- •2022 Весна. Общая химическая технология Вопросы для подготовки к экзамену
- •I. Теория химических процессов
- •Химические процессы
- •II. Теория химических реакторов
- •III. Химико-технологическая система и основы разработки эффективных хтс
- •Классификация элементов хтс проводится по их назначению.
- •Классификация связей (потоков)
- •Типы или структура связей
- •Модели хтс
- •Формы представления балансов:
- •Свойства хтс:
- •Система с фракционным рециклом
- •Концепция более полного использования сырьевых ресурсов решается путём:
Химические процессы
Химический процесс (ХПр) – сложное явление, в котором химическое превращение сопровождается массо-теплопередачей.
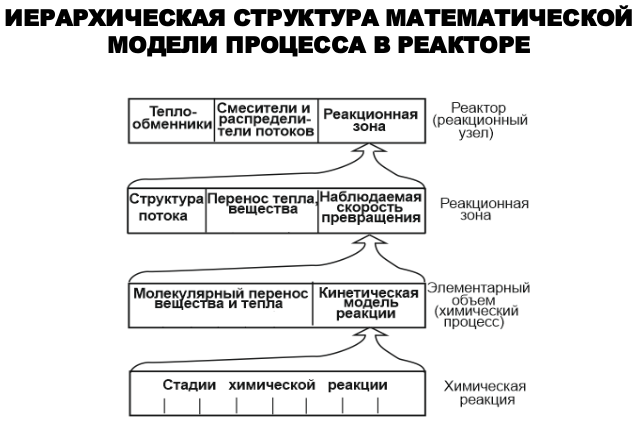
Классификация процессов по способу взаимодействия реагентов, фазовому признаку и т.д.
Наблюдаемая скорость превращения Wн, ее отличие от скорости химической реакции.
Таким образом, наблюдаемая скорость превращения является результатом наложения на химическую реакцию всех перечисленных факторов нехимической природы (плотность, вязкость, интеисивность явлений переноса вещества и тепла, размер частиц, их форма, пористая структура и тд.). При этом в конечном выражении для наблюдаемой скорости превращения всегда появляется известная из исходных данных, так называемая «наблюдаемая» концентрация реагирующего вещества.
Гомогенный химический процесс.
Определение
Гомогенным химическим процессом называют процесс, в котором все реагенты (участники химического превращения) находятся в одной фазе (газовой или жидкой) и в этой же фазе протекают химические превращения.
Примеры: хлорирование, сульфохлорирование углеводородов, нейтрализация кислоты и щелочи без образования твёрдой соли, окисление оксида азота в производстве азотной кислоты
Аналитические и графические зависимости скорости превращения (или реакции) от концентрации, степени превращения и температуры для простых необратимых и обратимых реакций.
Оптимальная температура и линия оптимальных температур.
Влияние концентрации, порядка реакций и температуры на дифференциальную селективность в сложной реакции.
Способы управления интенсивностью и селективностью процесса.
Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”.

Схема
и математическое описание процесса. 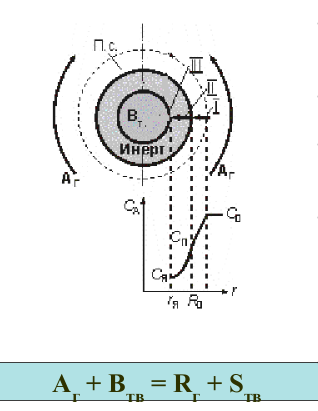
Твердая частица В в форме сферы радиусом R0, обтекается потоком газа А с концентрацией реагента в нем с0.
Частицу окружает пограничный слой газа.
Реакция начинается на поверхности и фронтально продвигается вглубь частицы
В какой-то момент времени частица будет состоять из ядра радиуса r, содержащего непрореагировавшее вещество В, и наружного слоя продукта или не реагирующего компонента (инерта).
Реакция протекает на поверхности ядра. В результате ядро уменьшается, но размер частицы (R0) сохраняется.




Лимитирующая стадия.

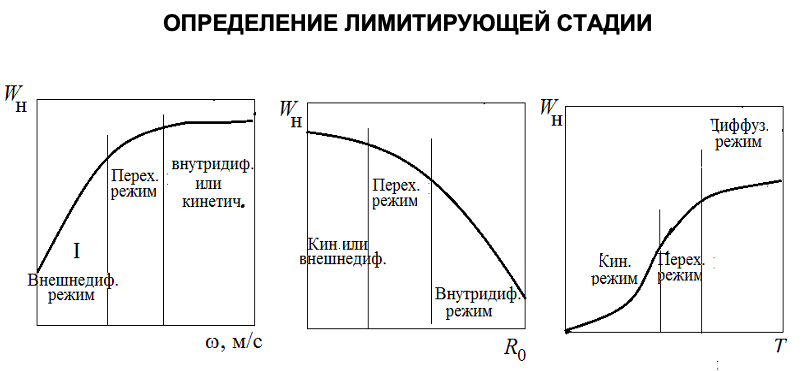
Наблюдаемая скорость и время полного превращения в кинетической, внутридиффузионной и внешнедиффузионной областях.

Способы интенсификации.

Каталитический процесс.
Определение катализа и катализатора.
Катализ – это явление ускорения химической реакции под влиянием веществ, называемых катализаторами.
Действие катализатора заключается в том, что он открывает новый реакционный путь. Не входя в стехиометрическое уравнение реакции, катализатор многократно вступает в химическое взаимодействие с участниками реакции с образованием промежуточных соединений. Образование любого из промежуточных соединений требует меньшей энергии активации, чем при проведении реакции в том же направлении в отсутствии катализатора. Катализатор восстанавливает свой химический состав после каждого цикла промежуточных взаимодействий.
Химический процесс в пористом зерне катализатора.
С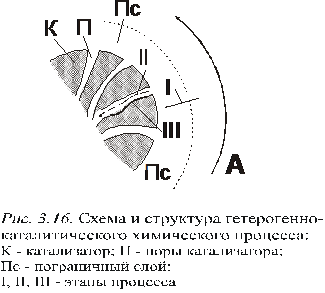 хема
и структура гетерогенно-каталитического
химического процесса:
хема
и структура гетерогенно-каталитического
химического процесса:
К – катализатор
П – поры катализатора
Пс – пограничный слой
I, II, III – этапы процесса
Схема процесса и математическое описание.

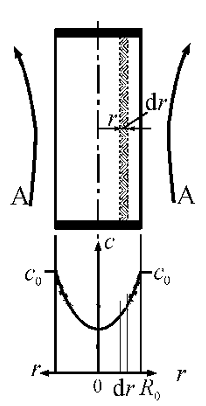
Математическая модель процесса
Допущения:
Форма зерна – плоская пластинка толщиной 2R0;
Пластинка омывается с боковых сторон (площадь каждой S) газом с концентрацией реагента С0;
Пренебрегаем внешнедиффузионным торможением в связи с интенсивным внешним переносом;
Перенос А в порах характеризуется эффективным коэффициентом диффузии Dэфф;
Протекает реакция 1-го порядка А→R и W(С) = – kC;
Условия процесса – изотермические и стационарные.

Общее решение дифференциального уравнения имеет вид:
![]()
Константы интегрирования А и В найдём из граничных условий
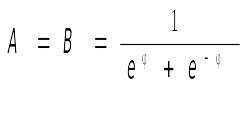
решение задачи распределение концентрации по глубине зерна:
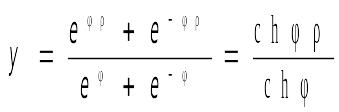
Наблюдаемая скорость превращения, возможные режимы.

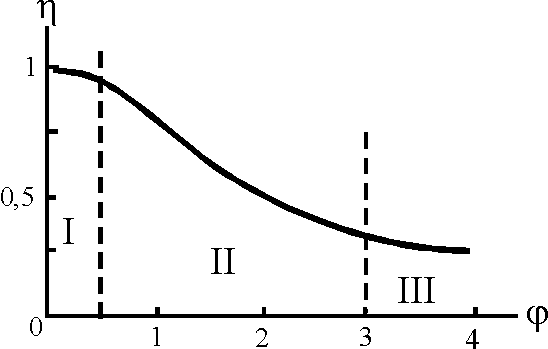
Коэффициент эффективности (степень использования внутренней поверхности) зерна катализатора и его зависимость от модуля Тиле-Зельдовича.
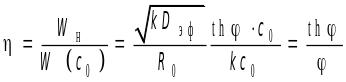
зависит
только от
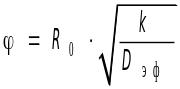
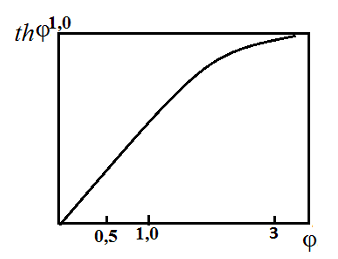
Зависимость степени использования внутренней поверхности катализатора от параметра . Пунктиры – примерные границы режимов: кинетического (I), переходного (II), внутридиффузионного (III)