
диссертации / 62
.pdf31
рургов используют систему APACHE II, 9% – SAPS и 3% – SOFA; общепринятые критерии Ranson и Glasgow применяют лишь 27% и 5% респондентов соответственно [121]. В преобладающем большинстве стационаров Российской Федерации основу составляют традиционные клинические и лабораторные данные. В некоторых лечебных учреждениях Великобритании при проверке точности выполнения национальных стандартов по лечению острого панкреатита выявлено, что только у 19% больных выполнена стратификация степени тяжести заболевания в течение 48 часов от момента госпитализации [402]. Тогда как внедрение в клиническую практику систем Ranson и APACHE II позволило S. Bank et al. (2002) снизить летальность от острого панкреатита за четырехлетний период с 13,8% до
8,0% [247].
Таким образом, оценка степени тяжести состояния больных с острым панкреатитом должна являться неотъемлемой частью их ведения и лечения. От правильной интерпретации клинических и лабораторных показателей, результатов инструментальных исследований зависит как тактика лечения больных с острым панкреатитом, так и прогноз развития, в первую очередь, инфекционных осложнений. В настоящее время отсутствуют разработанные системы прогнозирования вероятности развития инфекционных осложнений панкреонекроза.
1.2.1 Разработка и применение систем поддержки принятия решений для прогнозирования и диагностики в медицине
В последние годы много внимания исследователи уделяют использованию в сложных клинических случаях систем поддержки принятия решений (СППР) (в
англоязычной литературе – clinical decision support systems). CППР - компьютер-
ная автоматизированная система, целью которой является помощь людям, принимающим решение в сложных условиях для полного и объективного анализа предметной деятельности [265].
32
Известно, что при принятии медицинских решений проблемами являются недостаточность знаний, ограниченность временных ресурсов, отсутствие возможности привлечения большого числа компетентных экспертов, неполнота информации о состоянии больного [126]. При построении медицинских СППР обычно исходят из того, что человеческий организм – сложная биологическая функциональная система, которая входит как часть в более сложные системы. В настоящее время в медицине выделяют следующие типы систем поддержки принятия решений (СППР) в соответствии с направлениями их применения: в клинической практике – ассистирующие; в обучении и повышении квалификации – тестирующие и оппонирующие; в научных исследованиях – для решения задач анализа и оценки ситуации [50].
В настоящее время считается, что СППР в клинической медицине могут выполнять следующие функции: дифференциальная диагностика и выбор лечения; оценка эффективности решений вне зависимости от выраженности клинических проявлений болезни; учет фоновых состояний (сопутствующих заболеваний); анализ динамики патологического процесса; оценка состояния больного в режиме реального времени. Существенным моментом, определяющим практическую значимость СППР в клинической медицине, является ее эффективность в условиях различных ограничений: дефицита времени на принятие решения; неполноты данных о клинических проявлениях и анамнезе заболевания; неопределенности данных, которые не могут быть уточнены врачом; необходимости выбора дополнительных исследований по критериям диагностической эффективности и возможности их выполнения [50].
При ретроспективном взгляде на СППР с позиции проверки клинической практикой оценки отношения врачей к созданным ранее системам, анализа эффективности отдельных предложенных решений Б.А. Кобринским (2005) было заключено, что ССПР должны отличаться специфическими особенностями, при учете которых не только повышается их эффективность, но они становятся более привлекательными для врачей-пользователей. В этом плане особое значение
33
имеют следующие факторы: 1) психологическая совместимость врача и СППР, ощущение его участия в принятии решений; 2) уровень знаний врача; 3) возможность выбора режима диагностики из альтернативных вариантов [49].
В настоящее время сложилась определенная технология разработки интеллектуальных информационных систем, которая включает следующие шесть этапов: идентификация, концептуализация, формализация, конструирование и реализация, тестирование и опытная эксплуатация [38]. Этап идентификации связан с осмыслением тех задач, которые предстоит решить в будущей СППР. Результатом данного этапа является идентификация задачи: общие характеристики задачи, формулировка проблемы, определение целей и формирование требований к будущей СППР, ключевые понятия, предположительный вид решения [38]. Этап концептуализации предполагает содержательный анализ предметной области, выявление значимых факторов и их взаимосвязи, определение методов решения задач. Этот этап завершается созданием модели предметной области. Этап концептуализации включает решение следующих задач: определение входной и выходной информации; определение видов информации (тестовая, числовая, битовая); определение шкал измерения переменных; определение логических взаимоотношений между элементами входной и выходной информации (иерархия, причина – следствие, часть – целое и т.п.); используемые математические модели; процессы принятия решений, исследуемые в предметной области; типы ограничений, накладываемых на процессы [38].
Перспективным направлением создания СППР считается интеграция статистических пакетов прикладных программ (ППП) и системы управления базами данных (СУБД) на основе принципов системного анализа. Такая интеграция может обеспечить автоматизацию передачи данных по команде пользователя из СУБД в ППП для проведения необходимых расчетов, и обратно из ППП в СУБД, но уже с дополнительной информацией, полученной в процессе проведенного статистического анализа. Объединение ППП и баз данных в единую систему мо-
34
жет привести к синергетическому эффекту – существенному возрастанию эффективности их совместной деятельности [126].
Таким образом, современные технические возможности позволяют выйти на качественно новый уровень представления о течении того или иного заболевания, а именно на основе математических закономерностей смоделировать типовое развитие патологического процесса [2]. Следует констатировать, что на современном этапе развития медицины информационные нагрузки значительно возросли. Чтобы не жертвовать полнотой анализа информации необходимо шире использовать различные методы поддержки принятия решений [265]. Компьютерные медицинские системы позволяют врачу не только проверить собственные прогностические и диагностические предположения, но и использовать искусственный интеллект в сложных клинических случаях [37, 48].
Одним из примеров систем поддержки принятия решений являются системы, использующие программные реализации искусственных нейронных сетей
[37, 149]. Искусственные нейронные сети (англ. – artificial neural networks) явля-
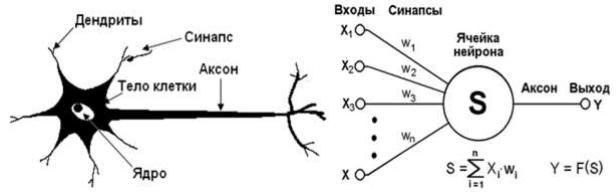
ются математическими моделями, позволяющими как правило несколько лучше классифицировать объекты, чем линейные модели [13, 91]. Метод построения ИНС базируется на некоторых принципах обработки информации в биологических системах (рис. 1).
а |
б |
а – биологический нейрон, б – искусственный нейрон |
|
Рисунок 1 – Аналогия биологического и искусственного нейронов
35
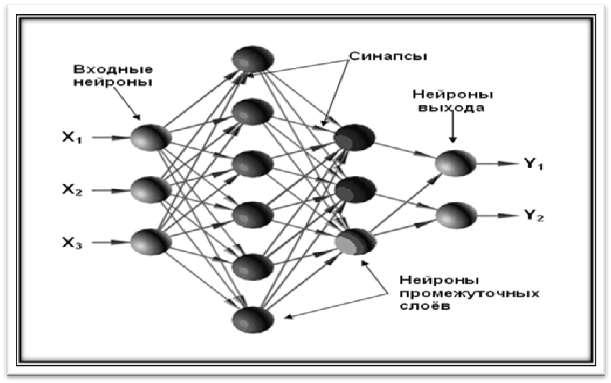
Основу каждой ИНС составляют относительно простые, в большинстве случаев однотипные элементы, имитирующие работу нейронов мозга. Каждый искусственный нейрон характеризуется своим текущим состоянием по аналогии с нервными клетками головного мозга, которые могут быть возбуждены или заторможены. Искусственный нейрон обладает группой «синапсов» – однонаправленных входных связей, соединенных с выходами других искусственных нейронов, а также имеет аксон – выходную связь данного нейрона, с которой сигнал (возбуждения или торможения) поступает на синапсы следующих искусственных нейро-
нов (рис. 2) [13].
Рисунок 2 – Схематическое строение искусственной нейронной сети
Для ИНС характерен принцип параллельной обработки сигналов, который достигается путем объединения большого числа нейронов в так называемые слои и соединения определенным образом нейронов различных слоев. Сила синаптических связей модифицируется в процессе извлечения знаний из обучающего набора данных (режим обучения), а затем используется при получении результата
36
на новых данных (режим исполнения) [91]. Нейронные сети позволяют принимать решения на основании выявляемых ими скрытых закономерностей в многомерных данных.
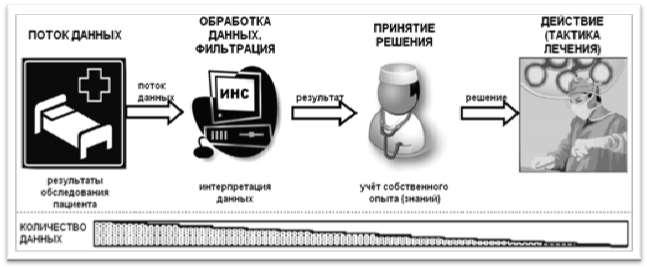
Нейронные сети нашли применение во многих областях техники, где они используются для решения многочисленных прикладных задач: в космонавтике, автомобилестроении, банковском деле, страховании, военном деле, робототехнике, при передаче данных и т.д. [14, 91]. Схематично процесс применения обученной ИНС в медицине показан на рисунке 3.
Рисунок 3 – Схема применения ИНС в медицине
Примеры использования компьютерного прогнозирования на основании технологии ИНС в медицине нельзя назвать единичными. Например, данная технология интеллектуального анализа данных применена N. Horowitz et al. (2007) в разработке диагностической анкеты для выявления гастроэзофагеальной рефлюксной болезни [180]. Были обследованы 132 пациента, и на основании полученных результатов построена компьютерная модель, позволившая выделить наиболее важные и достоверные признаки заболевания: изжога, отрыжка кислым, положительный эффект от антацидной терапии и ухудшение самочувствия после острой, жирной пищи. Чувствительность и специфичность данного метода составили 75%
37
и 78%. Y.C. Lee et al. (2007) использовали технологии интеллектуального анализа данных для прогнозирования снижения массы тела после хирургического лечения ожирения [347]. Ретроспективно были учтены данные 249 больных, оперированных с помощью разных методик: 177 женщин и 72 мужчины. 208 пациентов (83,5%) в течение двух лет после операции успешно снизили массу тела, тогда как у 41 больного (16,5%) эффекта не было. Созданная авторами компьютерная прогностическая модель позволяет ещё до операции выявить, будет ли ожидаемый эффект после неё и какой вид вмешательства предпочтительнее.
1.2.2 Современные возможности прогнозирования инфицированного панкреонекроза
Определение степени тяжести острого панкреатита и прогнозирование летального исхода при панкреонекрозе достаточно широко отражены в медицинской литературе, тогда как прогнозирование возможного развития панкреатической инфекции, несмотря на большую значимость этой проблемы – только в единичных исследованиях [190, 277, 288]. Прогнозирование панкреатической инфекции подразделяется на два этапа с точки зрения принятия тактических решений. При поступлении больного в стационар важно определить вероятность развития инфекционных осложнений с выделением группы больных, которым необходима целенаправленная профилактика панкреатической инфекции. Второй период наступает, когда имеется «вторая волна» ухудшения состояния больного на вто- рой-третьей неделе от начала заболевания, или не отмечается улучшения объективных показателей тяжести состояния, несмотря на проводимую интенсивную терапию, что чаще всего связано с развитием инфицированного панкреонекроза. На этом этапе важно своевременно выявить признаки инфекционных осложнений и перейти к достоверной диагностике панкреатической инфекции [255, 288].
H.G. Beger et al. (1986) показали, что частота инфекционных осложнений при панкреонекрозе коррелирует с продолжительностью болезни [190]. По их
38
данным, при операциях, выполненных по поводу панкреонекроза, инфицирование выявлено у 24% больных через одну неделю, 36% – через две недели и 72% – через три недели от момента заболевания. Сходные результаты получены S.G. Garza et al. (1987) [237]. Эти авторы, используя тонкоигольную аспирационную биопсию ткани поджелудочной железы при панкреонекрозе, выявили инфицирование в 22% случаев через одну неделю и у 55% больных через две недели от начала заболевания. Другая группа исследователей на большом клиническом материале обнаружила инфицирование ткани поджелудочной железы в 2,8% случаев в течение первой недели, у 28,8% и 39,7% больных панкреонекрозом в течение третьей и четвертой недель с момента заболевания [360].
Частота инфекционных осложнений также коррелирует с обширностью поражения поджелудочной железы, степенью панкреатического некроза [261, 289, 310]. H.G. Beger et al. (1986) впервые отметили высокую частоту панкреатической инфекции у 71% больных, у которых, по данным КТ, поражено более 50% ткани поджелудочной железы [190]. В настоящее время считается, что при панкреонекрозе, распространяющемся по данным КТ более чем на 50% ткани поджелудочной железы, наиболее вероятно развитие инфекционных осложнений [387]. У больных с острым панкреатитом и наличием одного положительного критерия по шкале Ranson панкреатическая инфекция выявлена в 5,3% случаев, тогда как при 5 баллах по шкале Ranson – 58,8% больных [359].
В настоящее время имеются данные, что существуют различия в частоте панкреатической инфекции в зависимости от этиологии заболевания [332]. A.S. Fung et al. (1997) обнаружили, что острый панкреатит чаще всего сопровождался инфекционными осложнениями после ЭРХПГ [258]. В результате другого исследования было установлено, что только лишь этиологические особенности острого панкреатита, без учета других факторов патогенеза заболевания, не могут определять риск развития панкреатической инфекции [281].
Повышение температуры тела, лихорадка всегда считались признаками инфекции. Но существует большой перечень заболеваний, которые сопровождаются
39
повышением температуры, не связанным с наличием какого-либо микробного агента. Инфицирование может проходить без лихорадки, особенно у больных пожилого и старческого возраста. Кроме того, нормальная или низкая температура тела могут отражать низкую сопротивляемость инфекции организма больного [199]. Тем не менее, лихорадка >38° C как проявление инфекционных осложнений, отмечена у половины больных, находящихся в отделениях интенсивной терапии и реанимации [197]. Тахикардия считается вторым стандартным признаком инфекции, причем, по данным некоторых исследователей, наиболее прогностически значимым [199]. Тахипноэ также считается достоверным признаком сепсиса, частота дыхания >20 в 1 мин установлена как нижняя граница, выше которой вероятность инфекционных осложнений многократно возрастает [198]. Лейкоцитоз является стандартным индикатором инфекции, лейкопения также может встречаться при прогрессировании инфекционного процесса, но имеет хуже прогноз [198]. Число лейкоцитов вместе с показателями температуры тела и уровнем мочевины используются в шкале прогнозирования инфекционных осложнений у больных после абдоминальных операций [317].
Все эти показатели (повышение температуры, тахикардия, тахипноэ, лейкоцитоз или лейкопения) являются критериями синдрома системной воспалительной реакции (ССВР) [198]. Использование показателей ССВР возможно для прогнозирования панкреатической инфекции [125]. ССВР обычно диагностируется, если два критерия из четырех присутствуют на одном отрезке времени [198]. Критерии ССВР оценены в проспективном исследовании с целью выявления прогностических возможностей для бактериемии. Бактериемия у хирургических больных встречалась чаще (55% случаев) с более высоким уровнем летальности, чем у больных, у которых ССВР не определялся [293]. ССВР имел положительную прогностическую значимость 71% для прогнозирования инфекционных осложнений у хирургических больных [389].
По данным В.С. Савельева с соавт. (1999), критерии ССВР-3 и ССВР-4 установлены во всех клинических группах больных с тяжелым острым панкреа-
40
титом, но частота их достоверно ниже при стерильном панкреонекрозе по сравнению с инфицированными формами [125]. Диагностируемые в динамике критерии ССВР позволяют выделить группу больных с большей вероятностью развития инфицированного панкреонекроза. Выявление ССВР у больных во второй фазе течения заболевания должно нацеливать врача на активную диагностику панкреатической инфекции и сепсиса [117, 125].
С 1930 г. используется в клинической практике С-реактивный белок. СРБ является острофазовым протеином, концентрация которого возрастает в плазме крови при воспалении [257]. Несмотря на то, что СРБ является неспецифическим маркером воспаления, отмечена возможность его использования для прогнозирования и контроля эффективности лечения панкреатической инфекции [409], СРБ также может быть индикатором абдоминального сепсиса [257].
Хорошей прогностической возможностью развития инфекционных осложнений обладают интерлейкины – IL-6, IL-8, IL-10 и др. [257, 280, 396]. Однако их использование в клинической практике ограничено высокой стоимостью, отсутствием многоцентровых исследований, доказывающих эффективность [257]. Прокальцитониновый тест в последнее время считается наилучшим маркером для дифференциальной диагностики между стерильным и инфицированным панкреонекрозом [396]. C.A. Muller et al. (2000) показали, что уровень прокальцитонина был недостаточно прогностически значимым для раннего предсказания инфицированного панкреонекроза [368].
В литературе описаны только две шкалы по прогнозированию непосредственно инфекционных осложнений, сепсиса – IPS, NOSEP [199, 306]. Система
IPS (Infection Probability Score) разработана D.P. Bota et al. (2003); в нее входят общепринятые критерии инфекции: температура тела, частота пульса, частота дыхания, лейкоциты крови, СРБ, SOFA [199]. Шкала IPS, по заключению авторов, имеет положительную прогностическую значимость – 53,6%, используя ее можно предсказать отсутствие инфекции при числе баллов <14 с точностью 89,5% [199].
