
- •I.Ферменты: определение понятия, химическая природа, физико-химические свойства и биологическая роль ферментов.
- •II.Изоферменты. Строение, биологическая роль, диагностическое значение определения.
- •III. Особенности ферментативного катализа. Механизм, стадии ферментативного катализа.
- •IV. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН, концентрации субстрата. Особенности ферментов полости рта
- •V.Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное.Ингибиторы ферментов в полости рта.
- •VI. Регуляция активности ферментов: неспецифическая, специфическая (понятия). Механизмы специфической регуляции активности ферментов:
- •VI. Классификация и номенклатура ферментов: систематические и рабочие названия.
- •VIII.Энзимопатии: понятие, классификация, молекулярные причины возникновения и механизмы развития, последствия, биохимическая диагностика
- •9. Энзимодиагностика, медико-биологическое значение
- •Ферменты крови в энзимодиагностике
- •10.Биохимические основы энзимотерапии. Ферменты –лекарственные препараты в полости рта
- •11.Этапы унифицирования энергии пищевых веществ и образования субстратов биологического окисления.
- •12 Цикл Кребса – биологическое значение, схема реакций, ферменты, коферменты, энергетический баланс одного оборота. Регуляция
- •Энергетический баланс одного оборота цтк
- •Хемиосмотическая теория Митчелла
- •15 Микросомальное биологическое окисление (система транспорта электронов, цитохромы р-450, в-5); биологическое значение, регуляция, клеточная и тканевая локализация ферментов в органах и полости рта
- •1. Ферментативная антиоксидантная система
- •2. Неферментативная антиоксидантная система
- •17. Углеводы пищи и организма человека: классификация, биологические функции, принципы нормирования суточной пищевой потребности.
- •20. Пути обмена галактозы в организме в норме, механизм развития галактоземи метаболические нарушения, биохимические и клинические проявления
- •21. Нормогликемия, пути превращения углеводов в клетках организма и ключевая роль глюкозо-б-фосфата.
- •Общие реакции аэробного и анаэробного гликолиза
- •Реакция анаэробного гликолиза
- •23. Аэробный путь окисления глюкозы: энергетический баланс, коферменты пируватдегидрогеназного комплекса
- •25. Гипогликемия: биохимические причины возникновения, механизмы восстановления нормогликемии (фосфоролиз гликогена, глюконеогенез,)
- •26. Гипергликемия: биохимические причины возникновения, механизмы восстановления нормогликемии
- •27. Контринсулярные гормоны (глюкагон, адреналин, кортизол): химическая природа, молекулярные механизмы участия в углеводном обмене
- •28. Инсулин: строение, молекулярные механизмы и механизм действия на метаболические процессы
- •Физиологические эффекты
- •Изменения метаболизма при сд I типа
- •Симптомы сд I типа
- •Симптомы сд II типа
- •Изменения метаболизма при сд II типа
- •31.Изсд и инзсд: механизмы развития патохимических нарушений, сходство и отличие в отклонении биохимических показателей. Изменение гематосаливарного барьера и состояния полости рта при диабете
- •Диабет и пародонтит
- •Пародонтит симптомы
- •Диабет и кариес
- •Диабет и грибковые инфекции полости рта
- •32. Глюкозотолерантный тест, методика проведения, диагностическое значение
- •Условия проведения
- •Методика проведения
- •Оценка результата
- •33) Важнейшие липиды пищи и организма человека: классификация, физико-химические свойства, биологическая роль. Принципы нормирования суточной потребности липидов.
- •34) Переваривание липидов в желудочно-кишечном тракте: роль гормонов, ферментов, желчных кислот. Понятие: энтерогепатическая циркуляция.
- •5. Мицеллообразование
- •35) Транспортные липопротеиды крови классификация (по плотности, электрофоретической подвижности, по апопротеинам), место синтеза, функции, диагностическое значение.
- •4. Моноацилглицероловый путь синтеза тг и фл
- •5. Глицерофосфатный путь синтеза тг и фл
- •Транспорт липидов в организме
- •Основные виды липопротеинов
- •Нормальные значения холестерина
- •Нормальные значения
- •36) Хиломикроны (хм), место синтеза, состав, обмен хиломикронов в абсорбтивный период.
- •1. Абеталипопротеинемия (синдром Бассена-Корнцвейга)
- •37) Липопротеины очень низкой плотности(лпонп), место синтеза, состав, обмен в постабсорбтивный период.
- •2. Семейная гиперхолестеролемия (гиперлипопротеинемия типа iIа и iIв)
- •38) Липопротеины низкой плотности (лпнп), место синтеза, состав, биологическая роль, биохимические причины патологии обмена.
- •39) Липопротеины высокой плотности (лпвп), место синтеза, состав, биологическая роль, биохимические причины патологии обмена.
- •40) Липолиз триглицеридов в белой и бурой жировой ткани: Механизмы β - окисления жирных кислот Регуляция.
- •Развитие жировой ткани
- •Химический состав белой жировой ткани
- •Особенности метаболизма белой жировой ткани
- •Энергетический баланс окисления насыщенных жк с четным количеством атомов углерода
- •Энергетический баланс окисления насыщенных жк с нечетным количеством атомов углерода
- •Энергетический баланс окисления ненасыщенных жк с четным количеством атомов углерода
- •Регуляция скорости β-окисления жк
- •Окисление жк в пероксисомах
- •41) Пути обмена АцКоА, Кетоновые тела:, биологическая роль, Кетонемия, кетонурия, причины и механизмы развития, последствия. Кетоновые тела
- •42) Обмен холестерина в организме человека. Регуляция. Холестерин
- •43) Атеросклероз: биохимические причины, факторы риска, лабораторная диагностика риска развития атеросклероза: обмена и развития его нарушений. Атеросклероз
- •44) Липогенез, направления в организме человека, гормональная регуляция, клеточные механизмы липогенеза (печень, жировая ткань).
- •Роль белка в питании. Показатели качества пищевого белка
- •Количество белка в некоторых пищевых продуктах
- •3. Азотистый баланс. Принципы нормирования белка в питании. Белковая недостаточность
- •Нормы белка в питании
- •Белковая недостаточность
- •Переваривание белков в желудке
- •Состав желудочного сока
- •48. Переваривание белков в кишечнике: гормоны секретин, холецистокинин,ферменты, всасывание аминокислот.
- •50. Реакция дезаминирования : в организме человека. Биологическое значение. Пути использования безазотистого остатка аминокислот (глюконеогенез, цт к). Дезаминирование аминокислот
- •Прямое дезаминирование ак
- •2. Оксидаза l-аминокислот
- •3. Оксидаза d-аминокислот
- •Пути обмена безазотистого остатка аминокислот
- •51. Пути использования и обезвреживания аммиака (образование глн, цикл мочевины, регуляция). Причины токсичности аммиака.
- •Связывание (обезвреживание) аммиака
- •Орнитиновый цикл
- •52. Частные пути обмена аминокислот: обмен и биологическая роль глу, глутамина.
- •53. Частные пути обмена аминокислот: обмен и биологическая роль серина и глицина. Обмен серина и глицина
- •Путь образования оксалатов из глицина
- •54. Частные пути обмена аминокислот: обмен и биологическая роль цистеина, метионина. Метионин
- •Цистеин
- •55. Частные пути обмена аминокислот: обмен и биологическая роль фенилаланина и тирозина. Фенилаланин
- •Тирозин
- •1. Обмен тирозина в надпочечниках и нервной ткани
- •2. Обмен тирозина в меланоцитах
- •3. Превращение тирозина в щитовидной железе
- •5. Катаболизм тирозина в печени
- •56. Биохимические механизмы патологии обмена фен и тир, клинические проявления.
- •Гормоны
- •Классификация и номенклатура гормонов
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по месту синтеза
- •3. Классификация гормонов по биологическим функциям
- •Принципы организации нейроэндокринной системы
- •59. Рецепция и механизмы действия стероидных гормонов. Обмен стероидных гормонов
- •60. Рецепция и механизмы действия пептидных гормонов. Обмен пептидных гормонов
- •61. Общий адаптационный синдром (оас): стадии, роль гормонов и изменения направления метаболизма в реализации адаптивных процессов в организме.
- •62. Механизмы действия гормонов: тропные гормоны гипофиза; стг, лтг - химическая природа, метаболические и физиологические эффекты
- •63. Механизмы действия «оси» ттг - тиреоидные гормоны, синтез, обмен, патология обмена. Метаболизм йода в организме. Обмен тиреоидных гормонов Гипоталамо-гипофизарно-тиреоидная ось
- •64. Механизмы действия «оси» актг(адренокортикотропный гормон) - глюкокортикостероиды, синтез, обмен, патология обмена
- •Нарушения обмена кортикоидов Гипофункция коры надпочечников
- •Первичная недостаточность надпочечников (болезнь Аддисона)
- •Вторичная недостаточность надпочечников
- •Врождённая гиперплазия надпочечников
- •Гиперпродукция глюкокортикоидов (гиперкортипизм)
- •Белки плазмы крови
- •Ферменты плазмы крови
- •I. Альбумины
- •ФункциИ эритроцитов
- •Строение эритроцитов
- •Химический состав эритроцитов
- •1. Плазмолемма эритроцитов
- •2. Цитоплазма эритроцитов
- •Особенность обмена веществ и энергии в эритроците
- •1. Особенность белкового обмена в эритроцитах
- •2. Особенность обмена нуклеотидов в эритроцитах
- •3. Особенность липидного обмена в эритроцитах
- •4. Особенность углеводного обмена в эритроцитах
- •5. Энергетический обмен в эритроцитах
- •6. Обезвреживание активных форм кислорода в эритроцитах
- •7. Обмен метгемоглобина
- •Синтез гемоглобина
- •Строение гемоглобина
- •Функции гемоглобина
- •Производные гемоглобина
- •Катаболизм гемоглобина
- •72 Обмен железа в организме человека, биологическое значение
- •73 Биохимические функции почек, особенности метаболических процессов в почках.
- •74 Биохимические особенности мочеобразования на этапах фильтрации, реабсорбции, секреции
- •1. Клубочковая фильтрация
- •2. Канальциевая реабсорбция
- •3. Канальциевая секреция
- •75 Состав первичной и конечной мочи, физико – химические показатели в норме. Клиренс: понятие, виды. Патологические компоненты мочи
- •76 Ренин-ангиотензин-альдостероновая система (раас) в поддержании гомеостаза натрия. Механизм действия альдостерона на молекулярном уровне в почке и слюнных железах
- •77 Антидиуретический гормон и регуляция водного баланса организма.
- •78 Биохимические гомеостатические функции печени.
- •79 Функциональные пробы и нагрузки характеризующие состояние углеводного, липидного, белкового обмена и детоксицирующей функции печени.
- •80 Обмен билирубина в норме и патологии: виды желтух. Диагностическое значение определения билирубина в крови и моче.
III. Особенности ферментативного катализа. Механизм, стадии ферментативного катализа.
Ферменты катализируют только энергетически возможные реакции. Любой катализатор (в т.ч. фермент) в процессе реакции не расходуется, не изменяет состояние равновесие, направление реакции в процессе катализа измениться не может.
К особенностям ферментативного катализа по сравнению с неорганическим катализом относятся:
* высокая специфичность
* высокие скорости реакций
* возможность регуляции скорости реакции
* физиологические условия катализа (температура 36-38 0 С, рН 6,9 – 7,5)
Особенности ферментативного катализа обусловлены строением ферментов и их белковой природой.
Механизм ферментативной реакции
Теория промежуточных состоянии -Катализаторы не изменяются в процессе реакции, но принимают участие в образовании промежуточных соединений, вызывая понижение энергии активации
Э. Фишер в конце Х1Х в. Теория соответствия пространственного строения фермента и субстрата подобно «замку и ключу».
В середине 50 гг. ХХ в. Д. Кошланд выдвинул более совершенную концепцию индуцированного взаимодействия фермента и субстрата. Согласно этой теории, контакт субстрата и фермента осуществляется только после изменения их пространственного строения под влиянием друг друга и возникновения пространственного и электронного соответствия.
более современная теория топохимического взаимодействия, которая предполагает следующую последовательность:
а) в первую очередь, фермент «узнает» у субстрата те участки, которые не будут изменяться в процессе биохимической реакции,
б) образует с ними водородные связи и гидрофобные взаимодействия,
в) изменяется пространственное строение и распределение и электронной плотности,
г) далее «включается» действие каталитического участка, чтобы осуществить биохимическую реакцию.
Стадии:
1 стадия. Энзим Е взаимодействует с субстратом S, образуется энзим – субстратный комплекс [Е S]. На стадии (1) участвует субстратный, связывающий центр.
2 стадия. В составе комплекса [Е S] происходит изменение электронного и пространственного строения субстрата под влиянием белка, субстрат переходит в возбужденное состояние [ЕS * ]. Очевидно, в этом принимает участие и каталитический центр (реакция2). Возбужденных состояний [ЕS * ]
3 стадия. Снижается энергия активации, в каталитическом центре происходит превращение субстрата в продукт реакции [ЕР*], который тоже находится еще в возбужденном состоянии (реакция 3).
4 стадия. Далее происходит стабилизация продукта Р (реакция 4 ) и отделение его от фермента (реакция 5).
Е + S —(1)—> [Е S] —(2)—> [ Е S *] —(3)—> [ Е P*] —(4)—> [Е Р] — (5)—> Е + Р
IV. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН, концентрации субстрата. Особенности ферментов полости рта
Скорость ферментативной реакции зависит от факторов:
* температуры
* величины рН среды
* концентрации энзима (зависимость линейная)
* концентрации субстрата (зависимость вначале линейная потом постоянная)
Влияние температуры на скорость ферментативной реакции.
У каждого фермента своя оптимальная температура. Vмах- в области оптим.температуры.
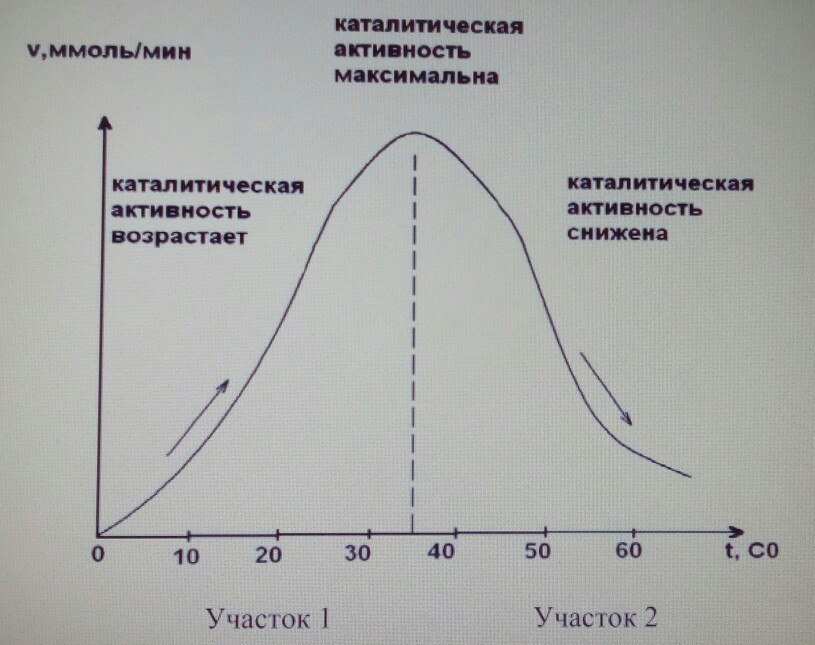
В полости рта непрерывно происходят колебания температурного режима при дыхании, приеме пищи, у курильщиков– при курении (!), возникают огромные для биологических тканей перепады температуры. Хронические длительные термические воздействия в полости рта могут быть одной из причин провокации злокачественного перерождения тканей.
Влияние значения рН на скорость ферментативной реакции
У каждого фермента есть свое оптимальное значение рН, что связано с физиологическими условиями функционирования ферментов. Пепсин желудочного сока наиболее активен при рН= 1,0 – 1,5,трипсин, выделяемый поджелудочной железой в просвет 12-перстной кишки – в слабощелочной среде, щелочная фосфатаза – в сильно щелочной среде.
Vмах-при оптимальном рН
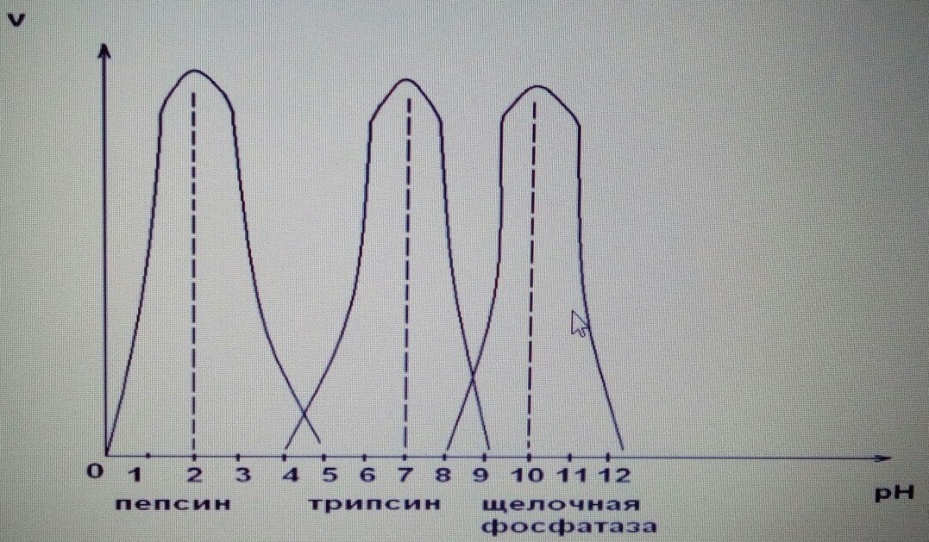
В полости рта непрерывно происходят колебания значения рН в процессе приема пищи, за счет деятельности микрофлоры и, особенно, при курении (!) за счет выделения СО 2 в процессе горения табачного изделия. Буферные свойства слюны поддерживают постоянство значения рН в пределах 6,5 – 7,2 , что необходимо для сохранения функции ферментов слюны, активности лейкоцитов и иммуноглобулина А, которые создают комплекс факторов защиты полости рта для предотвращения резорбции эмали и поддержания свойств эпителия слизистых тканей.
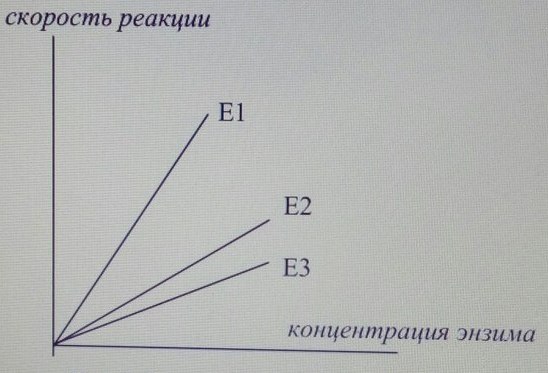
Влияние концентрации энзима на скорость ферментативной реакции
Чем больше концентрация энзима, тем больше скорость ферментативной реакции. Для изоферментов графики зависимости имеют отличия - различные углы наклона (вследствие разницы в значениях КМ – константы Михаэлиса). На рисунке представлены зависимости скорости реакции от концентрации энзима для трех изоферментов. Понятно, что скорость реакции Е1 > Е 2 > Е3 (определяется значением угла наклона)
Влияние концентрации субстрата на скорость ферментативной реакции
Скорость ферментативной реакции зависит от концентрации субстрата. До определенного значения концентрации скорость реакции повышается вначале линейно, затем линейная зависимость исчезает и скорость становится постоянной, достигнув максимального значения V мах.
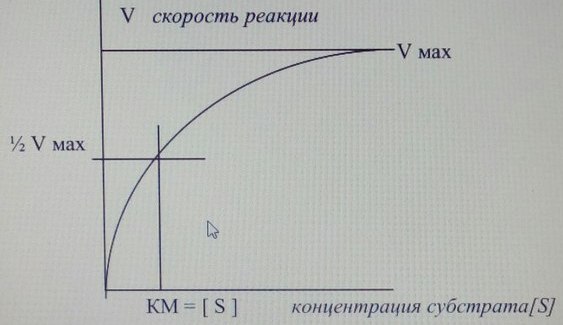
Обнаруженная зависимость подтверждает механизм ферментативной реакции в отношении образования фермент- субстратного комплекса. При определенной концентрации субстрата наступает насыщение активных центров субстратом.
Л.Михаэлис и его коллега М. Ментен (1913 г.) предложили использовать значение Км для оценки ферментативной активности и скорости реакции. Константа Михаэлиса (Км) численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимальной скорости ( ½ V мах). чем меньше значение Км, тем больше скорость реакции. чем больше значение Км, тем меньше скорость реакции.
