
- •Предпосылки возникновения квантовой физики
- •1.Предпосылки создания квантовой механики
- •1.1Волны де Бройля
- •1.1 Волны де Бройля
- •1.1 Волны де Бройля
- •1.1.1. Длина волны де Бройля и импульс частицы.
- •1.1.1. Длина волны де Бройля и импульс частицы.
- •1.1.1. Длина волны де Бройля и импульс частицы.
- •1.1.1. Длина волны де Бройля и импульс частицы.
- •1.1.1. Длина волны де Бройля и импульс частицы.
- •1.1.1.Длина волны де Бройля и импульс частицы.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.2. Соответствие гипотезы де Бройля СТО.
- •1.1.3. Гипотеза де Бройля. Основные результаты.
- •1.1.3. Гипотеза де Бройля. Основные результаты.
- •1.1.4. Экспериментальная проверка гипотезы де Бройля.
- •1.1.4. Экспериментальная проверка гипотезы де Бройля.
- •1.1.4. Экспериментальная проверка гипотезы де Бройля.
- •1.Предпосылки создания квантовой механики.
- •Модель атома Томсона
- •Усовершенствованная модель атома Томсона
- •Модель атома Нагаоке
- •Планетарная модель атома
- •Быть может, эти электроны - миры, где пять материков,
- •1.3.Опыты
- •Эрнест Резерфорд (1871 - 1937)
- •Исследование a-частиц
- •Рассеяние a-частиц золотой фольгой
- •Рассеяние a-частиц золотой фольгой
- •Рассеяние a-частиц золотой фольгой
- •Рассеяние a-частиц золотой фольгой
- •И все-таки они вертятся?
- •1.4.Правило
- •Что общего у атома и квантов?
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •Правило квантования Бора - Зоммерфельда
- •1.5.Боровская теория атома водорода.
- •Боровская теория водородоподобного атома
- •Боровская теория водородоподобного атома
- •Боровская теория водородоподобного атома
- •Боровская теория водородоподобного атома
- •Боровская теория водородоподобного атома
- •Схема энергетических уровней атома водорода
- •Постулаты Бора
- •Постулаты Бора
- •Постулаты Бора
- •При поглощении энергии атомом электрон переходит с внутренней орбиты на внешнюю, более далекую
- •1.6.Экспериментальные
- •Оптические спектры испускания атомов
- •Применение спектрального анализа
- •Как проверить?
- •Схема
- •Опыт Франка и Герца.
- •Опыт Франка и Герца.
Боровская теория водородоподобного атома
Итак, энергия электрона в водородоподобном атоме может принимать ряд дискретных значений
Здесь n – целое число.
При этом, согласно боровской теории, электрон в водородоподобном атоме может находиться на орбитах с радиусами
Состояние атома с наименьшей энергией (что соответствует n = 1) называется основным состоянием. Энергия основного состояния
Энергию произвольного состояния с любым номером n удобно выражать через энергию основного состояния:
Боровская теория водородоподобного атома
Радиус орбиты произвольного состояния с любым номером n удобно выражать через радиус первой бороской орбиты:
Для атома водорода (Z = 1)

Схема энергетических уровней атома водорода
 1=−12(4 1 0 )2 2 4 .
1=−12(4 1 0 )2 2 4 .

Постулаты Бора |
1. Атом может |
|
находиться только в |
|
дискретных |
|
устойчивых |
|
состояниях, |
|
характеризуемых |
|
определенными |
|
дискретными |
|
значениями энергии. В |
|
устойчивых состояниях |
|
атома электроны |
|
движутся вокруг ядра |
|
по определенным |
|
(“дозволенным”) |
|
орбитам, причем |
|
радиусы этих орбит |
|
соответствуют |
|
возможным значениям |
|
энергии атома. |
Постулаты Бора
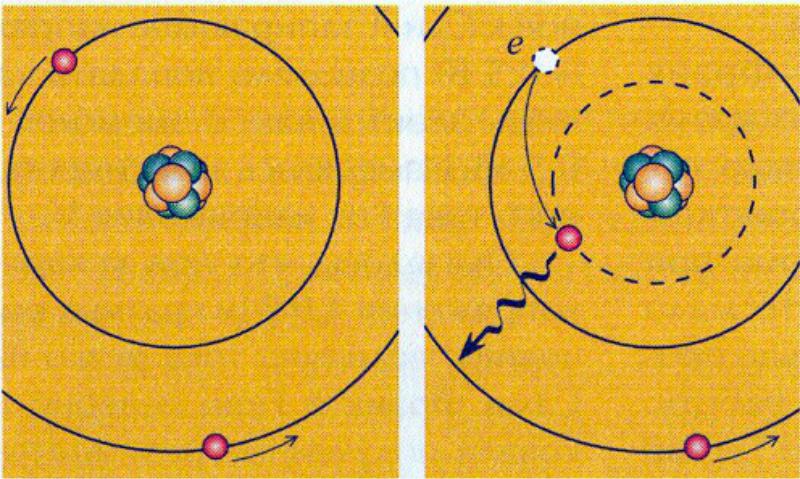
2. При движении по “дозволенным” орбитам электроны — вопреки классической электродинамике — не излучают электромагнитных волн. Излучение может происходить только при переходе электрона с одной “дозволенной” орбиты на другую.

Постулаты Бора
3. Испускание и поглощение энергии атомом происходит “скачками”, каждый из которых представляет собой порцию (квант энергии), кратную h .

При поглощении энергии атомом электрон переходит с внутренней орбиты на внешнюю, более далекую от ядра. При обратном переходе атом излучает порцию энергии.

1.6.Экспериментальные
подтверждения боровской теории атома водорода.

Оптические спектры испускания атомов
1
2
3
Линейчатые спектры испускания:
1 - водород; 2 - азот; 3 - светильный газ.

