
- •Техническая термодинамика и основы теории теплообмена
- •2. Измерить температуру термоэлектрическим термометром.
- •1.2. Биметаллические преобразователи температуры.
- •1.3. Манометрические термометры.
- •1.4. Термометры, основанные на температурной зависимости электрического сопротивления.
- •1.5. Пирометры излучения.
- •1.6. Термоэлектрические термометры.
- •2. Описание лабораторного стенда и порядок выполнения работы.
- •3. Контрольные вопросы.
- •Изохорный процесс.
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропные процессы.
- •Измерение теплоёмкости воздуха
- •Определение теплопроводности твердых материалов методом плоского слоя
- •2. Определить зависимость коэффициента теплопроводности от температуры
- •2.1. Теплоотдача от горизонтальной трубы (поперечное обтекание).
- •2.1.1.Описание лабораторного стенда.
- •Плотность.
- •Температурный коэффициент объёмного расширения.
- •Коэффициент теплопроводности.
- •Коэффициент кинематической вязкости.
- •2.2. Теплоотдача от вертикальной трубы (продольное обтекание).
- •2.2.1.Описание лабораторного стенда.
- •Переходный режим (2320Re104).
- •Закон Планка.
- •Закон смещения Вина.
- •Закон Стефана – Больцмана.
- •Закон Кирхгофа
Изохорный процесс.
При изохорном процессе выполняется
условие
![]() или
или![]() .
Из уравнения состояния идеального газа
следует, что
.
Из уравнения состояния идеального газа
следует, что
![]() .
.
Таким образом,
![]() - уравнение процесса.
- уравнение процесса.
На рис. 1 представлен график процесса в p-vиT-Sкоординатах.
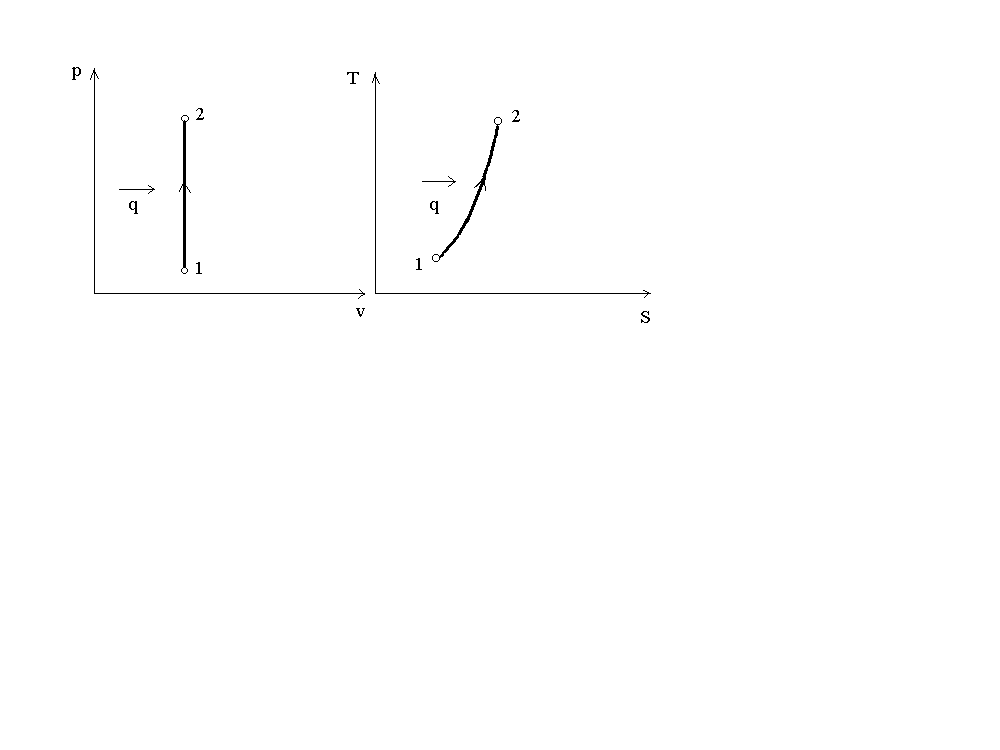
Рис.1. График изохорного процесса
Работа изменения объёма

Количество теплоты, участвующей в процессе:
![]() при постоянной теплоемкости
при постоянной теплоемкости![]() ;
;
![]() при переменной теплоемкости
при переменной теплоемкости![]() .
.
Изменение внутренней энергии системы:
Согласно 1-му закону термодинамики
![]() ,
,
но т.к.
![]() ,
то
,
то![]() .
.
Тогда
![]() .
.
Таким образом, в изохорном процессе вся теплота, подводимая к системе, затрачивается на изменение её внутренней энергии.
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то и для любого термодинамического процесса идеального газа:
![]()
Изменение энтропии:
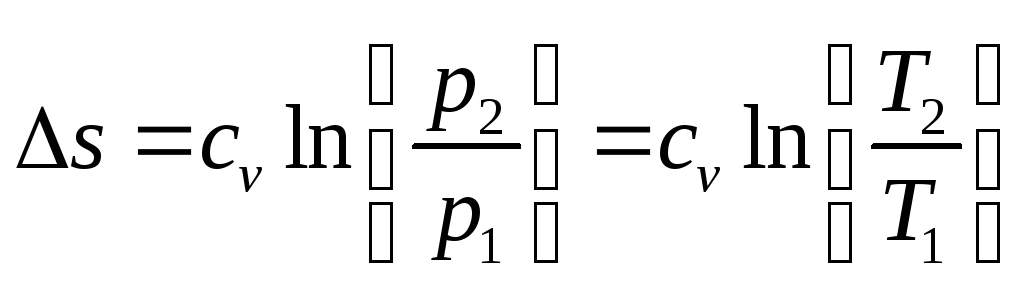
Изобарный процесс
При изобарном процессе выполняется
условие
![]() или
или![]() .
Из уравнения состояния идеального газа
следует, что
.
Из уравнения состояния идеального газа
следует, что
![]() .
.
Таким образом,
![]() - уравнение процесса.
- уравнение процесса.
На рис. 2 представлен график процесса в p-vиT-Sкоординатах.
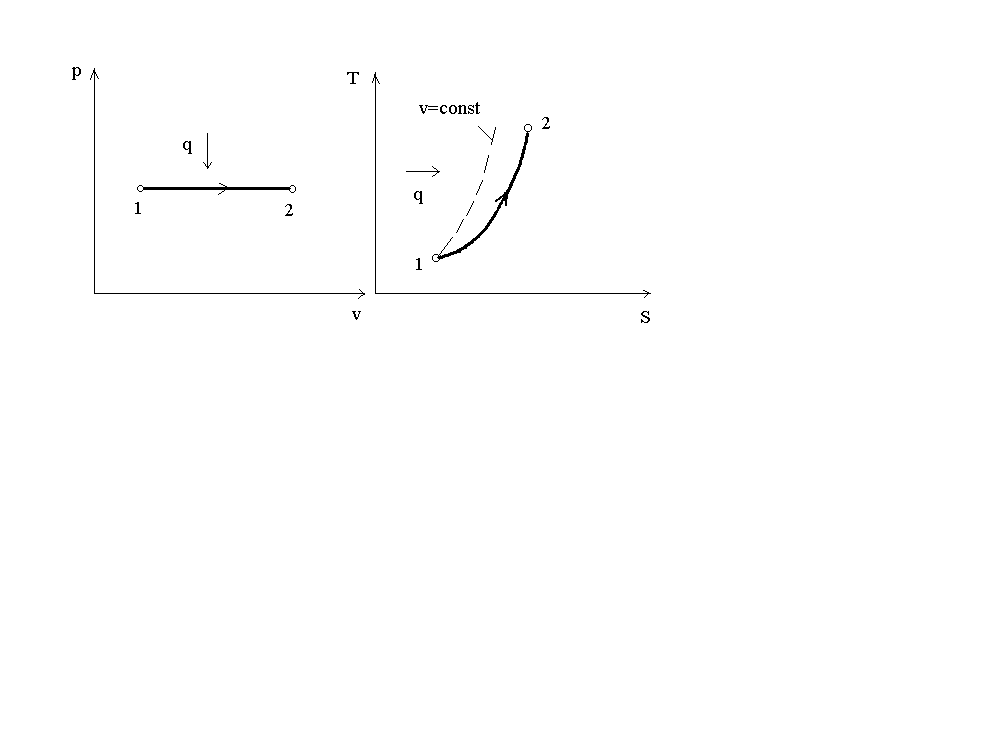
Рис. 2. График изобарного процесса
Работа изменения объёма
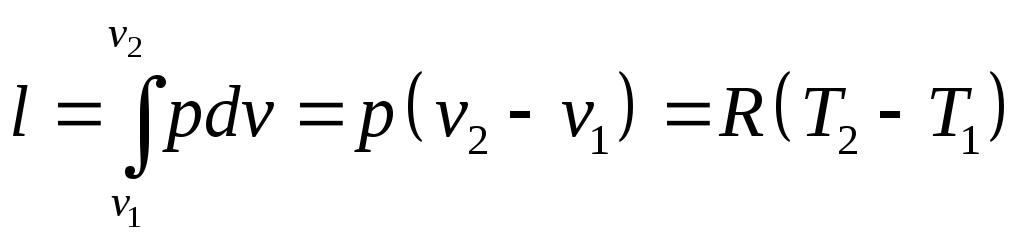
Количество теплоты, участвующей в процессе:
![]() при постоянной теплоемкости
при постоянной теплоемкости![]() ;
;
![]() при переменной теплоемкости
при переменной теплоемкости![]() .
.
Изменение внутренней энергии системы:
![]()
Изменение энтропии:
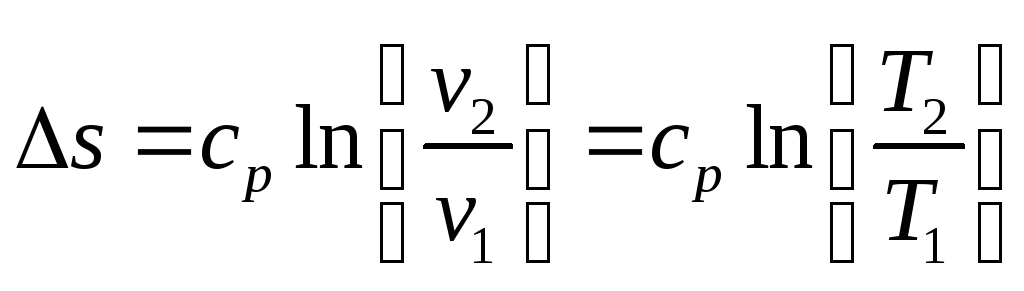
Изотермический процесс
При изотермическом процессе выполняется
условие
![]() или
или![]() .
Из уравнения состояния идеального газа
следует, что
.
Из уравнения состояния идеального газа
следует, что
![]() .
.
Таким образом,
![]() - уравнение процесса.
- уравнение процесса.
На рис. 3 представлен график процесса в p-vиT-Sкоординатах. Вp-vкоординатах графиком процесса является равнобокая гипербола.
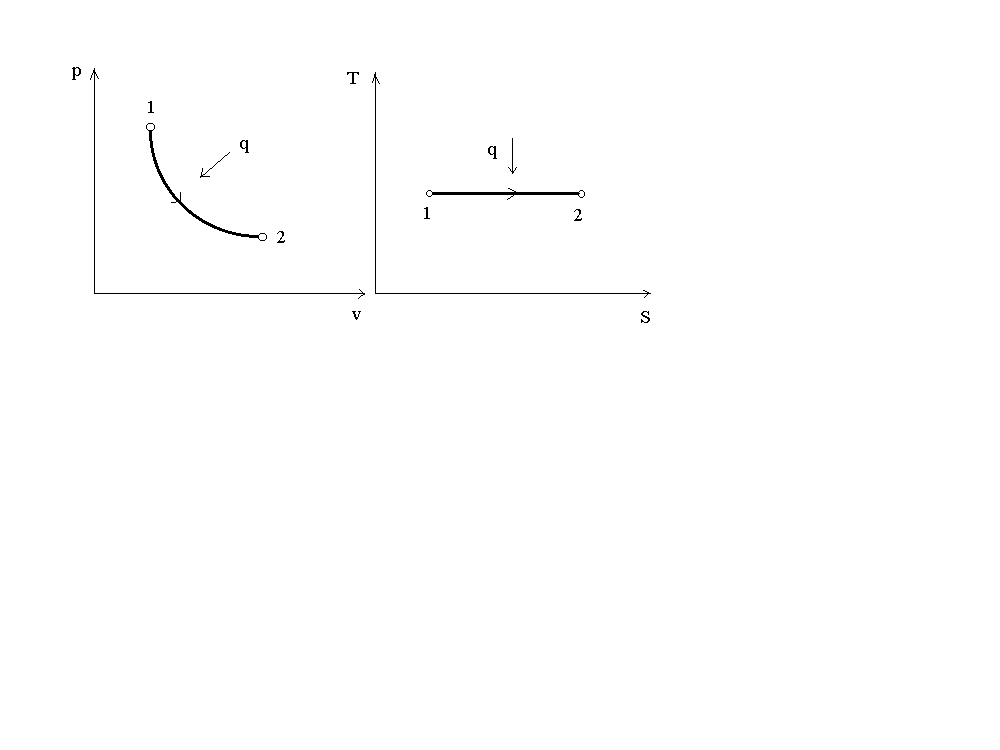
Рис.3. График изотермического процесса
Работа изменения объёма:
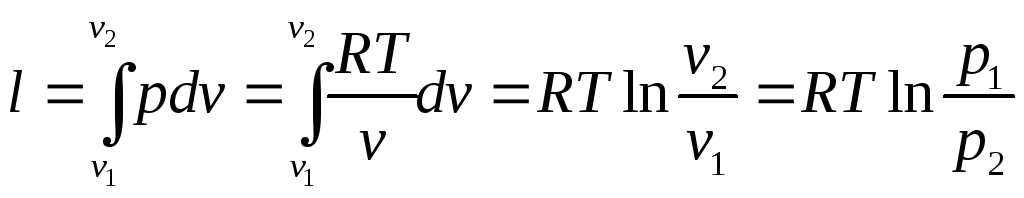
Изменение внутренней энергии системы:
![]() .
.
Количество теплоты, участвующей в процессе:
Согласно 1-му закону термодинамики
![]() ,
,
но т.к.
![]() ,
то
,
то![]() .
.
Таким образом, в изотермическом процессе вся теплота, подводимая к системе, затрачивается на совершение работы изменения объёма.
Изменение энтропии:
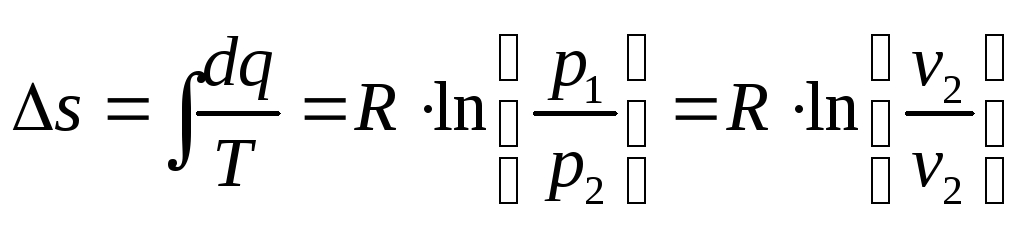
Адиабатный процесс
Процесс, происходящий без
теплообмена с окружающей средой,
называетсяадиабатным.
Таким образом, условие адиабатного
процесса![]() .
.
Для того, чтобы выполнялось данное условие, следует либо теплоизолировать газ, т.е. поместить его в адиабатную оболочку, либо провести процесс настолько быстро, чтобы изменение температуры газа, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа.
Уравнения 1-го закона термодинамики для адиабатного процесса имеют вид
![]()
Поделив первое уравнение на второе, получают
![]() или
или![]() ,
,
где
![]() - показатель адиабаты.
- показатель адиабаты.
После интегрирования и потенцирования получают уравнение адиабаты
![]() или
или![]()
Согласно молекулярно-кинетической теории показатель адиабаты для идеального газа не зависит от его температуры, а определяется только числом степеней молекулы газа. Для одноатомных газов k=1,66, для 2-х атомныхk=1,4, для 3-х и многоатомныхk=1,33.
Поскольку k1, то в координатахp-vлиния адиабаты идет круче линии изотермы. На рис.4 представлен график адиабатного процесса в сравнении с графиком изотермического.
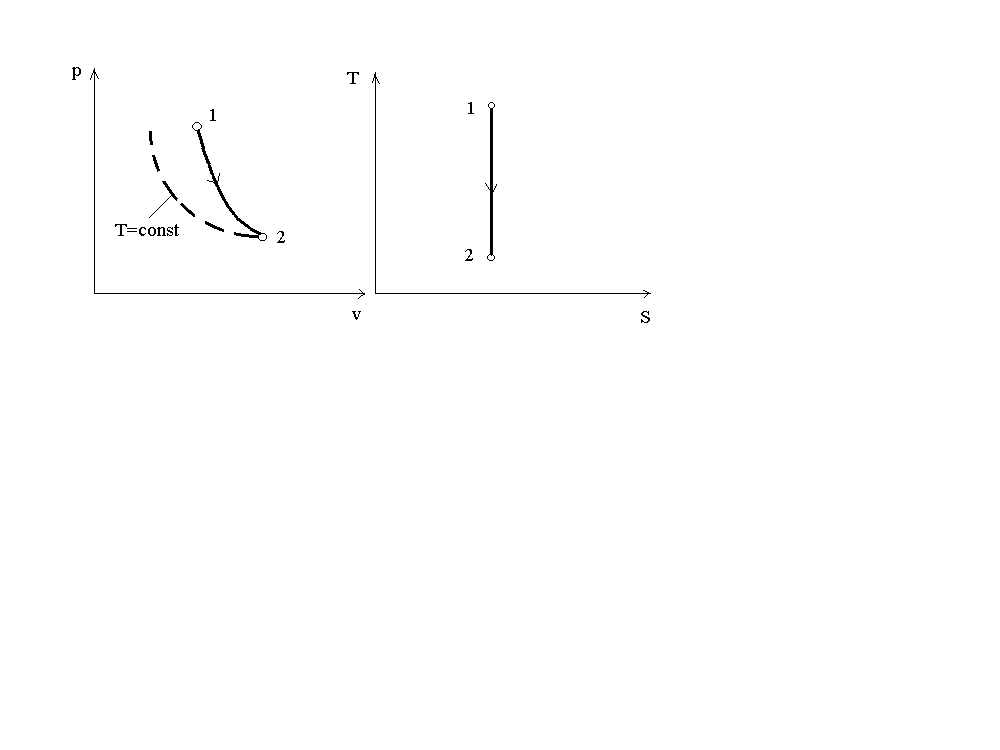
Рис. 4. График адиабатного процесса
При адиабатном расширении давление понижается быстрее, чем при изотермическом расширении, т.к. при этом происходит уменьшение температуры газа.
Параметры состояния в адиабатном процессе связаны следующими соотношениями

Изменение внутренней энергии системы:
![]()
Работа изменения объёма системы:
Согласно 1-му закону термодинамики
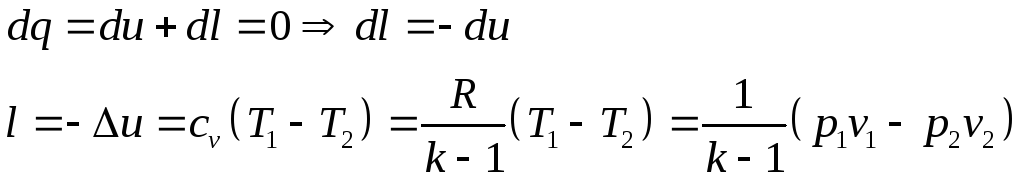
Таким образом, в адиабатном процессе работа совершается за счет изменения внутренней энергии системы.
Изменение энтропии:
![]()
В связи с тем, что в адиабатном процессе энтропия системы остается постоянной, иное название этого процесса – изоэнтропный.
