
Підручники з Біології / Біологія 9 клас / Шаламов Біологія 9 клас 2017
.pdf
гоявищапростий:виявляється,щоздатністьдвохрідкихречовинзмішуватися,ане«розбігатися» в різні боки, визначається важливою фізико-хімічною властивістю — полярністю молекул.
Один із найважливіших класів біомолекул — ліпіди — саме і є тією групою гідрофобних неполярних речовин. Цю властивість ліпідів організми вдало використовують під час побудови біологічних мембран, основним компонентом яких є саме ліпіди. Проте в організмі не всі органи мають однакову здатність синтезувати ліпіди. Кажучи простіше, для різних тканин та органів характерна різна інтенсивність обміну речовин, багато тканин просто не в змозі синтезувати собі стільки ліпідів, скільки потрібно для їхньої діяльності, зокрема й для побудови мембран. Основним органом, що синтезує ліпіди для організму, є печінка — біохімічна лабораторія організму. І ось тут постає проблема: як ліпіди — гідрофобні сполуки, утворені
впечінці, можна транспортувати до всіх органів? Адже основний компонент транспортної системи організму — плазма крові — гідрофільне середовище: у такому середовищі ліпіди неможливо розчинити, а отже, і транспортувати. Важливість цієї проблеми зростає, якщо згадати, що в складі їжі, яку ми споживаємо щодня, є жири (група молекул ліпідної природи), а їх теж треба адресно доставляти до різних органів.
Добре відомо, що, крім побудови мембран, організм використовує ліпіди і як запасний енергетичний матеріал. Запасні ліпіди розподілені по організму нерівномірно й зосереджені
вчітко визначених місцях — жирових депо. Якщо якісь тканини потребують енергії, то постає та сама проблема транспортування ліпідів із місць зберігання до ділянок організму, які потребують енергії. Тож як живі організми розв’язують цю проблему? У цьому випадку ми маємо справу з геніальним винаходом природи: гідрофобні ліпіди запаковуються в капсули з гідрофільних білків, формуючи ліпопротеїни, і саме в такому вигляді циркулюють у кров’я- ному руслі.
Ліпопротеїни крові дуже різноманітні та відрізняються один від одного за розмірами й густиною частинок, що формуються. Основним параметром, за яким класифікують групи ліпопротеїнів, є густина (рис. ІІІ.1). Найбільші за розмірами ліпопротеїни з мінімальною густиною називають хіломікронами. Вони утворюються в клітинах тонкого кишківника та переносять ліпіди, які надходять в організм у складі їжі (в основному це нейтральні жири). Далі вони потрапляють до лімфатичних судин, а з них уже надходять у кров і прямують до жирових депо. Там відбувається збирання нових частинок — ліпопротеїнів дуже низької густини (ЛДНГ). Ці ліпопротеїни, на відміну від хіломікронів, транспортують нейтральні жири внутрішнього організмового походження, які не були щойно отримані ззовні в складі їжі. Саме ЛДНГ відповідають за доставлення молекул, які забезпечують потребу органів в енергетичному матеріалі.
Транспортування інших ліпідних молекул, таких як холестерол і фосфоліпіди, забезпечується ліпопротеїнами низької густини (ЛНГ) та ліпопротеїнами високої густини (ЛВГ) відповідно. Ці ліпопротеїни транспортують ліпіди від місця їх синтезу — печінки — до місця їх використання, тобто до органів і тканин. У фізіологічному сенсі ЛНГ називають атерогенними ліпопротеїнами: велика кількість їх указує на підвищений уміст холестеролу в крові й можливе його відкладення на стінках судин, що може призвести до ризику виникнення атеросклерозу. А ЛВГ, навпаки, називають антиатерогенними ліпопротеїнами: вони знижують ризик захворювання на атеросклероз. Можливо, один із механізмів розвитку цього поширеного захворювання пов’язаний із порушенням балансу між ЛНГ та ЛВГ.
ЛВГ |
ЛНГ |
ЛДНГ |
Рис. ІІІ.1. Відносні розміри ліпопротеїнів
31
§ 6. Ферменти
У клітинах відбуваються реакції, неможливі без каталізаторів
Як ми вже знаємо з попередніх параграфів, у клітинах живих організмів є надзвичайно багато різноманітних молекул. Ці молекули не тільки становлять основу клітин і тканин, із яких побудовані організми, а й вступають у хімічні реакції одна з одною. В організмі відбуваються найрізноманітніші процеси хімічних перетворень молекул: розщеплення полімерів їжі до мономерів, дихання, фотосинтез, синтез нових білків з амінокислот тощо. Багато із цих реакцій супроводжуються виділенням енергії, яку може використовувати організм, а інші, навпаки, вимагають додаткового джерела енергії. Розглянемо просту реакцію розкладання карбаміду (інша назва цієї речовини — сечовина) у воді:
(NH2)2CO + H2O = 2NH3 + CO2
Така реакція не потребує додаткового джерела енергії, оскільки речовини, що реагують, мають біль-
шу енергію, ніж продукти реакції. Ця
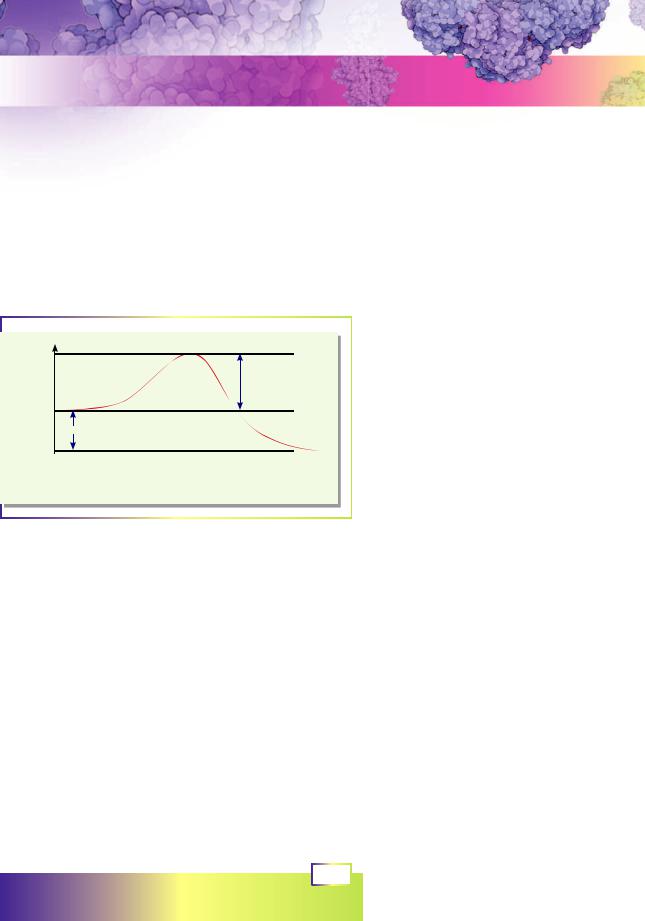
реакція відбувається довільно. На рисунку 6.1 зображено зміну енергії реагентів у ході реакції. Такий графік має назву енергетичний профіль реакції. Помістимо невелику кількість карбаміду в пробірку з водою й спостерігатимемо за процесом ви-
ділення амоніаку та вуглекислого газу. Енергетичний розрахунок показує, що карбамід має повністю розкластися. Проте швидкість такої реакції дуже мала. Для того, щоб ця реакція відбулася повністю, нам доведеться чекати мільярд років! У чому ж причина такої малої швидкості?
Якщомищеразуважнорозглянеморисунок6.1,топомітимо,щонаенергетичному профілі між реагентами й продуктами є «пагорб» — стан із високою енергією, яка перевищує енергію реагуючих речовин на енергію активації. Якщо подолати цей «пагорб», реакція відбуватиметься дуже швидко, але «видертися» на нього та «переступити» його дуже непросто. Саме це й обмежує швидкість реакції. Але деякі речовини здатні знижувати висоту цього «пагорба», тобто знижувати енергію активації. Такі речовини називають каталізаторами.
Ферменти — біологічні каталізатори
Реакція розкладання карбаміду у воді відбувається дуже повільно. Проте якщо ви додасте до цього розчину перетерте насіння кавуна та піднесете вологий лакмусовий папірець, то відразу помітите, як він почне синішати: це амоніак, що виділяється, створює лужне середовище. Можна припустити, що в кавуновому насінні є каталізатор цієї реакції. Це справді так: цим каталізатором є білок уреаза. Уреаза — лише один із величезного різноманіття каталізаторів білкової природи, які називають ферментами. Ферменти становлять абсолютну більшість каталізаторів у живих
32
Субстрат |
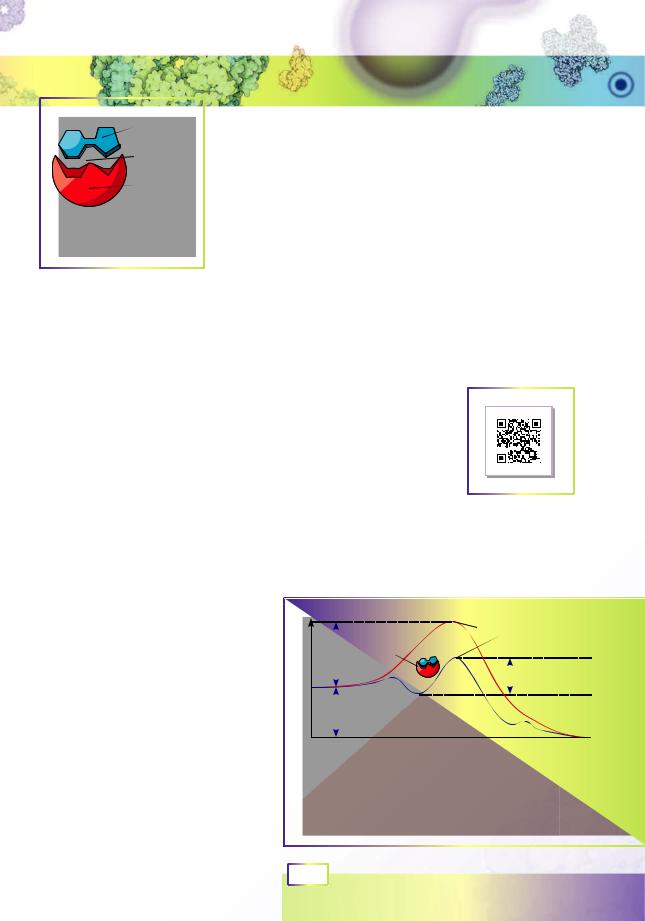
організмах. Як і всі білки, ферменти є дуже великими мо- |
|
Активний |
лекулами. На рисунку 6.2 зображено фермент і субстрат |
|
реакції (реагент). Взаємодіє із субстратом не вся поверхня |
||
центр |
||
ферменту,алишеневеличкаїїчастина,щомаєназвуактив- |
||
|
||
Фермент |
нийцентр.Іншачастинаформуєструктурнуоснову,наякій |
|
|
активний центр фіксується та набуває структури, необхід- |
|
Рис. 6.2. Фермент |
ної для каталізу. Активний центр зазвичай зовсім невелич- |
|
і його субстрат |
кий, проте до його складу часто входять віддалені ділянки |
|
|
амінокислотноїпослідовності.Упроцесізгортаннямолеку- |
|
|
||
|
ли ферменту ці ділянки опиняються поруч одна з одною. |
Принцип роботи ферментів — взаємодія із субстратом
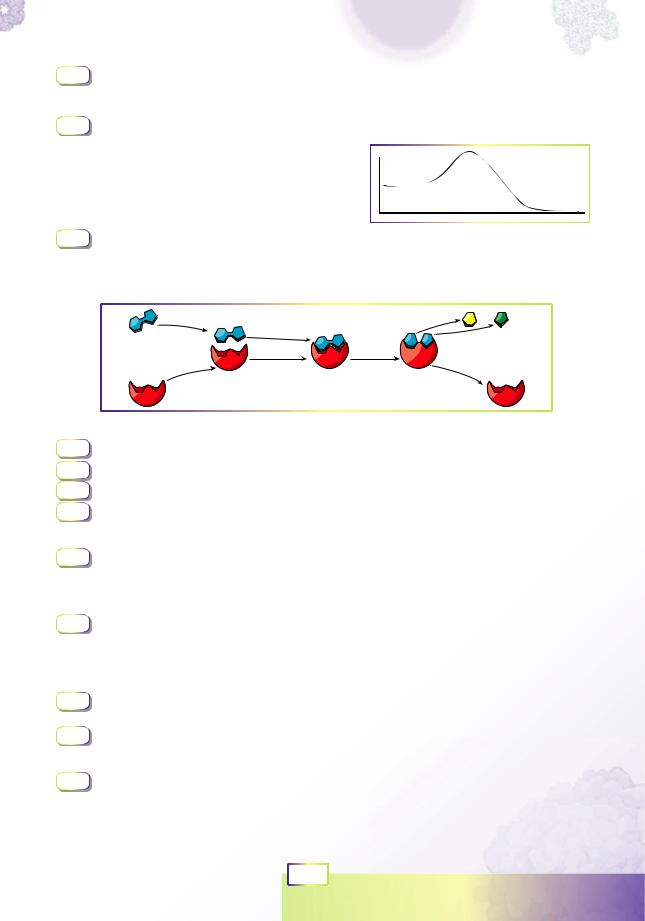
Активний центр — це каталітична ділянка молекули ферменту. Там відбувається зв’язування субстратів реакції та акт каталізу. Субстрати заходять до активного центру та взаємодіють з амінокислотними залишками, спричиняючи зміни в тривимірній структурі ферменту. Формується фермент-суб- стратний комплекс (рис. 6.3). Часто ці зміни зовсім незначні, але іноді вони глобально перебудовують структуру молекули.
Це стосуюється, зокрема, білків-моторів, що виконують механічну роботу. Поспостерігати за тим, як працює білок-мотор,
ви можете за посиланням. 







Активний центр формує відповідне оточення для здійснення реакції з меншим енергетичним бар’єром, ніж у розчині. Саме це прискорює реакцію в мільйони й навіть сотні мільярдів разів.
У кожній клітині є тисячі різних ферментів, що здійснюють різноманітні реакції. При цьому можна говорити про специфічність ферментативних реакцій: кожен фермент може здійснювати каталіз тільки обмеженої кількості реакцій. Так, фермент амілаза, що міститься в слині, може розщеплювати крохмаль, але не здатний розщепити целюлозу. Специфічність визначається тим, що активний центр має
певну форму, доступну для взаємо- |
|
|
|
|
|
дії з одними субстратами та не до- |
|
|
|
|
|
ступну для взаємодії з іншими. Деякі |
Енергія |
|
фермент- |
Перехідний стан |
|
|
|||||
ферменти прискорюють лише одну |
|
|
|
||
|
субстратний |
|
|
||
реакцію, натомість інші — багато. |
|
|
|
||
|
комплекс |
|
Енергія активації |
||
|
|
|
|
||
На ферментативну активність |
|
|
|
|
ферментативної |
|
|
|
|
реакції |
|
|
|
|
|
||
впливають чинники середовища |
|
|
Зміна вільної енергії |
|
|
|
|
|
G за постійної температури |
|
|
Ферментативний каталіз не- |
|
|
та тиску |
|
|
|
|
|
|
|
|
можливий без правильного розта- |
Рис. 6.3. Енергетичний профіль реакції, |
||||
шування залишків в активному цен- |
|||||
трі. А розташування амінокислотних |
каталізованої ферментом |
|
|
||
залишків в активному центрі визна- |
Червона лінія — реакція без ферменту, |
||||
чається правильним згортанням мо- |
фіолетова лінія — реакція з ферментом. |
||||
лекули ферменту. У § 3 ми вже з’я- |
|
|
|
|
|
|
|
|
|
|
|
сували, що на згортання молекули |
|
|
|
|
|
33

1 |
2 |
3 |
4 |
5 |
Рис. 6.4. Різноманітність ферментів
білка впливають різноманітні фактори зовнішнього середовища: температура, кислотність, солоність. Молекули ферментів, як і молекули інших білків, чутливі до варіацій цих факторів: якщо ці параметри не відповідають оптимальним, порушується тривимірна структура ферментів і вони втрачають свою активність. Так, пепсин, що є компонентом шлункового соку людини, активний у кислому середовищі шлунка, проте втрачає свою активність у слабколужному середовищі кишківника. Більшість ферментів дуже чутливі до змін температури. Під час нагрівання вище за 60 °С вони припиняють працювати. Але ферменти бактерій, що живуть у гарячих джерелах, часто оптимально працюють за температури 70– 80 °С.
Ферменти надзвичайно різноманітні
Ми вже згадали на початку параграфа, що в живих організмах відбувається величезна кількість різноманітних біохімічних реакцій, що каталізуються ферментами. Ферменти класифікують за каталізованими реакціями, будовою і клітинною локалізацією. На рисунку 6.4 зображено деякі ферменти, що є в живих організмах.
1.Амілаза — позаклітинний фермент, що здійснює розщеплення крохмалю. У людини він міститься в слині та секреті підшлункової залози. У момент проростання зернин злаків активно синтезується зародком і здійснює розклад крохмалю, накопиченого в ендоспермі (поясніть, для чого).
2.Пепсин — фермент, що міститься в шлунковому соці. Здійснює розщеплення білків. Активний у кислому середовищі.
3.Нітрогеназа — фермент, що синтезується азотфіксувальними бактеріями. Здійснює перетворення атмосферного азоту в амоніак, відіграє ключову роль у колообігу Нітрогену в природі. Містить атоми Молібдену і Феруму.
4.Глутамінсинтетаза — фермент, відповідальний за включення Нітрогену до складу амінокислот. Є в клітинах усіх живих організмів.
5.Синтаза жирних кислот — великий цитоплазматичний фермент, що здійснює синтез жирних кислот — компонентів жирів. У бактерій це мультиферментний комплекс, а в людини — димер, що містить багато різних активних центрів.
Поміркуймо
Знайдіть одну правильну відповідь
1 На рисунку до завдання № 4 цифрою 5 позначено
А активний центр ферменту |
Б субстрат |
В фермент-субстратний комплекс |
Г продукт реакції |
Д фермент-продуктний комплекс |
|
34
2Енергією тваринні організми забезпечує процес
А |
біосинтезу білка |
Б |
синтезу ліпідів |
В перетравлювання їжі |
Г |
фотосинтезу |
Д |
дихання |
|
3На графіку, що зображує зміну енергії в ході хімічної реакції, літерою Х позначено
А енергію субстратів Б енергію продуктів В енергію ферменту Г енергію активації
Д різницю енергії продуктів і субстратів
 Eнергія
Eнергія
X
Продукти
Субстрати
4 Цифрою 2 на рисунку позначено |
|
А активний центр ферменту |
Б субстрат |
В фермент-субстратний комплекс |
Г продукт реакції |
Д фермент-продуктний комплекс
1 |
5 |
4 |
|
||
|
|
|
|
|
H2O |
2 |
|
|
3 |
|
|
Сформулюйте відповідь кількома реченнями
5Як активність ферментів залежить від факторів довкілля?
6Чи витрачається фермент під час ферментативної реакції? Чому?
7 Яка з ділянок молекули ферменту безпосередньо відповідає за каталіз? 8 Що таке специфічність ферменту? Чому вона важлива для живої природи?
Знайди відповідь і наблизься до розуміння природи
9Термофільні організми мешкають у місцях із високою температурою довкілля (наприклад, у гарячих джерелах). Які особливості повинні мати ферменти, що є в цих організмах? Зроби припущення, як можуть бути використані ці ферменти на практиці?
10Зазвичай швидкість хімічної реакції збільшується з підвищенням температури (у середньому в 2–4 рази на кожні 10 градусів). Чи завжди це твердження справедливе для реакцій, які каталізуються ферментами?
Дізнайся самостійно та розкажи іншим
11Які властивості повинні мати біологічні молекули, щоб виконувати роль каталізаторів? Чому білки якнайліпше підходять для цієї функції?
12Як, для чого та які ферменти використовують у промисловості?
Проект для дружної компанії
13Використовуючи різноманітні матеріали (папір, картон, нитки, ґудзики, пластилін тощо), зробіть модель ферментативної реакції. Покажіть модель у класі та поясніть, що вона демонструє. Якщо зі справжніми матеріалами працювати ліньки, створіть подібну віртуальну модель на комп’ютері й покажіть її в класі.
35
§ 7. Нуклеїнові кислоти
ДНК — носій інформації
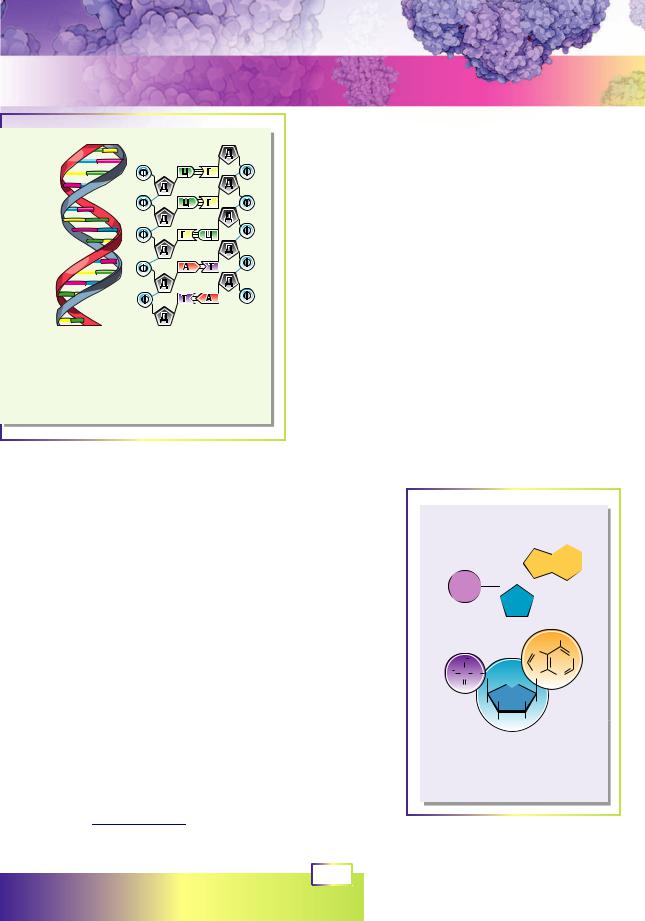
Рис. 7.1. Модель дволанцюгової молекули ДНК
Ф — ортофосфат, Д — дезоксирибоза,
А,Т, Г, Ц — нітрогеновмісні основи.
Властивість усіх живих організмів — відтворювана складність. Живі організми вирізняються не тільки складною мікрота макроскопічною структурою, а й тим, що ця структура має подібності в різних організмів, а отже, є результатом не лише випадкових, а й закономірних процесів. Можна припустити, що організм тварини чи рослини розвивається за певною прописаною програмою. Отже, має існувати носій відповідної інформації. Зручно було б записати цю інформацію у вигляді якогось тексту. Цей текст містив би обмежений набір «літер», із них складалися б окремі «слова» та «речення». Понад те, цей «текст» зміг би зберігатися та передаватися нащадкам (саме в цьому й полягає принцип спадковості). І такий «текст» у живих організмах є. Його роль відіграє молекула ДНК — дезоксири-
бонуклеїнової кислоти.
ДНК — довга лінійна молекула
Молекула ДНК має надзвичайно характерну й упізнавану структуру1. Це довга лінійна молекула, що складається з двох переплетених ланцюгів (рис. 7.1). Зазвичай кожен із ланцюгів є окремою молекулою, яка не пов’язана ковалентними зв’язками з протилежною. Обидва ланцюги переплітаються один з одним, формуючи спіральну дволанцюгову структуру.
Нуклеотиди — «літери» в молекулі ДНК
ДНК є полімерною молекулою, побудованою з мономерних ланок — нуклеотидних залишків.
На рисунку 7.2 зображено будову одного нуклеотиду. У будові нуклеотиду можна виокремити три структурні ланки. По-перше, це нітрогеновмісна основа, що є нітрогеновмісною циклічною структурою. Треба зазначити, що нітрогеновмісна основа плоска, а на своїй периферії містить групи, здатні утворювати водневі зв’язки. По-дру- ге, це залишок вуглеводу, у випадку ДНК —
А |
Нітрогеновмісна |
|||
основа |
||||
|
||||
Ортофосфат |
|
|
|
|
|
Цукор |
|
||
Б |
|
NH2 |
|
|
|
N |
|
N |
|
O |
|
|
||
|
|
|
||
O P O CH2 |
N |
N |
|
|
|
|
|
||
O |
O |
|
|
|
|
|
|
||
H |
H |
|
|
|
OH |
H |
|
|
|
Рис. 7.2.
Будова нуклеотиду
А. Схема. Б. Формула.
1Відразу зазначимо, що в цьому параграфі описується лише «канонічна» дволанцюгова ДНК. Про інші форми ДНК можна дізнатися зі спеціальної літератури.
36

дезоксирибози (саме дезоксирибоза дала назву ДНК — дезоксирибонуклеїновійкислоті).І,нарешті,залишокортофосфатної кислоти. Нуклеотиди в ДНК з’єднуються між собою
так, що залишок ортофосфатної кислоти одного нуклеотиду виявляється пов’язаним із залишком дезоксирибози іншого нуклеотиду. Таким чином, можна уявити, що один ланцюжок ДНК — це почергова послідовність залишків ортофосфатної кислоти та дезоксирибози (так званий цукрофосфатний остов), на якій закріплені нітрогеновмісні основи. Нуклеотиди ДНК відрізняються між собою лише нітрогеновмісними
основами. Загалом їх чотири: аденін (А), гуанін (Г або G), тимін (Т) і цитозин (Ц або C). Саме нуклеотиди є «літерами» тексту, яким записано інформаціюв ДНК. Довжина цього тексту може бути дуже різною. Найкоротші геноми бактерій містять мільйони нуклеотидів, найдовші геноми рослин — сотні мільярдів. У геномі людини понад три мільярди нуклеотидів1.
Принцип комплементарності — основа будови ДНК
Як ми вже згадали, класична ДНК — це спіральна дволанцюгова молекула, що складається з двох полінуклеотидних ланцюгів, переплетених один із одним. При цьому обидва ланцюги повернуті один до другого нітрогеновмісними основами: навпроти нітрогеновмісної основи одного полінуклеотидного ланцюга розташована нітрогеновмісна основа іншого. Треба зазначити, що це не випадкова, а закономірна відповідність. Так, навпроти аденіну (А) одного ланцюга розташовується тимін (Т) другого, тоді як навпроти цитозину (Ц) розташований гуанін (Г) — і навпаки (рис. 7.3). Така однозначна відповідність має назву принципу комплементарності (від лат. сomplementum — доповнення). Таким чином, обидва ланцюги ДНК, що формують дволанцюгову структуру, комплементарні один одному. Знаючи послідовність нуклеотидів в одному ланцюгу ДНК, легко визначити послідовність їх у другому ланцюгу, що утворює молекулу.
Розалінд Франклін
Народилася 1920 року в Лондоні. Навчалася в школі Святого Павла та коледжі Ньюнгем Кембриджського університету. Основні наукові праці пов’я- зані з рентгеноструктурним аналізом будови ДНК. Двоспіральна модель будови ДНК, запропонована Вотсоном і Кріком, базувалася на даних, отриманих Франклін. На жаль, Розалінд мала онкологічне захворювання й померла 1958 року у віці 37 років. Згідно із заповітом Нобеля, премії його імені не вручаються посмертно. Саме із цієї причини Франклін не була висунута
на здобуття Нобелівської премії 1962 року, яку вручили за відкриття структури та з’ясування значення ДНК. Утім внесок дослідниці в з’ясування структури ДНК був оцінений багатьма науковими установами світу, і навіть проект 2012 року з онлайн-освіти в галузі біоінформатики, програмування й молекулярної біології був названий Rosalind на честь Розалінд Франклін.
1Коли генів багато, інформацію записано на кількох молекулах ДНК.
37

|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AA |
Ц |
A |
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
ЦЦ |
У |
4 |
|
||
1 |
Г |
|
|
|
|
|
A |
|
|
|
У |
A |
|
|
|
|
A |
|||
Ц |
|
|
У У Г |
Ц У A |
|
|
|
У |
|
A Г |
||||||||||
A |
|
|
Ц Ц |
|
Ц Г У |
|
|
|
||||||||||||
|
A ЦЦ |
2 |
|
|
|
|
3 |
|
|
A ГГ |
|
|||||||||
|
|
|
|
AЦ Г A |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
У Г Г |
A |
У Г |
Г |
|
|
|
|
Г |
|
|
|||||||
|
|
|
|
|
|
|
Г Ц A |
|
|
Ц |
|
|
||||||||
|
Ц |
|
|
|
|
|
|
|
|
|
|
Ц |
|
|||||||
|
|
|
|
|
|
|
|
|
Г |
|
A |
Ц |
|
|
|
|
|
|||
|
Г |
|
|
|
|
|
|
|
|
|
A |
Г |
|
|
|
|
||||
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
У |
|
|
|
|
|
|
|
|
|
|
|
|
|
Г |
|
|
|
|
|
Рис. 7.4. Варіанти вторинних структур у РНК
1.Одноланцюгова ділянка.
2.Дволанцюгова ділянка.
3.Петля. 4. Шпилька.
Отже, у кожного організму кількість аденілових нуклеотидів дорівнює кількості тимідилових, а кількість гуанілових — кількості цитидилових. Як ми з’ясуємо з вами в наступних параграфах, принцип комплементарності вкрай важливий для прочитання та реалізації спадкової інформації, записаної в ДНК.
РНК — інший вид нуклеїнових кислот
ДНК—неєдинийполінуклеотид,щоміститься
вклітині. Інший тип полінуклеотидів, який завжди
єв клітинах і виконує життєво важливі функції, — РНК (рибонуклеїнова кислота). Молекули РНК побудовані за тією самою схемою, що й молекули ДНК: це ланцюг послідовно з’єднаних нуклеотидів. Ключова відмінність полягає в тому, що
внуклеотидах РНК замість дезоксирибози є рибоза. Також у РНК, на відміну від ДНК, замість тиміну є близький до нього за хімічною структурою урацил1. Тривимірні структури, яких набувають молекули РНК, більш різноманітні, ніж структури ДНК. Хоча спіральна дволанцюгова структура в РНК доволі поширена, обидва ланцюги
вній зазвичай є ділянками однієї полінуклеотидної послідовності. Таким чином, молекули РНК формують петлі, шпильки, псевдовузли та інші незвичні структури (рис. 7.4). Варто зазначити, що принцип комплементарності, такий суворий для ДНК, нерідко порушується у дволанцюгових ділянках РНК.
Роль РНК у клітині — реалізація спадкової інформації
Якмивжезнаємо,молекулиРНК вирізняютьсявеликимрізноманіттямструктур (рис. 7.5), що дає змогу їм виконувати багато функцій у клітині. Більшість молекул РНК так чи інакше залучена до реалізації генетичної інформації: прочитання інформації, закодованої в послідовності ДНК, синтез молекул білка, забезпечення синтезу інших молекул РНК. Є РНК, що бере участь у захисті клітинної ДНК від вірусів, а також у регуляції роботи ДНК. Деякі РНК задіяні у перенесенні білків крізь мембрани, а також у хімічному каталізі.
Останній тип РНК має назву рибозими (за аналогією з ензимами — іншою назвою ферментів). Деякі віруси, як-от вірус грипу, риновіруси (спричиняють застуду) та вірус імунодефіциту людини, використовують не ДНК, а РНК для збереження своєї спадкової інформації.
Рис. 7.5. Приклад згортання молекули РНК — РНК із рибосом термофільної бактерії
Зверніть увагу на велику кількість дволанцюгових структур, а також на те, що молекула становить одну полінуклеотидну послідовність.
1РНК вирізняється більшою різноманітністю нітрогеновмісних основ, що входять до її складу, проте основними є чотири: аденін, гуанін, урацил і цитозин.
38

Френсіс Крік
Народився 1916 року в англійському місті Норгемптон. Його дід був біологом і мав кілька спільних наукових праць із Чарльзом Дарвіном. Освіту здобув у школі Мілл-Гілл, а потім в Університетському коледжі в Лондоні. Головні дослідження вченого стосувалися структури молекули ДНК. Завдяки зусиллям Кріка й багатьох його колег у 1953 році вдалося запропонувати модель будови ДНК у вигляді подвійної спіралі. Учений сформулював властивості генетичного коду, центральну догму молекулярної біології,
ключові особливості біосинтезу білка. У 1962 році він разом із Джеймсом Вотсоном і Морісом Вілкінсом був удостоєний Нобелівської премії з фізіології або медицини «за відкриття, що стосуються структури нуклеїнових кислот і їхнього значення для передачі інформації в живих системах». До кінця своїх днів Крік залишався дослідником, гуманістом і атеїстом. Помер науковець 2004 року в Сан-Дієго, США.
Поміркуймо
Знайдіть одну правильну відповідь
1Функцію зберігання спадкової інформації в організмах виконують
А білки Б нуклеїнові кислоти В ліпіди Г вуглеводи Д амінокислоти
2Мономерами нуклеїнових кислот є
А |
амінокислоти |
Б нуклеотиди |
В нітрогеновмісні основи |
Г |
ортофосфат-іони |
Д жирні кислоти |
|
3У складі ДНК зазвичай не буває нітрогеновмісної основи
А тиміну Б аденіну В урацилу Г гуаніну Д цитозину
4З указаних пар нуклеотидів НЕ є комплементарною пара
А А–Т Б Г–Ц |
В У–Т |
Г А–У Д Ц–Г |
5На місці, позначеному Х, у подвійній спіралі ДНК має стояти нуклеотид 1-й ланцюг: Т Г Ц Ц Т А Т Г А Ц
2-й ланцюг: А Ц Г Г А Х А Ц Т Г |
|
|
||
А А |
Б Г |
В Т |
Г У |
Д Ц |
Сформулюйте відповідь кількома реченнями
6Напишіть послідовність ДНК, що комплементарна такій: АТГЦГЦТТАТТЦГАЦ. Напишіть послідовність РНК, комплементарну цьому ланцюгу ДНК.
7Назвіть відмінності в хімічній природі та будові ДНК і РНК.
8Що означає поняття «комплементарність ланцюгів ДНК»? Якою мірою ця властивість притаманна молекулам РНК?
9При підвищенні температури відбувається так зване плавлення ДНК, за якого вона розплітається та стає одноланцюговою. З урахуванням того, що енергія взаємодії Г–Ц дещо вища за енергію взаємодії А–Т, припустіть, який із двох фрагментів ДНК (наведено тільки по одному ланцюгу!) матиме вищу температуру плавлення: ГЦАААГТТААТТЦАТАТ чи ТАГЦГЦТГТЦЦГТЦЦГГ?
39

10Сечовина може бути використана для порушення тривимірної структури білків, оскільки сприяє розриву водневих зв’язків. Чи може сечовина бути використана для руйнування дволанцюгової структури ДНК?
Знайди відповідь і наблизься до розуміння природи
11Одинарний набір ДНК у ядрах клітин людини містить приблизно 3 мільярди пар нуклеотидів. У ДНК на кожну основу припадає близько 0,34 нм спіралі. Використовуючи ці дані, обчисли, якою була б сумарна довжина молекул ДНК у кожній клітині людського організму, якби вся ДНК була повністю розгорнута та перебувала у формі дволанцюгової спіралі (врахуй, що в клітині зазвичай є по дві копії кожної молекули ДНК!).
12Видатний біофізик Макс Дельбрюк за значенням для науки порівняв відкриття структури ДНК з відкриттям Резерфордом атомного ядра. Поміркуй, як праці з визначення структури ДНК вплинули на подальший розвиток біологічної науки та в чому їхня важливість.
Дізнайся самостійно та розкажи іншим
13Відомо, що одноланцюгова ДНК поглинає ультрафіолетове світло приблизно на 40 % ефективніше, ніж дволанцюгова. Спробуй спрогнозувати, як зміниться поглинання світла ДНК при підвищенні температури від 25 до 98 °C. А що станеться, якщо температуру знову повільно знизити з 98 до 25 °C?
Доповнення ІV
Анастасія Бондарєва |
«Божевільний» пошук подвійної |
спіралі1 |
|
Закінчила Харківську гімназію |
У 1869 році Фрідріх Мішер, працюючи |
№ 47 у 2008 році. Того ж року ви- |
|
борола бронзову медаль на Міжна- |
над вивченням лейкоцитів, виділив «нукле- |
родній біологічній олімпіаді в Індії. |
їн» із їхніх ядер, згодом перейменований на |
Закінчила Київський національний |
нуклеїнову кислоту. Пізніше, у 20-х роках |
університет імені Тараса Шевченка. Зараз на- |
ХХ століття, американський хімік Фібус Ле- |
вчається в аспірантурі медичного факультету |
він з’ясував, що ДНК містить чотири типи |
Технічного університету Дрездена. |
нуклеотидів (з аденіном (А), гуаніном (Г), |
|
цитозином (Ц) і тиміном (Т), що склада- |
|
|
|
ються з вуглеводу дезоксирибози, залиш- |
ку офтофосфатної кислоти та відповідної нітрогеновмісної основи), та описав зв’язки, що утворюються між ними. Проте більш відомий Левін своєю помилковою теорією структури ДНК: він уважав, що одна молекула ДНК містить тільки по одному нуклеотиду кожного типу (тетрануклеотидна теорія). У 1934 році цю теорію спростувало відкриття того, що ДНК є полімером багатьох нуклеотидів, з’єднаних у ланцюг.
Понад півстоліття ДНК цікавила здебільшого хіміків: на той час у біології панувала думка, що носіями спадковості є білки. Але у 1928 році Фредерік Гріффіт отримав несподіваний результат експерименту, у якому вбиті нагріванням бактерії (зазвичай білки втрачають свою просторову структуру за високих температур і стають нефукціональними) були здатні передавати свою патогенність іншим, непатогенним, бактеріям. Це вказувало на наявність іншого, ніж білок, носія спадковості. Вирішальні експерименти, що не залишили сумнівів
1Перегук із назвами книг Френсіса Кріка та Джеймса Вотсона: Francis Crick «What Mad Pursuit: A Personal View of Scientifi c Discovery», 1988; James Watson «The Double Helix», 1968.
40
