
к экзамену последний семестр / ФХ Экзамен
.pdfТемы 1
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
−Константа диссоциации и степень диссоциации слабого электролита. Закон разведения Оствальда для электролитов различных валентных типов. Влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
−Активность и коэффициент активности электролита. Связь между активностью электролита и средними ионными: моляльностью, активностью и коэффициентом активности на примере электролитов различного валентного типа.
−Ионная сила раствора.
−Растворы сильных электролитов. Основные положения теории Дебая-Хюккеля. Зависимость среднего ионного коэффициента активности от ионной силы раствора в разбавленных и концентрированных растворах сильных электролитов.
−Молярная электрическая проводимость растворов электролитов: понятие, единицы измерения. Зависимость молярной электропроводности от концентрации (разведения), температуры и природы растворителя. Закон квадратного корня Кольрауша.
−Удельная электрическая проводимость: понятие, единицы измерения. Зависимость удельной электрической проводимости от концентрации для сильных и слабых электролитов.
−Скорость и подвижность ионов. Закон независимого движения ионов (закон Кольрауша). Предельные молярные электропроводности ионов. Эстафетный механизм переноса электричества ионами гидроксония и гидроксила. Числа переноса ионов.
Расчетные задачи:
−Расчет степени диссоциации и константы диссоциации слабого электролита.
−Расчет рН раствора для растворов сильных и слабых электролитов.
−Расчет активности электролита и средних ионных величин: моляльности, активности и коэффициента активности.
−Расчет электропроводности электролита при заданной концентрации.
−Расчет площади поверхности электродов.
−Расчет растворимости малорастворимых соединений.
ФХ Экзамен Стр.1
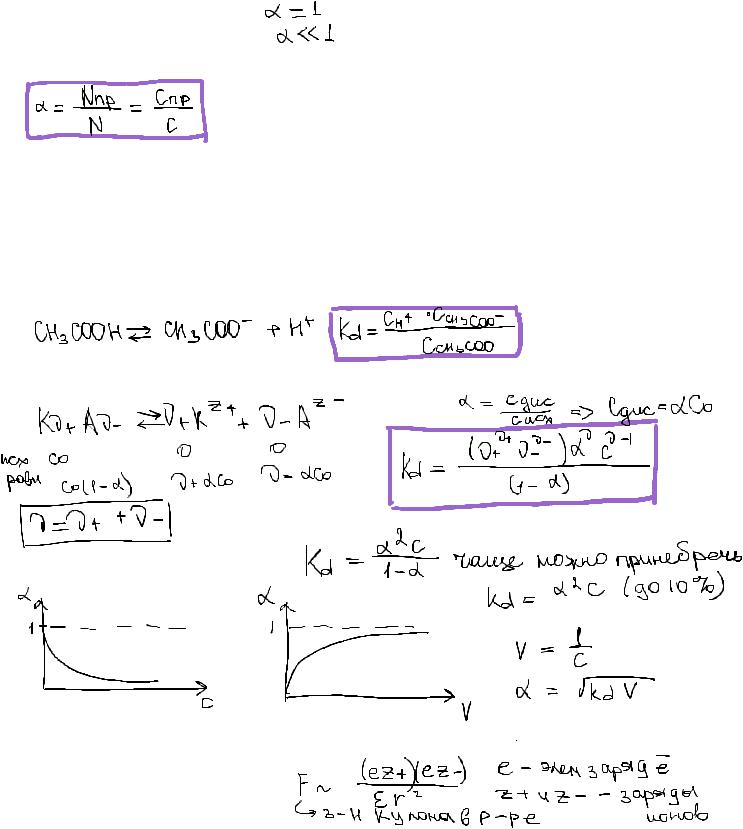
Константа диссоциации и степень диссоциации слабого электролита. Закон разведения Оствальда для электролитов различных валентных типов. Влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
Электролит - вещество, которое способно самопроизвольно в растворах и расплавах распадаться на ионы.
Сильные - диссоциируют нацело; Слабые - диссоциируют частично.
Количественный критерий - степень диссоциации.
Теория э/д Арениуса:
1.Электролиты при растворении в соответствующем растворителе способны распадаться на ионы - эл дис.
2.Эл-ты диссоциируют неполностью, колич хар-ка - степень диссоциации
3.ионы и недис молекулы находятся в равновесии, к процессу диссоциации применим закон действующих масс.
Так же как Кравн, Кд является величиной постоянной для данного электролита, в данном р-ле при данной Т. Не зависит от концентрации и присутствия посторонних ионов!
Закон разведения Оствальда:
Один из признаков слабого электролита является подчинение закону Оствальда:
Электролит типа 1-1 однозарядный
Зависимость константы и степени диссоциации от температуры:
(влияние одинаковое)
1. Природа электролита 2. Природа растворителя:
Основное св-во растворителя, влияющая на диссоциацию - полярность, которая характеризуется диэлектрической проницаемостью (ε) . Чем выше эл прониц, тем активнее диссоциирует электролит, тем выше Кд и α.
Закон Кулона:
Сила взаим 2х точечных зарядов в вакууме прямопрапорциональна их величинам и обратно проп квадрату расст м/ду ними.
ФХ Экзамен Стр.2
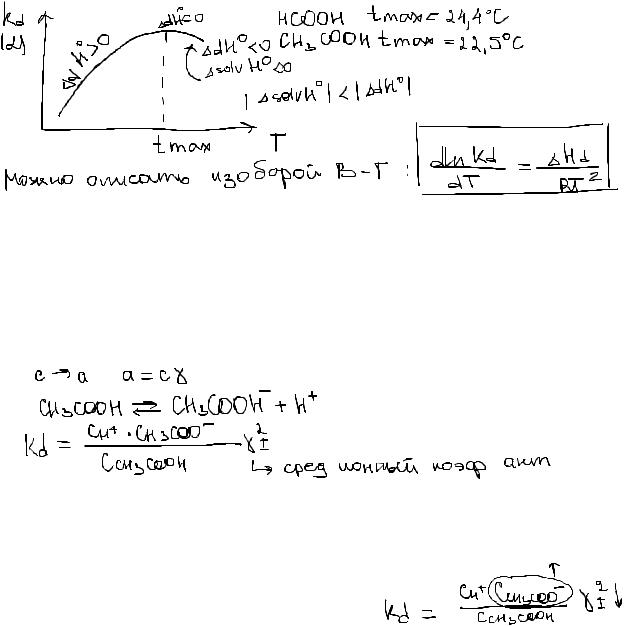
Чем выше ε, тем меньше сила взаимодействия между зарядами (тем меньше стремление ионов объединиться обратно в молекулу)
3. Температура Диссоциация - процесс сложный, включающий разрыв связей и сольватацию, как минимум!
Строгой функциональной зависимости не существует. Общая закономерность (эмпирическая зависимость) - прохождение графика Кд через макс
Нд - эффективная в-на, которая определяется тепловым эфф всех процессов, происходящих при р-ции электролита.
Факторы, которые влияют только на α:
1.Степень диссоциации падает с ростом конц (см стр. 1)
2.Присутствие посторонних ионов:
При добавлении сильного электролита коэффициент активности γ не равен 1:
а) при добавлении индиферентного эл-та (не имеют общ ионов с данным элтом; не влияют на конц ионов данного эл-та)
Средний ионный коэф акт уменьшается, кон ионов данного эл-та НЕ мен, поэтому для сохранения Кд должна ув степень дис.
б) при добавлении неидн эл-та (γ+- уменьшается)
Изменение степени дис будет зависеть от соотношения кол-го вклада коэф акт и конц иона неид эл-та, но как правило, изменение конц иона за счет добавки оно провоцирует, т.е. изменением средне ионного коэф акт можно пренебречь.
ФХ Экзамен Стр.3
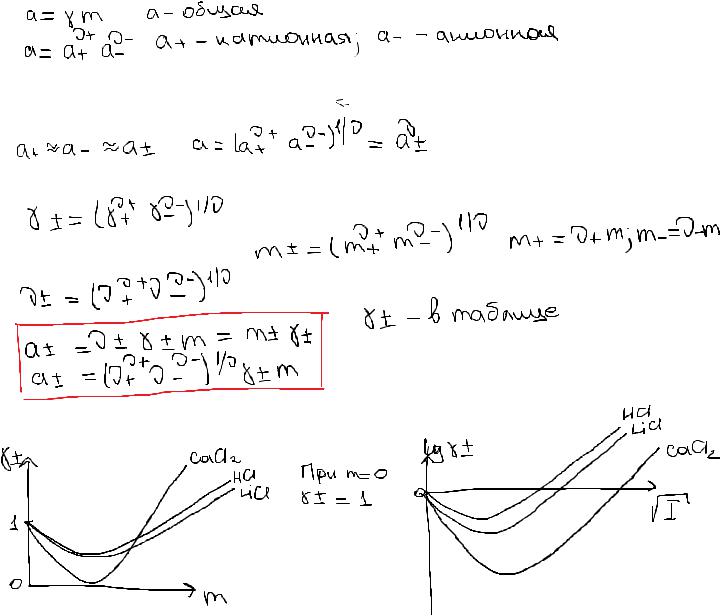
Активность и коэффициент активности электролита. Связь между активностью электролита и средними ионными: моляльностью, активностью и коэффициентом активности на примере электролитов различного валентного типа.
Даже в разбавленных растворах сильных элктролитов ионы взаимодействуют друг с другом, что приводит к отклонению от идеальности, т.е. необходимо использовать понятие активности.
Тк катионную и анионную акт невозможно определить по отдельности используют понятие средней ионной активности (среднее геометрическое из а+ и а-).
Средний ионный коэффициент активности:
Средняя ионная моляльность:
Зависимость среднего ионного коэф акт от конц:
При росте m γ+- уменьшается за счет уменьшения расстояния м/ду ионами и появления сил вз-я м/ду ними. (На этом этапе силы электростатического притяжения). При дальнейшем сближении появляются силы отталкивания и при определенном значении конц они уравновешивают друг друга, после силы отталкивания возрастают и гамма возрастает.
ФХ Экзамен Стр.4

Ионная сила раствора:
-мера э/ст взаимодействия ионов в растворе, которое зависит от концентрация и заряда ионов.
Сувеличением заряда иона - ионная сила возрастает быстрее, чем моляльность. При один мол конц р-ры однозарядных электролитов ведут себя как более конденсированные.
ФХ Экзамен Стр.5

Растворы сильных электролитов. Основные положения теории Дебая-Хюккеля. Зависимость среднего ионного коэффициента активности от ионной силы раствора в разбавленных и концентрированных растворах сильных электролитов.
Теория Дебая-Хюккеля:
1.Сильные электролиты диссоциируют нацело.
2.Ионы представляют собой материальные точечные заряы, взаим м/ду которыми только э/ст.
3.Ионы распределены в растворе равномерно и находятся в непрерывном тепловом движении
4.Вокруг каждого иона в растворе образуется ионная атмосфера ее заряд и размеры носят статистических характер.
Допущения:
1.Ионы - материальные точки;
2.Чисто кулоновские взаимодействия
3.Диэлектрическая проницаемость раствора сопоставима с диэл проницаемостью р-ля.
Зависимость среднего ионного коэффициента активности от ионной силы раствора в разбавленных и концентрированных растворах сильных электролитов:
ФХ Экзамен Стр.6
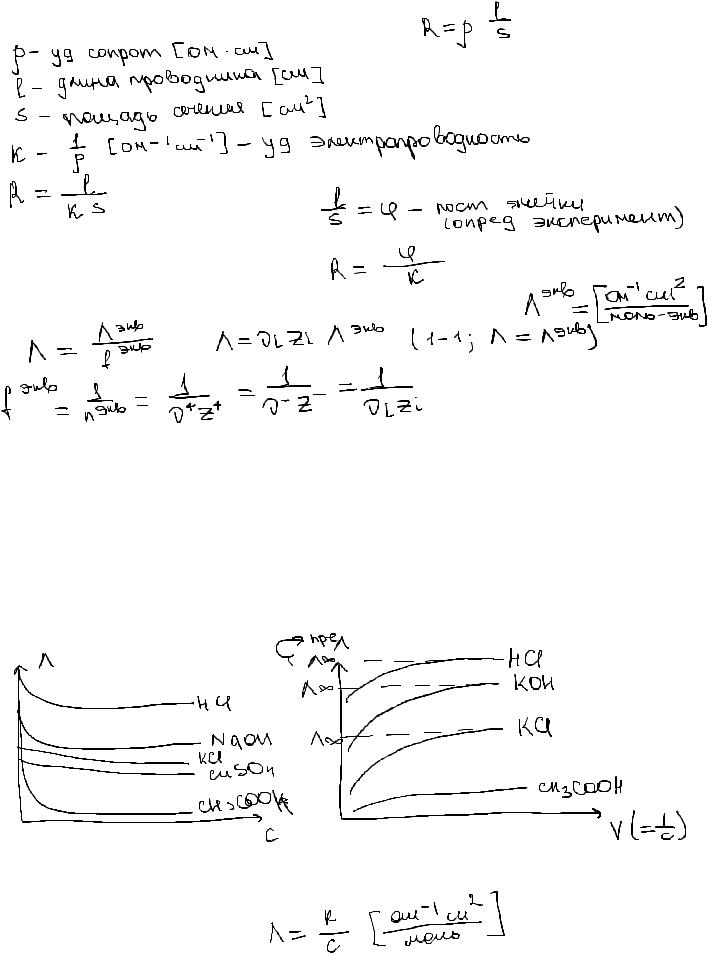
Молярная электрическая проводимость растворов электролитов: понятие, единицы измерения. Зависимость молярной электропроводности от концентрации (разведения), температуры и природы растворителя.
Электропроводность - способность в-ва проводить эл ток.
В эл-ной ячейке l-расст м/д электродами S - площадь истинной ячейки
Молярная электропроводность - проводимость 1 моль-экв р-го вещества
Зависимость молярной электропроводности от концентрации (разведения), температуры и природы растворителя:
1.Природа эл-та (ri, zi - характер влияния аналогичен эл подв) способность к диссоциации: С ростом радиуса/ заряда молярная эл-пр увеличивается;
2.Природа р-ля: (при ув вязкость, эл-пр уменьшается; при ув ε, увеличивается, как и для удельной)
3.Т (как у удельной) строгой зависимости нет, но можно сказать, что увеличивается с увеличением температуры, тк ум вязкость.
4.Конц: в увеличением конц эл-пр уменьшается
Причины: для сильных - при ув конц ув взаимодействие м/д ионами, для слабых - уменьшается степень диссоциации. 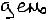


С увеличением разбавления увеличивается эл-пр, при бесконечном разбавлении эл пр достигаем максимального значения - предельная электропроводность
Связь межму молярной и уд эл-тями:
ФХ Экзамен Стр.7
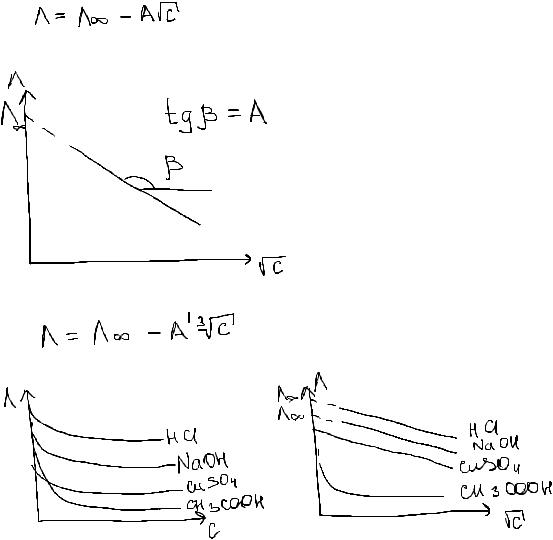
Закон квадратного корня Кольрауша:
Представление зависимости мол эл-ти от конц для сильных и слабых электролитов:
1) Сильные:
Кольрауш экспериментально определил в обл малых конц мол эл-ть сильного эл-та ЛИНЕЙНО зависит от корня квадратного из конц:
- закон квадратного корня Кольрауша.
А НЕ равно 0,510(!)
Метод экс определения предельной эл-ти сильного эл-та
Для более кон растворов - ур-е кубического корня Гоша:
Линейная зависимость эл-ти от конц отличительнй признак сильного электролита (1-1)!
ФХ Экзамен Стр.8

Удельная электрическая проводимость: понятие, единицы измерения. Зависимость удельной электрической проводимости от концентрации для сильных и слабых электролитов.
Удельная электропроводность - элетропроводность объема р-ра эл-та, заключенного м/ду 2мя плоскопараллельными электродами площадью 1 см2 и расположенными на расст 1 см друг от друга.
Факторы, влияющие на уд. электропроводность:
1.Природа электролита (размер ионов, заряд, способность к дис)
2.Природа рас-ля (вязкость, диэл. проницаемость) Чем выше вязкость, тем ниже эл-ть - сильные
Чем выше диэл прониц, тем выше степень дис, тем выше электропроводность.
3.Концентрация эл-та
Объяснение хода зависимости: при низких конц ионов в р-ре мало (мало носителей заряда) эл-ть низкая, при ув с К ув, за счет роста кол-ва заряж частиц.
При ув с в дальнейшем: 1) нарастают эффекты торможения, за счет вз-я м/ду ионами
2)Образование "двойников" = ионных пар (заряд 0), что приводит к снижению числа заряженных частиц
3)С ростом конц растет вязкость (для сильных эл-тов), в слабых падает степ дис.
4.Т: строгой зависимости нет, но примерно при ув Т К растет, за счет ум вязкости и ум сольватных оболочек
ФХ Экзамен Стр.9

Скорость и подвижность ионов. Закон независимого движения ионов (закон Кольрауша).
u - разность потенциалов м/д электродами l - расстояние м/д эл-ми
е - элементарный заряд z - зарядовое число
- вязкость
r- радиус сольватированного иона
Сравнение скорости движения разн ионов целесообразно проводить при условии u/l=1, те при единичном градиенте потенциала.
Факторы, влияющие на скорость движения ионов и электр подвижность:
1.Заряд: чем больше заряд, тем выше подвижность и скорость;
2.Природа растворителя (вязкость): чем выше вязкость тем меньше скорость и подвижность;
3.Темп: чем выше Т, тем выше скорость;
4.Радиус иона: чем больше радиус, тем ниже скорость
Чем меньше r кр, тем сильнее эл поле ионов и тем больше число мол-л р-ля входит в его сольватную оболочку, следовательно тем больший радиус сольв имеет сольв ион.
5.На скорость движения влияет градиент потенциала, чем он больше, тем выше скорость иона. (u/l растет, скорость растет)
Закон Кольрауша:
В бесконечно разб р-ре кат и ан переносят эл ток независимо друг от друга.
ФХ Экзамен Стр.10
