
к экзамену последний семестр / ФХ Экзамен
.pdf
Связь ЭДС гальванической цепи с электродными потенциалами:
ЭДС (Е) гальванической цепи - разность потенциалов на концах правильно разомкнутой цепи при отсутствии тока во внешнем контуре.
Условный электродный потенциал - ЭДС цепи, составленной из данного эл-да т эл-да сравнения, потенциал которого 0.
ЭДС цепи рассчитывается как разность эл потенциалов: Е =Е2-Е1 У правильно сост эл/хим цепи ЭДС >0, поэтому Е=Е+ - Е- Е=Еправ - Елев
Катод - электрод, которому перемещаются положительные заряды (происходит восст). Анод - электрод, к которому перемещаются отрицательные заряды (происходит окис).
В качестве нулевого электрода используют стандартный водородный электрод (см схему газового электрода).
Стандартный водородный электрод - водородный электрод с активностью ионов водорода (гидроксония) в р-ре а(Н+) = 1 и давлением водорода, равному 1 амт.
Электродный потенциал СВЭ принимается равным нулю при любой температуре.
Знак потенциала исследуемого электрода совпадает со знаком ЭДС приведенной цепи. Диффузионный потенциал должен быть сведен к нулю. Стандартный водородный электрод, следовательно, служит электродом, с потенциалом которого сравниваются потенциалы всех других электродов (электрод сравнения). Потенциал электрода, определенный таким образом, также называют электродным потенциалом по водородной шкале.
Правило знаков ЭДС и электродных потенциалов:
Положительная величина ЭДС (напряжения) гальванического элемента - если электр. ток (электроны) во внешней цепи течет от левого электрода к правому, что тождественно условию, согласно которому положительно заряженные ионы внутри гальванического элемента перемещаются в том же направлении.
Таким образом, на правом электроде имеет место процесс восстановления и он является положительным полюсом гальванического элемента.
На левом протекает процесс окисления и он является отрицательным. Уравнения электродной реакции записывают таким образом, чтобы в левой части располагались вещества в окисленной форме, а в правой - продукты их восстановления.
Знаки потенциалов электродов устанавливаются на основании принципа самопроизвольного протекания электродного процесса, при условии, что вторым электродом гальванического элемента является стандартный водородный электрод.
Если в паре со СВЭ на данном электроде протекает процесс восстановления, то потенциалу электрода приписывается положительное значения, если процесс окисления - отрицательное.
ФХ Экзамен Стр.21

Методика измерения ЭДС и электродных потенциалов:
Компенсационный метод - метод при котором соблюдается условие отсутствия тока к эл цепи; в нем разность потенциалов на концах электрохимической цепи компенсируется выверенной по эталону разностью потенциалов внешнего источника тока.
ФХ Экзамен Стр.22

Зависимость ЭДС от температуры:
ФХ Экзамен Стр.23

Алгоритм составления условной записи гальванического элемента
ФХ Экзамен Стр.24

Расчетные задачи: |
|
Расчет ∆ , ∆ ∆ |
, протекающей в электрохимической цепи. |
Формула для расчета константы равновесия:
Расчет ∆ , ∆ ∆ :
План:
ФХ Экзамен Стр.25

Расчет электродного потенциала электрода (ЭДС электрохимической цепи) при заданных значениях концентрации раствора электролита (давления газа):
1.Проверить правильность записи гальванического элемента.
2.Написать полуреакции.
3.Написать суммарную реакцию.
4.Составить уравнения Нернста.
5.Определить активности (активности веществ =1).
Пример:
ФХ Экзамен Стр.26
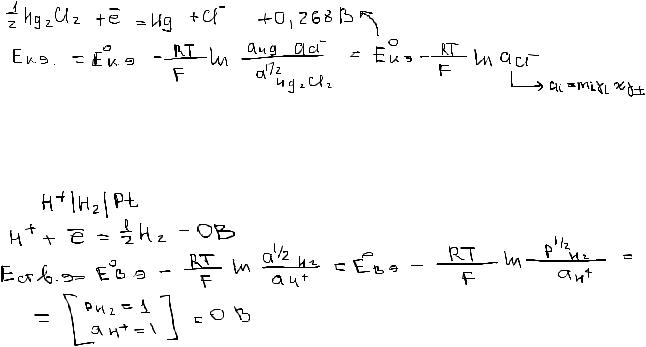
Расчет рН раствора по данным о значении ЭДС электрохимической цепи:
Электроды сравнения - эл-ды, по отношению к которым экспериментально измеряют потенциалы других электродов.
а) Каломельный электрод (к.э.):
Pt|Hg|Hg2Cl2|Cl− (104)
Насыщенный р-р KCl: Ек.э. = 0,2415В 1,0М - 0,2812В 0,1М - 0,3341В
б) Стандартный водородный электрод (ст.в.э.) (43):
Электрохимические цепи для определения pH исследуемого раствора:
1. Водородно-каломельный цепь:
-Pt|H2 (p(H2)=1атм)|H+ (pH-?)||KCl|Hg2Cl2|Hg|Pt +
E=Er-El = Eк.э. - Eв.э. = Ек.э. - (- RT/F *2,303*pH)=Eк.э. + RT/F *2,303*pH
Выражаем pH
pH= (E-Eк.э.)*F/(2,303*R*T)
2. Каломельно-хингидронная цепь:
- Pt|Hg|Hg2Cl2|KCl||хинон, гидрохинон, H+ (pH-?)|Pt +
E=Er-El=Eхг.э.-Ек.э. = (Eхг.э. - RT/F *2,303*pH) - Ек.э.
pH = (Eхг.э. - Ек.э. - Е)*F/ 2,303*RT
3. Водородно-хингидронная цепь:
- Pt|H2 (p(H2)=1атм)|H+||хинон, гидрохинон, H+ (pH-?)|Pt +
E=Er-El=Eхг.э.-Eв.э. = (Eхг.э. - RT/F *2,303*pH) -0
pH = (Eхг.э. - Е)*F/ 2,303*RT
ФХ Экзамен Стр.27

Расчет среднего ионного коэффициента активности (активности) электролита по данным о значении ЭДС электрохимической цепи:
Для определения общей активности (а) и средних ионных величин эл-та необходимо составить цепь без переноса с общим исследуемым р-ром данного эл-та, при этом один эл-д должен быть образован по катиону (эл-д 1рода) данного эл-та, а другой - по аниону (2 рода)
ФХ Экзамен Стр.28

Расчет произведения растворимости и растворимости по значениям стандартных электродных потенциалах:
Не нужно составлять гальванический элемент!
Электрод 2 рода можно представить как эл-д 1 рода только с очень малой конц иона Ме, которая будет зависеть только от конц аниона, обр с ним малорастворимое соединение.
ФХ Экзамен Стр.29
Темы 3 ФОРМАЛЬНАЯ КИНЕТИКА
−Скорость химической реакции, основной постулат химической кинетики. Константа скорости гомогенной реакции, размерность константы скорости. Зависимость константы скорости от различных факторов.
−Определения: «частный порядок», «полный порядок», «молекулярность» химической реакции. Период полупревращения.
−Односторонние гомогенные реакции первого, второго, третьего и нулевого порядков, кинетические уравнения (при условии равенства концентраций исходных реагентов в момент начала реакции), линейные интерпретации кинетических кривых.
−Методы определения порядка реакции.
– Сложные реакции.
− Влияние температуры на скорость химической реакции. Температурный коэффициент константы скорости реакции, приближенное правило Вант-Гоффа. Уравнение Аррениуса в дифференциальной и интегральной форме. Энергия активации и предэкспоненциальный множитель. Методы определения этих величин из экспериментальных данных.
Расчетные задачи:
−Для простых односторонних реакций целочисленных порядков: определение порядка реакции, расчет константы скорости реакции, периода полупревращения, концентрации вещества в заданный момент времени от начала реакции.
−Расчет энергии активации, температурного коэффициента Вант-Гоффа,
предэкспоненциального множителя уравнения Аррениуса по данным о зависимости константы скорости от температуры.
−Сложные реакции. Обратимые, последовательные и параллельные реакции первого (второго) порядка. Расчет констант скоростей отдельных стадий реакции.
−Расчет порядка реакции, константы скорости и периода полупревращения реакции по графическому изображению кинетической кривой.
ФХ Экзамен Стр.30
