
к экзамену последний семестр / ФХ Экзамен
.pdf
Скорость химической реакции, основной постулат химической кинетики. Зависимость константы скорости от различных факторов.
Скорость х/р - изменение кол-ва в-ва в единицу времени в единицу объема.
Средняя скорость - скорость за конечный промежуток времени. |
Инвариантная скорость:
Основной постулат химической кинетики:
Скорость реакции в каждый момент времени пропорциональна произведению концентрации реагирующих веществ, возведенных в некоторые степени.
Для реакции |
+ |
= |
+ |
ч |
м |
следующий вид: |
|
|
|
|
|
Константа скорости гомогенной реакции, размерность константы скорости. Зависимость константы скорости от различных факторов:
– |
х м ч й |
. |
Физический смысл этой величины: константа скорости численно равна скорости реакции при единичной концентрации реагирующих веществ.
Константа скорости не зависит от концентрации реагирующих веществ, определяется природой реакции и зависит от температуры, а также от условий протекания процесса (наличия катализатора, природы растворителя и т.д.).
Размерность константы скорости зависит от вида кинетического уравнения.
ФХ Экзамен Стр.31
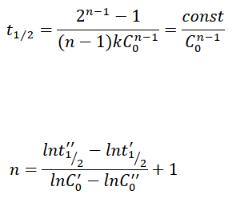
Определения: «частный порядок», «полный порядок», «молекулярность» химической реакции. Период полупревращения:
Порядок реакции – показатель степени при концентрации в кинетическом
уравнении. В приведенном примере |
1 з |
ч |
м п |
д |
м п |
мп |
А, а 2 – |
|||
ч |
м п |
д |
м п мп |
В. С мм ч |
х п |
д |
п |
д л |
полный порядок |
|
реакции: |
= 1 + |
2. |
|
|
|
|
|
|
|
|
Частный порядок - показатель степени при концентрации в инт форме кинетического уравнения.
Порядок реакции является величиной формальной, физического смысла не имеет, |
|
|||||||
определяется экспериментально. |
|
|
|
|
|
|
|
|
Для простых реакций порядок совпадает со стехиометрическим коэффициентом, |
|
|||||||
то есть 1 = , 2 = |
. (П |
м |
з |
ю |
, п |
ющ |
д |
д ю, механизм |
которых правильно отражается стехиометрическим уравнением.) |
|
|
|
|||||
В общем случае, когда механизм реакции включает в себя несколько |
|
|
|
|||||
элементарных стадий, |
1 ≠ , |
2 ≠ . |
|
|
|
|
|
|
Порядок реакции может принимать любые значения – целочисленные и дробные, а также может быть равен нулю. По величине порядка реакции делятся на реакции первого, второго, третьего и т.д. порядков.
Молекулярность – число частиц, участвующих в элементарном акте химического взаимодействия. Молекулярность может принимать значения 1, 2 и 3. По этому признаку реакции делятся на мономолекулярные, бимолекулярные и
тримолекулярные. В простых реакциях значения молекулярности и порядка совпадают. В случае многостадийного процесса можно говорить лишь о молекулярности элементарной стадии.
Период полупревращения – время, которое необходимо для превращения половины исходного количества вещества.
Для реакции n-го порядка период полупревращения равен:
Таким образом, если известны хотя бы два значения периода полупревращения при двух разных начальных концентрациях, порядок реакции можно рассчитать по следующей формуле:
ФХ Экзамен Стр.32

Таблица с кинетическими уравнениями:
- константа скорости для n порядка
Линейные интерпретации кинетических кривых:
ФХ Экзамен Стр.33
Односторонние гомогенные реакции первого, второго, третьего и нулевого порядков, кинетические уравнения (при условии равенства концентраций исходных реагентов в момент начала реакции), линейные интерпретации кинетических кривых:
Реакции первого порядка
В реакцию вступает одно вещество:
пд
Креакциям первого порядка относятся такие процессы как термическое разложение, реакции изомеризации, радиоактивный распад, ряд бимолекулярных реакций при избытке одного из реагентов.
Реакции второго порядка – это реакции вида:
2 п д л + п д
К реакциям первого порядка относятся такие процессы как реакции димеризации, ряд гидоролитических реакций в щелочных растворах и т.д.
Реакции третьего порядка – это реакции вида:
3 п д , 2 + п д л + + п д
Пример реакций третьего порядке – взаимодействие оксида азота (II) с галогенами:
2 + 2 = 2
Реакции нулевого порядка
В ряде случаев при определенных условиях проведения процесса, экспериментально определяемый порядок реакции может оказаться равным нулю.
Примерами реакций нулевого порядка могут служить реакции в насыщенном растворе, находящемся в контакте с избытком нерастворенного реагирующего вещества или гетерогенные каталитические реакции, протекающие на поверхности твердого катализатора при непрерывном подводе реагентов в зону реакции.
ФХ Экзамен Стр.34

Методы определения порядка реакции:
Интегральные методы.
1. Метод подстановки или подбора уравнения
а) Аналитический вариант
Суть метода состоит в подстановке в уравнения для расчета константы скорости реакций разных порядков – первого, второго и третьего экспериментальных данных о концентрации реагирующих веществ в разные моменты времени. Порядок реакции считается выбранным верно, если рассчитанные по соответствующему уравнению значения констант скорости колеблются возле какой-то средней величины, и отклонения от среднего не превышают погрешности измерения.
б) Графический вариант
Суть метода состоит в нахождении такой функции концентрации от времени, которая имела бы линейный характер. Для каждого порядка зависимость концентрации от времени может быть выражена прямой линией, если правильно выбрать систему координат. Так для реакций первого порядка прямая получается в системе координат
− (п м 1), дл |
г п |
д |
– |
м |
д |
1⁄ − (п м 2) , дл |
третьего порядка – в координатах 1⁄ |
2 − |
(п м |
3). |
|
|
|
2. Метод Оствальда-Нойеса
Метод позволяет непосредственно рассчитать порядок реакции на основании зависимости периода полупревращения (или времени достижения любой другой степени превращения) от начальной концентрации реагирующих веществ.
Для реакции n-го порядка период полупревращения равен:
Таким образом, если известны хотя бы два значения периода полупревращения при двух разных начальных концентрациях, порядок реакции можно рассчитать по следующей формуле:
ФХ Экзамен Стр.35

Дифференциальный метод Вант-Гоффа: |
|
|
|
|||
Основан на дифференциальном кинетическом уравнении |
= |
. |
||||
Прологарифмировав это выражение получаем: |
|
|
|
|||
а) Аналитический вариант |
|
|
|
|
|
|
Если известны хотя бы два значения скорости ( |
) п |
д |
х з х |
|||
|
х |
|
|
|
|
|
( |
), п д м ж |
ч |
ь п ф м л : |
|
|
|
В зависимости от исходных данных могут быть использованы как истинные, так и средние скорости реакции.
б) Графический вариант |
|
При наличии достаточно большого числа экспериментальных данных порядок |
|
реакции может быть найден по графику через тангенс угла наклона прямой: |
= . |
Если для нахождения порядка реакции методом Вант-Гоффа были использованы результаты одного опыта, и скорость реакции найдена в разные моменты времени по одной кинетической кривой, то определенный порядок называется временным ( ), поскольку учитывает возможное изменение механизма, а следовательно и порядка, реакции под влиянием образующихся продуктов.
Если же реакция была проведена несколько раз с различными начальными концентрациями, а скорость определена в момент времени = 0, п д
, найденный по таким данным, носит название истинного или концентрационного ( ), поскольку в начальный момент времени влияние продуктов на механизм процесса отсутствует.
Чем больше порядок реакции, тем больше времени потребуется на достижение одной и той же степени превр.
ФХ Экзамен Стр.36

Сложные реакции:
Сложная реакция состоит из нескольких элементарных стадий с участием одних и тех же реагирующих веществ.
При изучении кинетики сложных реакций применяется принцип независимости элементарных стадий:
−Если в системе протекает несколько реакций, то каждая из них идет независимо от остальных, а скорость ее пропорциональна концентрациям реагирующих веществ согласно основному постулату химической кинетики;
−конечное изменение концентрации данного вещества является результатом всех независимо протекающих элементарных реакций, в которых оно принимает участие.
Типы сложных реакций (все реакции первого порядка):
1)обратимые;
2)параллельные;
3)последовательные.
Обратимые реакции
Обратимая реакция первого порядка протекает по схеме:
В некоторый момент времени в системе достигается состояние равновесия. Константа равновесия равна отношению констант скоростей прямой и обратной реакций с одной стороны, и отношению равновесных концентраций продукта реакции и исходного вещества – с другой:
Обозначим: |
|
|
|
|
|
|
|
, – ч ль |
|
|
щ |
А В ( л |
ч л |
п д |
В |
системе отсутствовал, то |
= 0; |
|
|
|
|
|
|
– л ч |
х д г щ |
, п |
г |
ш д |
м м м |
м ; |
|
− л ч |
х д |
г щ |
, п |
г |
ш |
м м |
. |
ФХ Экзамен Стр.37

Параллельные реакции
В ходе параллельных реакций одни и те же исходные вещества реагируют одновременно в двух и более направлениях с образованием различных продуктов. Схема параллельной реакции первого порядка, протекающей по двум направлениям:
Обозначим: |
|
|
|
|
|
|
|
– ч ль |
щ |
А; |
|
|
|
|
|
– л ч |
х д г щ |
А, п |
г |
ш п б м п л |
м |
||
данному моменту времени; |
|
|
|
|
|
|
|
1 − л ч |
х д г щ |
А, п |
г |
ш п п |
м |
п л ю л |
|
количество образовавшегося продукта В. |
|
|
|
|
|
||
2 − л ч |
х д г щ |
А, п |
г |
ш п |
м |
п л ю л |
|
количество образовавшегося продукта D. |
|
|
|
|
|
||
ФХ Экзамен Стр.38

Последовательные реакции
При протекании последовательной реакции продукт образуется из исходных веществ не непосредственно, а через образование одного или нескольких промежуточных веществ. Самый простой случай – промежуточный продукт только один, и каждая стадия имеет первый порядок. Такая реакция протекает по схеме:
Продукт D образуется из исходного вещества А через образование промежуточного вещества В.
Изменение концентрации вещества А происходит как в обычной необратимой реакции первого порядка:
ФХ Экзамен Стр.39

Табличка со сложными реакциями:
Кинетические кривые:
ФХ Экзамен Стр.40
