
- •Внутренняя энергия, энтальпия и тепловой эффект реакции
- •7.2. Стандартные условия и стандартное состояние. Стандартная энтальпия образования
- •7.3. Термохимические уравнения. Закон Гесса. Энергия связи.
- •7.4. Энтропия
- •7.5. Изобарно-изотермический потенциал и направление химических реакций
- •Влияние концентраций реагирующих веществ на скорость реакции
- •Влияние температуры и природы реагирующих веществ на скорость химической реакции
- •Катализ
Влияние концентраций реагирующих веществ на скорость реакции
Элементарные и сложные реакции. Закон действующих масс. Элементарные, или простые реакции – это реакции, протекающие в одну стадию. Большинство химических реакций представляют собой сложные процессы, протекающие в несколько стадий, т. е. состоящие изнескольких элементарных процессов.
Для элементарных реакций справедлив закон действующих масс:
скорость элементарной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции.
Закон открыт К. М. Гульдбергом и П. Вааге в 1864-1867 гг.
Для реакции в общем виде аА+bВ...-›продукты ее скорость, согласно закону действующих масс, выражается соотношением
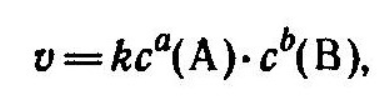
где с (А) и с (В) - молярные концентрации реагирующих веществ А и В ;k- константа скорости данной реакции, равная , если (А)=1 и (В)=1, и зависящая от природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций).
Таблица 8.1. Молекулярность, порядоки кинетические уравнения элементарных гомогенных реакци
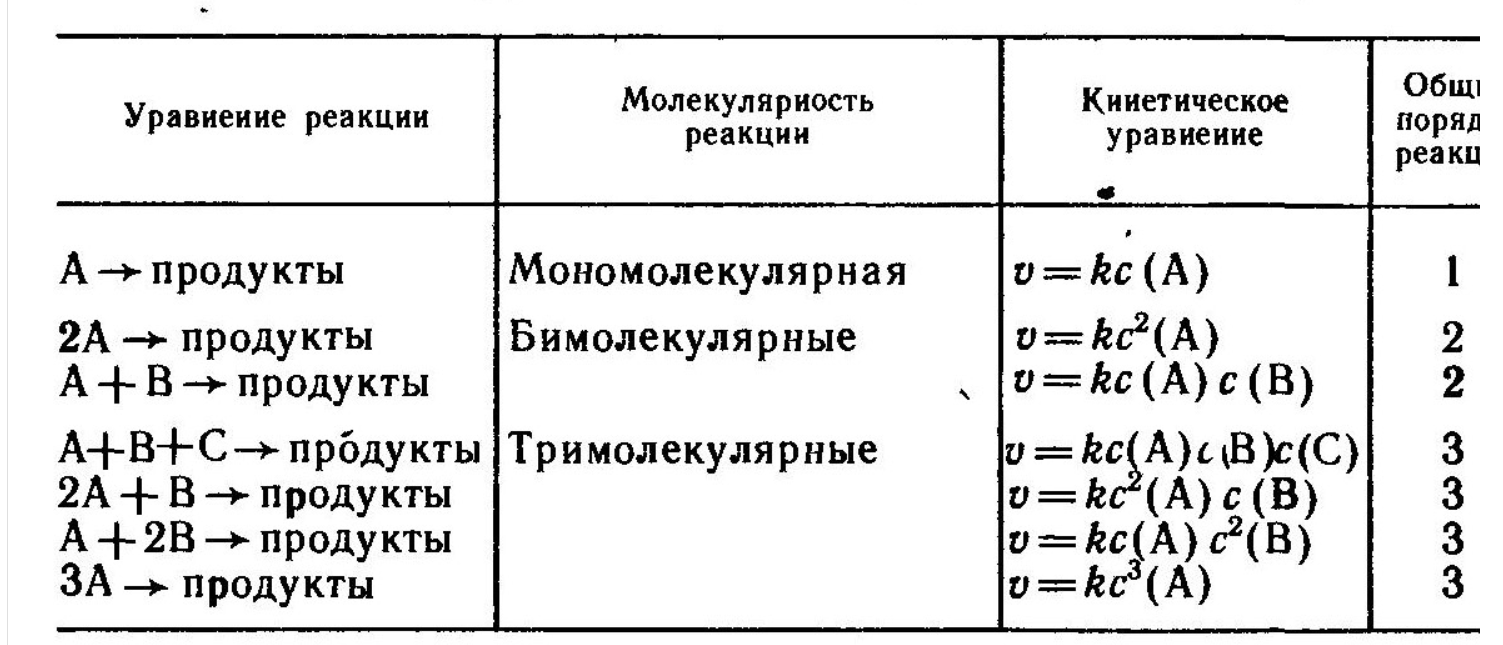
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
Кинетические уравнения простых гомогенных реакций приведены в табл. 8.1.
В случае сложных реакций закон действующих масс применим к каждой отдельной стадии.
Для гетерогенных реакций в кинетическое уравнение входят только концентрации газообразных и растворенных веществ. Так, для реакции горения серы Ѕ+ -› уравнение скорости имеет вид v=kс.
Молекулярность и кинетический порядок реакции. Понятие «молекулярность реакции» применимо только к простым реакциям. Молекулярность реакции характеризует число частиц, участвующих в элементарном взаимодействии.
Различают моно-, би- и тримолекулярные реакции,в которых участвуют соответственно одна, две и три частицы. Вероятность одновременного столкновения трех частиц мала. Элементарный процесс взаимодействия более чем трех частиц неизвестен.
Примеры элементарных реакций:
+NO+ (мономалекулярная);
2N (бималекулярная);
2NO+ (тримолекулярная);
Молекулярность простых реакций совпадает с общим кинетическим порядком реакции (табл. 8.1). Порядок реакции определяет характер зависимости скорости от концентрации. Общий (суммарный) кинетический порядок реакции - сумма показателей степеней при концентрациях реагирующих веществ в уравнении скорости реакции, определенном экспериментально.
Влияние температуры и природы реагирующих веществ на скорость химической реакции
Правило Вант-Гоффа. Температурный коэффициентскорости реакции. Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза:
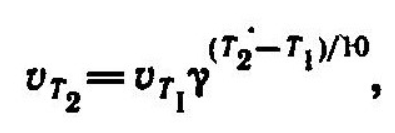
где и - скорость реакции соответственно при температурах и ); γ-температурный коэффициент скорости реакции.
С помощью правила Вант-Гоффа возможно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции от температуры осуществимо в рамках теории активации Аррениуса.
Теория активации Аррениуса. Энергия активации. Химическая реакция может происходить только при столкновении активных частиц. Активными называются частицы, которые обладают определенной, характерной дляданной реакции энергией, необходимой для преодолениясил отталкивания, возникающих между электронными оболочками частиц.
Активные частицы при столкновении могут образовать промежуточную неустойчивую группировку, находящуюся в состоянии перераспределения связей, называемую активированным комплексом, при дальнейшем превращении которого образуются продукты реакции.
Влияние температуры на скорость химической реакции в теории активации отражается следующим уравнением для константы скорости реакции:
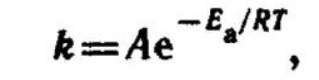
где А - постоянный множитель, не зависящий от температуры и концентрации; R - универсальная газовая постоянная; - энергия активации; е - основание натурального логарифма.
Энергия активации равна разности между средней энергией реагирующих частиц и энергией активированного комплекса. Энергия активации является характеристикой каждой реакции и определяет влияние на скорость химической реакции природы реагирующих веществ. Для большинства химических реакций энергия активации меньше энергии диссоциации наименее прочной связи в молекулах реагирующих веществ.
