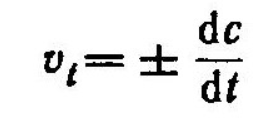- •Внутренняя энергия, энтальпия и тепловой эффект реакции
- •7.2. Стандартные условия и стандартное состояние. Стандартная энтальпия образования
- •7.3. Термохимические уравнения. Закон Гесса. Энергия связи.
- •7.4. Энтропия
- •7.5. Изобарно-изотермический потенциал и направление химических реакций
- •Влияние концентраций реагирующих веществ на скорость реакции
- •Влияние температуры и природы реагирующих веществ на скорость химической реакции
- •Катализ
7.5. Изобарно-изотермический потенциал и направление химических реакций
Изменение энтальпии в ходе химической реакции не служит критерием ее направления. Самопроизвольно могут протекать как экзотермические, так и эндотермические реакции, хотя при обычных условиях последние и менее многочисленны. Критерием принципиальной осуществимости процессов, протекающих в закрытой системе при постоянных температуре и давлении, является изменение в ходе процесса термодинамической функции состояния, называемой изобарно-изотермическим потенциалом ∆G (G=Н—TS) или просто изобарным потенциалом (синонимы: энергия Гиббса, свободная энергия).
Изменение изобарного потенциала отражает влияние на направление химической реакции двух конкурирующих тенденций, одновременно действующих в системе: 1) к минимуму энергии и 2) максимуму энтропии.
При постоянной температуре
∆G=∆H-T∆S. (7.6)
Условие принципиальной возможности протекания процесса при постоянных температуре и давлении —
∆G<0,
т.е. при Т=const и p=const реакции могут протекать самопроизвольно ( без затраты работы) в сторону уменьшения изобарного потенциала.
Если ∆G<0, протекание реакции принципиально возможно, но практически может не осуществляться из-за кинетических затруднений.
Процесс принципиально невозможен в данных условиях, если
∆G>0.
В системе наступило химическое равновесие, если ∆G=0.Чем более отрицательно значение ∆G, тем дальше система от состояния равновесия, тем более она реакционноспособна.
Как следует из выражения (7.6), изменение изобарного потенциала отражает влияние на направление протекания процесса как энтальпийного фактора ∆Н, так и энтропийного T∆S. В зависимости от температуры влияние одного из этих факторов на значение и знак ∆G и, следовательно, на направление процесса может быть определяющим (табл.7.1).
Влияние температуры на ∆Н и ∆S незначительно, поэтому при повышении температуры ∆Н практически не изменяется, а T∆S растет. При достаточно высоких температурах │T∆S│>>│∆H│и ∆G ≈ -T∆S.
Следовательно, ∆G<0, если ∆S>0(∆H>0) или ∆H<0).
Критерием принципиальной осуществимости процесса при достаточно высоких температурах является изменение энтропии. При высоких температурах самопроизвольно могут протекать реакции, сопровождающиеся увеличением энтропии.
При достаточно высоких температурах все химические соединения разлагаются (∆S>0), хотя эти процессы эндотермичны (∆Н>0). Энтропийный фактор оказывает определяющее влияние также на направление процесса растворения кристаллических веществ в жидкостях, сопровождающегося поглощением теплоты (∆H>0). В данном случае ∆S>>0 и │T∆S│>>│∆H│, следовательно ∆G ≈ - T∆S и ∆G>0. При низких температурах для реакций со значительным тепловым эффектом │∆H│>>│T∆S│и ∆G ≈∆H. Следовательно, ∆G<0, если ∆H<0 (∆S>0 или ∆S<0). Таким образом, возможность самопроизвольного протекания реакции при низких температурах определяется изменением энтальпии. При низких температурах самопроизвольно могут протекать только экзотермические реакции. Для большинства реакций, идущих при обычных температуре и атмосферном давлении, │∆H│>│T∆S│, т.е. в обычных условиях эндотермические реакции (∆H>0) редко протекают самопроизвольно, в отличие от экзотермических ((∆H<0). Изменение изобарного потенциала в ходе химической реакции определяется следующим образом:
∆Gреакц=∆Hреакц-T∆Sреакц.
Или аналогично выражению для ∆Hреакц (так как G – функция состояния):
∆Gреакц=∑∆fG(продуктов) - ∑∆fG(раегентов),
Где ∆fG – изобарный потенциал образования соединения.
Обычно определяют изменение стандартного изобарного потенциала реакции по стандартным изобарным потенциалам образования продуктов и реагентов при 298 К:
∆G○298(реакц)=∑∆fG○298(продуктов) -∑∆fG○298(реагентов).
Стандартный изобарный потенциал образования соединения при температуре T∆fG○T (чаще сего при 298 К ∆fG○298)) равен изменению изобарного потенциала реакции образования 1 моль этого соединения при давлении p=101 кПа в данной температуре Т из простых веществ, находящихся в стандартном состоянии.
Для простых веществ в стандартном состоянии
∆fG○T=0 и ∆f G○298=0.
Стандартный изобарный потенциал образования соединения при 298 К (∆f G○298) определяется по уравнению
∆fG○298=∆fН○298 - T∆fS○298,
Где ∆fН○298 –справочная величина, а ∆fS○298 рассчитывается по уравнению (7.5)
ПОНЯТИЕ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ. ФАКТОРЬІ, ВЛИЯЮЩИЕ НА СКОРОСТЬ
Скорость химической реакции равна числу актов взаимодействия в единицу времени в единице объема для реакций, протекающих в гомогенной системе (для гомогенных реакций), или на единице поверхности раздела фаз для реакций, протекающих в гетерогенной системе (для гетерогенных реакций).
Гомогенная система состоит из одной фазы, гетерогенная - из нескольких фаз. Фазой называется часть системы, отличающаяся по своим физическим или химическим свойствам от других частей системы и отделенная от них поверхностью раздела, при переходе через которую свойства системы резко меняются.
Скорость гомогенной реакции количественно можно характеризовать изменением концентрации (обычно молярной) любого участника реакции в единицу времени (как правило, выражаемого в секундах).
Средняя скорость реакции , в интервале времени от до определяется соотношением
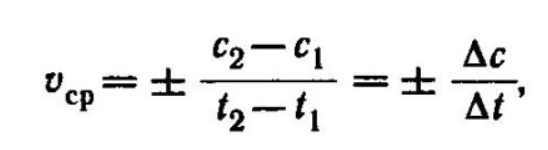 где
и
- молярная концентрация любого участника
реакции в моменты времени и соответственно.
Знак«-» перед дробью относится к
концентрации исходных веществ, с<0,
знак «+» - к
концентрации продуктов реакции, с>0.
где
и
- молярная концентрация любого участника
реакции в моменты времени и соответственно.
Знак«-» перед дробью относится к
концентрации исходных веществ, с<0,
знак «+» - к
концентрации продуктов реакции, с>0.
Мгновенная скорость - это скорость реакции в данный момент времени t. Она определяется производной от концентрации по времени: