
652
.pdfДиффузия (молекулярная) – это самопроизвольный процесс (идет с ростом энтропии системы). В дальнейшем для краткости молекулярную диффузию будем называть просто диффузией.
Перемещение частиц (скорость, механизм и др.) в большей мере определяется структурой диффузионной среды, т.е. диффузия структурно чувствительна.
В зависимости от того, где идет распространение частиц диффузанта, диффузию называют поверхностной (по поверхности кристалла, жидкости), граничной (по дефектным граничным слоям зерен), объемной (в объеме жидкости, кристалла), газовой (в газовой среде).
Механизм перемещения частиц в газе является броуновским. Решение задачи броуновского движения частиц дали А. Эйнштейн и М. Смолуховский.
Механизм перемещения частиц в твердых телах из-за отсутствия прямых наблюдений описывают с помощью модельных представлений: вакансионный (перескок атома в соседнюю вакансию), обменный (две частицы меняются местами), циклический обменный (кольцо из нескольких частиц «проворачивается»), межузельный (частица небольшого размера перемещается по межузельным пустотам, например, в растворе внедрения), краудионный (сдвиг цепочки частиц) и др. В жидких металлах, в рамках представлений о кластерном их строении, частицы могут перемещаться по объему кластера и по межкластерной разупорядоченной зоне. Долю частиц, перемещающихся по определенному механизму, точно определить не удается. Считают, что основной механизм диффузии в твердых растворах замещения – вакансионный, в твердых растворах внедрения – междуузельный.
Формально (без учета механизма), на основе опытных данных, молекулярную диффузию описывают как диффузионный поток частиц в единицу времени через определенную площадь под влиянием движущих сил. Движущей силой диффузии в общем случае является градиент термодинамического потенциала, в частных случаях это градиенты концентрации, температуры, давления, электрического поля и др.
При небольших концентрациях вещества в растворе (коэффициент активности постоянен) диффузионный поток в направлении х представляют формулой:
n = dm |
= −ω D dС |
+ K dT |
+ K |
dP |
+ ... |
, |
|
dτ |
|
dx |
T dx |
|
Р dx |
|
|
21
Стр. 21 |
ЭБ ПНИПУ (elib.pstu.ru) |

где dmdτ – поток частиц в единицу времени; m – число частиц; ω – пло-
щадь, перпендикулярная потоку; ddxС , dTdx , dPdx – градиент концентрации
диффундирующего вещества, температуры, давления вдоль пути потока; D – концентрационный коэффициент, названный коэффициентом диффузии; KТ , KР – коэффициенты термодиффузии, бародиффузии.
При T = 0, P = 0, ω = 1 и при отсутствии других градиентов кроме небольшого C для стационарного процесса (D = const) А. Фиком установлено:
dmdτ = − D ddxС (первый закон Фика);
dС = D d 2С2 (второй закон Фика). dτ dx
Физический смысл D: поток частиц при C = 1, ω = 1 за еди-ницу времени.
Интеграл второго уравнения системы (21), т.е. второго закона Фика, будет равен для бесконечно длинного цилиндра при взаимной диффузии двух газов следующему выражению:
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
С0 |
|
С0 |
|
4Dt |
|
− y2 |
|
С0 |
|
|
x |
|
Сt,x = |
2 |
− |
|
|
|
e |
|
dy ≈ |
2 |
1 |
− ϕ |
|
, |
π |
|
|
|||||||||||
|
|
0 |
|
|
|
|
|
4Dt |
|||||
где с0 – концентрация в начале процесса диффузии в сечении трубы 0–0;
ϕ |
x |
|
– функция, значение которой можно взять из справочника по |
|
|||
|
4Dt |
|
|
значениям функций Фурье–Фика.
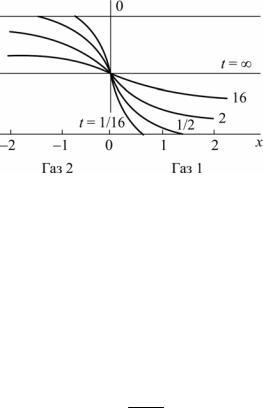
На рис. 2 представлено решение этого уравненения в виде изохрон концентраций (линий для постоянного значения времени), причем с увеличением времени при данном значении х (расстояние от начального сечения) концентрация возрастает и стремится к значению С0/2. Расчет развития диффузионных процессов на основании второго закона Фика сохраняется для жидких и для твердых сред, но коэффициенты диффузии будут значительно меньше, чем для газообразных систем.
Для газообразных систем коэффициенты диффузии вычисляют на основании кинетической теории газов:
22
Стр. 22 |
ЭБ ПНИПУ (elib.pstu.ru) |
D = λu/3,
где λ – длина свободного пробега; u – средняя скорость движения газовых молекул. Размерность коэффициента диффузии сохраняется (м2·с–1).
Рис. 2. Решение уравнения Фика для взаимной диффузии двух газов в бесконечном цилиндре
в зависимости от времени
Коэффициенты диффузии в жидкостях на несколько порядков меньше, чем в газах, например коэффициент диффузии магния в жидком алюминии при 973 К составляет 7,54 10–9 м2 с–1, а коэффициент диффузии NaNО3 врасплавленном KNО3 при 633 Ксоставляет5,22 10–9 м2 с–1.
Коэффициенты диффузии в жидкостях могут быть рассчитаны по уравнению Стокса
D = kT
6πηr
где k – постоянная Больцмана; Т – температура; η – коэффициент вязкости среды; r – радиус частицы.
Зависимость D от T описывают обычно уравнением Аррениуса
D = D e− |
ED |
, |
(22) |
||
RT |
|||||
0 |
|
|
|
|
|
где D0 – предэкспонентный множитель, м2/с; ED – мольная энергия ак- |
|||||
тивации диффузии, Дж/моль; в газе ED |
≈ |
|
RT |
(≈ 8 кДж/моль), в жидких |
|
2 |
|||||
|
|
|
|||
металлах ED ≈ 20…80 кДж/моль. Величины ED и D0 определяют для данной системы по опытным значениям D не менее чем для двух температур.
23
Стр. 23 |
ЭБ ПНИПУ (elib.pstu.ru) |
Для твердых кристаллических тел коэффициенты диффузии еще меньше Высокая энергия активации диффузии в твердых телах делает коэффициенты диффузии очень малыми согласно уравнению (22).
Коэффициенты диффузии компонентов в жидком железе приведены в табл. 1.
|
|
|
Таблица 1 |
Коэффициенты диффузии компонентов в жидком железе |
|||
|
|
|
|
Элемент |
t, °С |
D0 10–9, м2/с |
ЕD, кДж/моль |
C |
1550 |
7,9 |
50,4 |
N |
1600 |
3,77 |
38,6 |
O |
1600 |
4,5 |
21,0 |
S |
1550 |
4,7 |
33,0 |
Mn |
1680 |
0,61 |
67,1 |
Si |
1560 |
3,8 |
37,8 |
2.6. Модифицирование металла сварного шва
Многообразие и сложность структуры сварных швов определяются физико-химическими процессами между металлической, шлаковой и газовой фазами. Управление структурообразованием сварных швов невозможно без исследования влияния металлургических факторов: формирования сварочной ванны, взаимодействия фаз в зоне сварки, первичной и вторичной кристаллизации металла шва.
Одним из путей решения проблемы повышения вязкопластических свойств металла сварного шва низкоуглеродистых сталей является модифицирование мелкодисперсными частицами карбонитридных фаз. Модифицирование шва при дуговых способах сварки наблюдается при микролегировании азотом в сочетании с нитридообразующими элемен-
тами (Ti, V, Zr, Al).
Модифицирующее действие мелкодисперсных частицы карбонитридных фаз этих элементовможетосуществляться двумя путями (рис. 3).
Во-первых, тугоплавкие мелкодисперсные частицы карбонитридов, присутствующие в жидкой стали, служат дополнительными центрами кристаллизации – в результате формируется структура металла шва с мелким зерном (модифицированная структура). Так действуют модификаторы I рода.
Во-вторых, мелкодисперсные частицы карбонитридов распологаются на границе растущих кристаллов твердой фазы и тормозят рост зерен. Это модификаторы II рода.
24
Стр. 24 |
ЭБ ПНИПУ (elib.pstu.ru) |


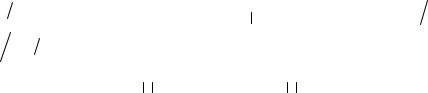
•для сварки под флюсом;
•для ручной дуговой сварки.
Рассмотрим реакцию образования карбонитридных фаз в железе:
|
|
|
|
|
|
|
|
|
|
|
|
|
Ti |
|
+ x |
|
C |
|
+ (1− x) |
|
N |
|
= TiCx N1− x , |
(23) |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
которая может быть представлена суммой реакций (Дж): |
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
Ti |
|
|
|
|
= Ti |
|
|
|
|
|
|
|
|
|
G0 |
= 69500 + 27,28 T , [Дж], |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
= C |
|
|
|
|
|
|
|
|
|
G0 |
|
|
|
= −22600 + 42,3 T, [Дж] |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
N |
|
|
|
|
= 1/ 2N |
|
|
|
|
|
|
|
|
|
|
|
G0 |
|
= −10500 − 20,37 T, [Дж], |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
1% |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
T 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ti + xC + (1− x)1/ 2N2 = TiCx N1− x . |
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
Решая уравнение |
G0 |
|
|
|
|
|
= −RT ln K с расшифровкой K1 |
через |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1,24 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
%i |
|
fi относительно Т, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
Ti = {− ( A 19,14) + 2557 lg f |
|
Ti |
|
1873 + x 2557 lg f |
|
C1873 + (1− x)3280lg f |
|
N |
|
1873} |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
{(B 19,14) |
− (lg |
|
|
|
%Ti |
|
|
|
%C |
|
x |
|
%N |
|
(1− x) )+ 0,365lg f |
|
Ti |
|
1873 + |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ x 0,365lg fC 1873 + (1− x) 0,75lg f N 1873 }
Это уравнение позволяет оценить термодинамическую температуру начала выделения включений TiCхN1−х с различным х при охлаждении сплава.
Величины А и В в уравнении для Ti следующие:
х |
−A, Дж |
B |
0 |
263223 |
101,13 |
0,3 |
233640 |
101,58 |
0,5 |
213433 |
98,83 |
0,8 |
182425 |
90,04 |
1,0 |
161271 |
81,08 |
Результаты расчета рациональных температур начала выделения фаз приведены в табл. 2.
Полученные величины Тр показывают, что при охлаждении сварного шва указанного состава термодинамически вероятно выделение, в первую очередь, нитрида титана (с Тр = 1465 К), затем – карбонитридов
27
Стр. 27 |
ЭБ ПНИПУ (elib.pstu.ru) |
титана в порядке повышения в них доли углерода и, в последнюю очередь, карбида титана с дефицитом углерода.
Таблица 2
Рациональная температура, Тр, К начала выделения TiN, TiCxN1–x, TiC и TiC0,6 в сварном шве стали Ст3
|
Рациональная температура начала выделения частиц : |
|
||||
TiN |
TiN* |
|
TiCxN1–x |
|
TiC |
TiC0,6 |
х = 0 |
х = 0 |
х = 0,3 |
х = 0,5 |
х = 0,8 |
х = 1 |
– |
1588 |
1465 |
1349 |
1276 |
1186 |
1000 |
972 |
* Расчет произведен с использованием |
G0 образования TiN по разным |
|||||
|
|
|
|
T |
|
|
справочным данным
2.7. Кинетика процесса выделения упрочняющих фаз в сварном шве
Одним из главных факторов, повышающих качество металла сварного шва, является возможность модифицирования структуры дисперсными частицами вторичных фаз. При ручной дуговой сварке углеродистых сталей рутиловыми электродами такими частицами являются нитриды, карбонитриды и карбиды титана, которые образуются в результате окислительно-восстановительных реакций между компонентами электродного покрытия, газовой фазой и металлом. В разделе 2.6 на основе сравнения расчетных термодинамических и фактических концентраций титана и азота показано, что образование дисперсных модифицирующих частиц происходит ниже температуры кристаллизации стали. В результате измельчения зерна повышается ударная вязкость и понижается температурный порог хладноломкости металла шва.
Полученные на основе термодинамического расчета выводы относительно условий образования модифицирующих частиц являются ориентировочными, поскольку в алгоритм расчета не входят основные кинетические характеристики структурообразования в сварных швах, такие, например, как скорость охлаждения. Скорость охлаждения сварного шва существенно влияет на результат структурных и фазовых превращений, поэтому необходимо дополнить полученные на основе термодинамического расчета данные кинетическими закономерностями роста модифицирующих частиц в условиях сварки.
При построении математической модели кинетики роста частиц нитрида титана в сварном шве, используем шаговый метод расчета. Интервал охлаждения сварного шва, определенный по температурному
28
Стр. 28 |
ЭБ ПНИПУ (elib.pstu.ru) |
циклу сварки, делили на участки по 20 К. Устанавливаем время пребывания металла шва в пределах этого температурного интервала и для каждого шага рассчитываем концентрационную ситуацию, предполагая, что на межфазных границах устанавливается локальное термодинамическое равновесие, а кинетика процессов близка к диффузионной.
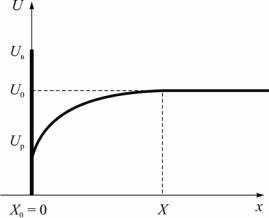
Диффузионная подвижность атомов внедрения в твердой фазе многократно превышает подвижность металлических атомов. Поскольку кинетика роста фазы определяется наиболее медленным из диффузионных потоков, то определяющим при образовании карбидов и нитридов является диффузия титана. Схема распределения концентрации титана в области, окружающей частицы нитрида титана, на основе которой построена модель, приведена на рис. 5.
Рис. 5. Схематичное распределение концентрации элемента, образующего включение, вблизи растущей частицы
в случае полубесконечной матрицы
На границе с включением устанавливается равновесная концентрация титана Up. Начальная концентрация титана в металле шва (матрице) – U0, концентрация во включении – Uв. Положение межфазной границы включение – матрица в начальный момент – Х0 = 0.
Задача кинетики заключается в нахождении для условий сварки следующих величин:
• распределения концентрации растворенного вещества (титана) в диффузионной области с учетом особенностей охлаждения сварного шва – U(x, τ, Т), где х – текущая координата, τ – время, Т – температура;
•размеров этой диффузионной области – Х;
•и, в конечном итоге, размеров включения (нитрида) – S.
29
Стр. 29 |
ЭБ ПНИПУ (elib.pstu.ru) |
Для нахождения распределения концентрации растворенного вещества в рамках модели постоянных коэффициентов диффузии используем второе уравнение Фика:
∂U |
= D |
∂2U |
, |
(24) |
∂τ |
|
∂x2 |
|
|
где D – коэффициент диффузии растворенного вещества. Начальные и граничные условия выражены следующим образом:
U(x = X0, τ) = Up, U(x = ∞ ,τ) = U0, U(x < X0, τ) = Uв. |
(25) |
На межфазной границе должно выполняться условие баланса масс:
(Uв − Uр ) |
dx |
|
∂U |
(26) |
dτ |
= D |
. |
||
|
|
∂x x= X |
|
Распределение концентрации растворенного вещества в полубесконечной матрице в случае образования включения имеет вид:
U (x, τ,T ) = U0 |
+ (Uр − U0 ) |
erfc[(x − S0 ) / 2 |
Dτ] |
(27) |
erfc(k / D) |
|
|||
|
|
|
|
Константа k находится из условия баланса масс: подставив (27) в (26), получим уравнение)
πk erfc(k D ) exp(k2 D) = |
D |
Uр − U0 |
(28) |
|
Uр − Uв |
||||
|
|
|
Коэффициент самодиффузии титана в аустените рассчитываем по выражению
DTi = 68 10–4exp(–251000/RT), |
(29) |
DTi – в м2/с, R – Дж/моль К |
|
В качестве условия термодинамического равновесия на границе TiN – аустенит используем температурную зависимость равновесной концентрации титана в сварном шве (в ат.%):
Up(T) = 1,137 10–6 Т2 – 2,538 10–3 Т +1,409, ат.% |
(30) |
Начальную температуру нитридообразования в твердой фазе устанавливали по приведенной математической модели, считая за темпера-
30
Стр. 30 |
ЭБ ПНИПУ (elib.pstu.ru) |
