
652
.pdf•кинетика физико-химических реакций;
•формирование химического состава сварочной ванны;
•модифицирование металла сварного шва.
2.2. Прогнозирование физико-химических реакций при сварке плавлением
Для создания эффективных технологических процессов сварки плавлением необходимо прогнозировать ход физико-химических реакций и применять способы управления, препятствующие их развитию в неблагоприятном направлении.
Вцелях прогнозирования хода физико-химических реакций используют методы термодинамического анализа, допуская при этом, что, несмотря на кратковременность процесса сварки, высокие температуры нагрева металла и большая удельная поверхность его контакта со средой обеспечивают практическое достижение термодинамического равновесия в системе, представляющей собой зону сваривания.
Вусловиях термодинамического равновесия для анализа развития физико-химических реакций следует определить изобарно-изотермный
потенциал Гиббса (энергию Гиббса) G. Существует ряд методов расчета этого потенциала (Темкина−Шварцмана, Владимирова и др.), отличающихся по точности, простоте и универсальности. Для экспертной инженерной оценки вполне применим метод Улиха, опирающийся на наличие большого количества справочных данных о термодинамических свойствах различных веществ: теплоемкости, энтальпии, энтропии.
Теплоемкость Ср − количество теплоты, необходимое для нагрева единицы вещества на 1 К при постоянном давлении. В качестве единицы вещества принимают 1 моль, т.е. число граммов, равное молекулярной массе вещества. Такая теплоемкость называется молекулярной.
Энтальпия Н − теплосодержание вещества или системы в конкретных условиях (температуры, давления, концентрации). Она определяет количество теплоты, которое требуется передать веществу или системе, т.е. группе веществ, участвующих в физико-химической реакции, чтобы привести ее в данное состояние. Принято измерять приращение энтальпии Н0 по отношению к ее величине в стандартных условиях (р = 1 ат = = 105 Па, Т = 25 °С = 289 К).
Для экзотермических реакций, идущих с выделением теплоты, энтальпия убывает, т.е. она обратна тепловому эффекту реакции по знаку.
11
Стр. 11 |
ЭБ ПНИПУ (elib.pstu.ru) |
Приращение энтальпии вещества HТ0 в пределах одного агрегатного состояния пропорционально температуре ( Т) и его теплоемкости (Ср):
HТ0 = Cp T . |
(11) |
Ср = const в приближенных расчетах. При переходе из одного фазового или агрегатного состояния вещества в другое энтальпия изменяется на Нпр − энтальпия плавления, испарения и т.д.
Вторая составляющая изменения внутренней энергии системы − энтропия S. Это энергия, расходуемая на изменение внутреннего строения вещества, степени беспорядка его атомно-кристаллического строения. Она также зависит от температуры, давления р и концентрации Nс элементов в сплавах. При р = const и Nс = const S = Q T , где Q −
T , где Q −
приращение энергии вещества или системы при нагреве на 1 К. Суммируя Н и S, определяют приращение термодинамического
потенциала Гиббса (энергии Гиббса) G для конкретной температуры по отношению к стандартной. Для простых веществ, не претерпевающих превращений,
|
|
G0 = |
H 0 − S0T . |
(12) |
|
|
|
Т |
|
Т |
|
Однако при определении Н0 следует иметь в виду, что Ср зависит |
|||||
от температуры. |
|
|
|
|
|
Приближенный расчет |
G0 |
, учитывающий эту зависимость, про- |
|||
|
|
Т |
|
|
|
водят по формуле Улиха: |
|
|
|
|
|
G0 |
= |
H 0 |
− |
S0T − C0M T . |
(13) |
т |
|
|
|
p 0 |
|
В этой формуле Н0, |
S0 и |
Cp0 |
− приращение энтальпии, энтропии |
||
и теплоемкости реагирующих веществ при стандартных условиях. Их значения содержатся в справочниках [13, 14].
Погрешность, создаваемая допущением постоянства Cpт = Cp0
при 298 К, компенсируется табличным коэффициентом М0, который изменяется от 0 до 2,5 при нагреве от 298 до 8000 К.
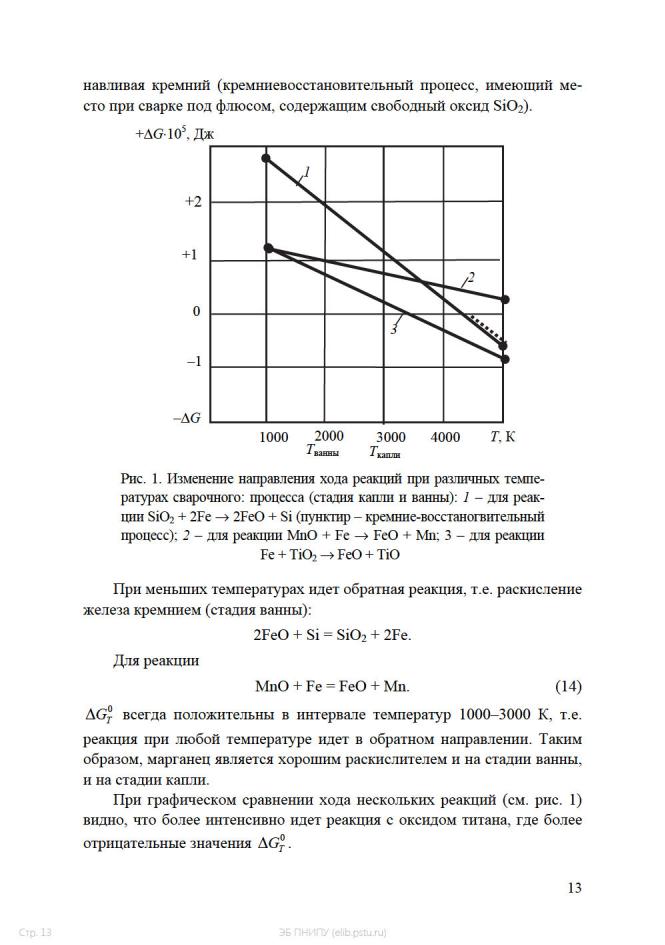
Графически ход реакции (12) при различных температурах изображен на рис. 1, где по горизонтали отложены значения температуры, а по
вертикали − значения GТ0 , подсчитанные по методу Улиха.
На рис. 1 видно, что при температурах выше 4200 К, т.е. на стадии капли, реакция идет в прямом направлении, окисляя железо и восста-
12
Стр. 12 |
ЭБ ПНИПУ (elib.pstu.ru) |
2.3. Расчет массы продуктов реакций
Для реакций с участием газовой фазы расчет массы продуктов реакцииопределяют потемпературнойзависимости константыравновесия Kр.
Рассмотрим это на примере реакции диссоциации мрамора:
CaCO3 = CaO + CO2. |
(15) |
||
Константа равновесия: |
|
|
|
Kp = |
[CaO] PCO2 |
. |
(16) |
|
|||
|
[CaCO3 ] |
|
|
В числителе представлено произведение концентраций продуктов реакции (с учетом стехиометрических коэффициентов), а в знаменателе− исходных веществ. Для газообразного вещества – углекислого газа CO2 – концентрация есть ни что иное, как его давление. Поскольку CaO и CaCO2 − твердые конденсированные вещества, ихконцентрациипринимают за 1.
Константа равновесия Kр является функцией температуры. Она растет при протекании реакции в прямом направлении.
Подсчет температурной зависимости Kр проводят по уравнению Вант-Гоффа:
|
ln Kp = |
− |
G0 |
, |
(17) |
|
|
Т |
|||
|
|
|
RT |
|
|
где G0 |
− потенциал Гиббса для данной температуры; R − газовая по- |
||||
Т |
|
|
|
|
|
стоянная, численно равная работе расширения 1 моль газа при нагреве на 1 К, а Т − температура.
Обычно G0 |
в справочниках дается в виде зависимости от Т: |
|
|
T |
|
|
|
|
G0 |
= А + ВТ, |
(18) |
|
T |
|
|
где для определенного интервала температур А и В – постоянные. При известной для заданной Т величине GT0 по уравнению (17) легко вы-
числить Kр при этой температуре.
По определению, Kр зависит только от Т. Это позволяет по величине Kр, вычисленной по GT0 (для Р = 1 атм), определять равновесные
активности или концентрации участков реакции и для нестандартных условий (Р ≠ 1 атм), что расширяет условия применимости термодинамических расчетов равновесия.
14
Стр. 14 |
ЭБ ПНИПУ (elib.pstu.ru) |
Понятия активности пока не имеют точного определения, поэтому для конкретных реакций их представляют по-разному:
1.Если в реакции участвует чистое вещество (элемент, соединение), то его активность принимается равной 1.
2.Активность газообразного участника реакции при давлении примерно до 10 атм приравнивают его парциальному давлению (в атмосферах).
3.В случае, когда участник реакции находится в растворе, который можно считать идеальным, его активность приравнивают его содержанию в растворе, выраженному в атомных (мольных) долях.
4.Когда участник реакции находится в реальном растворе, его активность представляют произведением его содержания на коэффициент активности. (Неопределенность понятия активности переходит в неопределенность понятия коэффициента активности.)
Взависимости от выбранного состояния сравнения (стандартного состояния вещества) содержание вещества в растворе чаще выражают
через мольную (атомную) долю Xi (стандартное состояние − чистое вещество, элемент) или через массовую долю − мас. % (стандартное состояние − гипотетический 1 % раствор вещества, принятый условно за
идеальный) − Ci.
В первом случае
ai = Xi γi ,
во втором
ai′ = %i fi .
Величины коэффициентов активности γi и fi не равны друг другу. Они определяются опытным путем или оцениваются с помощью различных теорий. Для инженерных расчетов γi и fi часто относятся к справочным данным. Обычно fi называют коэффициентом активности по Генри. Оп-
ределить опытным путем коэффициенты активности элементов во всех реальныхмногокомпонентныхрастворахпрактически невозможно.
Выходом из этой ситуации является, в частности, определение коэффициента активности элемента в многокомпонентном разбавленном растворе с помощью параметров взаимодействия Вагнера. С учетом только первого параметра взаимодействия (так как второй и третий редко бывают известны):
15
Стр. 15 |
ЭБ ПНИПУ (elib.pstu.ru) |

ln γi = ln γi + εij X j , |
(19) |
где γi − коэффициент активности элемента i в разбавленном растворе; |
|
εij − параметр взаимодействия, величина которого показывает степень влияния компонента j на γi; Хj − атомная доля компонента j.
|
|
|
lg fi = eij Cj , |
(20) |
где e j − коэффициент взаимодействия, определяющий степень влияния |
||||
i |
|
|
|
|
элемента j на fi; Сj − cодержание компонента j в растворе, мас. %. |
|
|||
Величины ε j |
и e j |
определяются в опыте и приводятся в справоч- |
||
i |
i |
|
|
|
никах. |
|
|
|
|
Опытные значения |
ε j |
и e j относятся к определенной основе спла- |
||
|
|
i |
i |
|
ва. Полнее других они найдены только для сплавов на основе Fe и Ni. Величины γi, γi , ε, e зависят от Т. В справочниках они даны для оп-
ределенной Т (для расплавов на основе Fe и Ni для 1873 К). Необходимо иметь в виду, что εij = εij , но eij ≠ eij .
Связь между εij и eij :
εij = 230 M j eij + M1 − M j ,
M1 M1
где М1 − атомная масса основы сплава; Мj − атомная масса элемента j.
eij = 4,342 10−3 |
|
M |
1 |
εij + |
M j − M1 |
|
||||
|
|
|
|
|
||||||
M |
|
M |
|
|||||||
|
|
|
|
|
j |
|
j |
|
||
|
|
|
|
|
|
|
|
|
||
При небольших различиях Mi и Mj |
|
|
|
|
|
|
|
|
||
e j = |
Mi |
|
ei . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
i |
M j |
j |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Температурная зависимость параметра и коэффициента взаимодействия определяются в опытах или по теории регулярных растворов:
e j |
= |
1873 e j |
, |
ln γ |
= |
1873 ln γ |
, |
||
i T |
|
T |
i 1873 |
|
T |
|
T |
1873 |
|
|
|
|
|
|
|
|
|
||
и потеорииквазирегулярныхрастворов длясплавов наоснове Fe илиNi:
16
Стр. 16 |
ЭБ ПНИПУ (elib.pstu.ru) |

e j |
= |
2557 |
− 0,365 |
e j |
, ln γ |
i T |
= |
2557 |
− 0,365 |
ln γ |
i 1873 |
||
i T |
|
|
T |
|
i 1873 |
|
|
|
T |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
Практическое применение этих величин рассмотрено в задании 3.
2.4.Расчет взаимодействия элементов в сплавах
ивыбор раскислителя
При воздействии на сплав окислителя или восстановителянеобходимо прогнозировать, какой компонентсплава вступит во взаимодействие.
Первым фактором является степень химического сродства элементов к кислороду.
Для температур до 1000 К это сродство усиливается в такой последовательности: медь, никель, кобальт, железо, вольфрам, молибден, хром, марганец, ванадий, кремний, титан, цирконий, алюминий.
Химическое сродство рассчитывают для определенной температуры, находя упругость диссоциации оксидов, т.е. парциальное давление кислорода рО2, выделяющегося при диссоциации оксида (МеО). Напри-
мер, при 1000 К парциальное давление кислорода, выделяющегося из MnO, меньше, чем парциальное давление кислорода, выделяющегося из FeO. Следовательно, химическое сродство к кислороду у железа меньше, чем у марганца. При 1000 К и равных молярных концентрациях марганец может быть раскислителем для железа. Еще одним фактором служит молярная концентрация элемента в сплаве. Пересчет массовой концентрации в молярную и обратно выполняют по формулам:
[Me] = qi % Ai |
|
k |
|
|
qi % Ai |
; |
|||
|
|
|
|
|
qiMe = |
[Me]i Ai |
k |
|
|
qi % Ai 100 , |
||||
|
|
|
|
|
где [Ме] − молярная концентрация элемента в составе ([Ме] < 1); qi − массовая доля элемента в сплаве; Ai − атомная масса элемента; k − число элементов в составе сплава.
Совместный учет первого и второго факторов проводится путем определения химического потенциала элементов в составе сплава, т.е. приращения энергии Гиббса при изменении количества вещества i-го компонента раствора. Рассчитывают химический потенциал μ по уравнениям:
17
Стр. 17 |
ЭБ ПНИПУ (elib.pstu.ru) |
для газовых смесей
μi = μi0 + RT lg pi ,
для расплавов (растворов)
μi = μi0 + RT lg pi ,
где μi0 − энергия Гиббса компонента в чистом виде (для рi = 1 Ni = 1) в стандартных условиях, т.е. μi0 = G0; рi − парциальное давление i-го газа; Ni − молекулярная доля i-го компонента раствора.
Процесс равновесия соответствует равенству μi в фазах системы. Самопроизвольно компонент переходит из фазы, где μi больше, в фазу, где μi меньше. Наиболее вероятна реакция, при которой приращение Δμ минимально. Так, при окислении сварочной ванны 08Г2С наиболее вероятно окисление кремния, несмотря на наличие компонента с
большим сродством к кислороду (углерод).
2.5. Кинетика физико-химических процессов
Сварка металлов плавлением представляет собой высокотемпературный быстропротекающии процесс, сопровождающийся химическими реакциями между металлом и средой (атмосфера дугового промежутка, шлаки, полученные плавлением флюсов или электродных покрытий), а также диффузионными процессами, особенно интенсивно развивающимися при высоких температурах (например, диффузионное соединение металлов в вакууме, предложенное Н.Ф. Казаковым).
Формальная кинетика – это раздел химической кинетики, в котором рассматривается количественное описание хода реакции во времени в зависимости от температуры и концентрации реагирующих веществ. При этом применяют модельный математический аппарат с использованием опытных величин.
В реакцию вступают исходные вещества, в результате образуются продукты реакции. Вещества, появляющиеся и исчезающие по ходу реакции, называются промежуточными. Различают гомогенные (исходные вещества в одной фазе), гетерогенные (взаимодействие на границе фаз), гомофазные (исходные и продукты в одной фазе) и гетерофазные (компоненты образуют две и более фаз) реакции.
Многие реакции идут в несколько стадий (последовательно или параллельно). Реакции могут быть двусторонними (обратимыми) и односторонними (необратимые, далекие от равновесия). Совокупность всех
18
Стр. 18 |
ЭБ ПНИПУ (elib.pstu.ru) |

стадий превращения исходных веществ в продукты является механизмом реакции.
Общая скорость реакции определяется скоростью самой медленной стадии, которая называется лимитирующей.
Основной постулат химической кинетики (закон действия масс): скорость реакции пропорциональна произведению концентраций исходных веществ в определенных степенях:
V = kCAn CBm ...,
где V – скорость реакции в статических условиях (это изменение концентрации, количества вещества А или В в единицу времени); k – константа скорости реакции; С – концентрация веществ; n, m – показатели степени, называемые порядком реакции (по веществу А и В); n + m – общий формальный порядок реакции.
Для реакций первого порядка:
|
|
|
|
V = − |
dС |
= k C , |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
dt |
1 |
|
|
|
|
|
|
|
|
|
|
|
||
откуда |
|
|
|
|
|
|
|
|
|
k dt = − dС |
, k t = ln C0 |
, k = 1ln C0 , |
|||||||
1 |
|
C |
1 |
|
C |
1 |
t |
C |
|
|
|
|
|
|
|||||
|
t = |
1 |
(ln C − ln С), |
С = C е− KT |
, |
||||
|
|
||||||||
|
|
k1 |
0 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
||
где С0 – начальная концентрация; С – концентрация в момент t от начала реакции.
Признак первого порядка – прямолинейная зависимость lnC от t.
Время полураспада t1/2 = 0,6932 . k1
Для реакций второго порядка
V = − ddtС = k2C2 ,
откуда
t = 1 C0 − C . k2 C0C
19
Стр. 19 |
ЭБ ПНИПУ (elib.pstu.ru) |

Признак реакции второго порядка – прямая зависимость C1 от t.
Время полураспада
|
|
t |
|
= |
|
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
1/2 |
|
k2C0 |
|
|
|
|||
|
|
|
|
|
|
|
|
|||
Для реакций третьего порядка |
|
|
|
|
|
|
||||
|
|
V = − dС |
= k3C3 , |
|
|
|||||
|
|
|
|
dt |
|
|
|
|
|
|
откуда |
|
|
|
|
|
|
|
|
|
|
1 C2 − C2 |
|
|
|
3 |
|
|
||||
t = k 2C2C2 , t1/2 = |
2k C2 . |
|||||||||
|
|
0 |
|
|
|
|
|
|
|
|
|
3 |
|
0 |
|
|
|
|
3 |
0 |
|
Признак реакции третьего порядка – прямая зависимость C12 от t.
Скорость реакции зависит от температуры.
Анализом экспериментальных данных установлено: ln k = B − TA
− E
или k = Be RT – уравнение Аррениуса, где k – константа скорости реакции при Т; В – предэкспонентный множитель (частотный фактор); Е – энергия активации реакции (энергетический барьер между исходным веществом и продуктом), Дж/моль;
Гетерогенные процессы идут в области границы фаз (растворение, испарение, сублимация, конденсация, реакции между веществами фаз, электрохимические процессы на границе фаз, каталитические реакции, выделение новой фазы, диффузионная сварка и др.).
В общем случае гетерогенный процесс можно условно разделить на несколько стадий (перемещение частиц в фазе 1 к границе, адсорбция на границе, химическое взаимодействие, десорбция, перемещение частиц в фазе 2), которые можно сгруппировать в два типа: химическая реакция и транспорт вещества. Стадии первого типа описывают уравнениями формальной кинетики, стадии второго типа – уравнениями, описывающими перемещение частиц (диффузию).
Диффузия может быть конвективной (перенос частиц вместе с окружающим веществом) и молекулярной (перемещение частиц в неподвижной окружающей среде). Слово «диффузия» – латинское, переводится как распространение, растекание.
20
Стр. 20 |
ЭБ ПНИПУ (elib.pstu.ru) |
