
388
.pdfФедеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования «Пермский государственный технический университет»
Г.В. Леонтьева, С.А. Колесова, Е.А. Шульга
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ. ХИМИЯ И БИОГЕННЫЕ СВОЙСТВА ЭЛЕМЕНТОВ VА И VIА ГРУПП
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Издательство Пермского государственного технического университета
2008
УДК 546.22(057) Л47
Рецензенты:
доктор химических наук, профессор С.А. Онорин (Научно-производственное предприятие «Старт»); кандидат химических наук, доцент Н.Б. Ходяшев (Пермский государственный технический университет)
Леонтьева, Г.В.
Л47 Общая и неорганическая химия. Химия и биогенные свойства элементов VA и VIA групп: учеб. пособие / Г.В. Леонтьева, С.А. Колесова, Е.А. Шульга. – Пермь: Изд-во Перм. гос. техн.
ун-та, 2008. – 148 с.
ISBN 978-5-88151-961-2
Представлены теоретические сведения о химических и биогенных свойствах элементов подгрупп азота и серы, соединениях этих элементов, индивидуальные задания для экспериментальных лабораторных работ, индивидуальные задания для самостоятельной работы и справочные материалы.
Предназначено для студентов специальностей химического профиля, металловедов и экологов, изучающих курс «Неорганическая химия».
УДК 546.22(057)
Издано в рамках приоритетного национального проекта «Образование» по программе Пермского государственного технического университета «Создание инновационной системы формирования профессиональных компетенций кадров и центра инновационного развития региона на базе многопрофильного технического университета»
ISBN 978-5-88151-961-2 © ГОУ ВПО «Пермский государственный технический университет», 2008
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ....................................................................................... |
4 |
1. БИОГЕННЫЕ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ |
|
И ИХ РОЛЬ В ФОРМИРОВАНИИ БИОМАССЫ......................... |
6 |
2. ЭЛЕМЕНТЫ VA ГРУППЫ И ИХ СОЕДИНЕНИЯ................... |
20 |
2.1. Общая характеристика элементов VА группы |
|
и закономерности в изменении их свойств ................................ |
20 |
2.2. Свойства простых веществ................................................... |
22 |
2.3. Химические свойства азота, фосфора |
|
и их соединений............................................................................ |
23 |
2.4. Свойства мышьяка, сурьмы, висмута |
|
и их соединений............................................................................ |
37 |
Индивидуальные лабораторные работы ................................... |
41 |
Задания для самостоятельной работы ..................................... |
65 |
Тесты. V А группа......................................................................... |
72 |
3. ЭЛЕМЕНТЫ VIA ГРУППЫ И ИХ СОЕДИНЕНИЯ.................. |
83 |
3.1. Положение элементов VIA группы в периодической |
|
системе и общие закономерности изменения их свойств........ |
83 |
3.2. Химические свойства серы, селена и теллура |
|
в свободном состоянии ................................................................ |
85 |
3.3. Соединения серы, селена и теллура и их свойства............. |
86 |
Индивидуальные лабораторные работы ................................... |
94 |
Задания для самостоятельной работы ..................................... |
122 |
Тесты. VI А группа....................................................................... |
130 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ........................... |
138 |
ПРИЛОЖЕНИЕ 1.............................................................................. |
139 |
ПРИЛОЖЕНИЕ 2.............................................................................. |
141 |
ПРИЛОЖЕНИЕ 3.............................................................................. |
144 |
ПРИЛОЖЕНИЕ 4.............................................................................. |
145 |
3
ВВЕДЕНИЕ
Курс общей и неорганической химии призван дать базовую химическую подготовку будущим специалистам в области химической технологии и биотехнологии. Однако отрасли промышленности, в которых предстоит трудиться выпускникам, существенно различаются по типам используемого сырья, технологическим процессам его переработки и видам получаемой продукции. Все это приходится учитывать при подготовке специалистов по новому направлению «Технологии биотоплива».
Необычным представляется использование сырья возобновляемого типа, такого, например, как различные виды растительности, микроводоросли. Если традиционные ископаемые виды топлива представляют собой в основном углеводороды, то растительные
иживотные виды сырья – углеводы, белки, нуклеиновые кислоты. Их химический состав, структура, свойства имеют свои особенности.
Существенно различны процессы получения моторных топлив из нефти и биомассы. В основе переработки нефти лежит физикохимический процесс – прямая перегонка. Последующий процесс – вторичная переработка нефти – хотя и включает крекинг, пиролиз
иизомеризацию углеводородов, но не изменяет их химическую природу. При переработке биомассы в различные виды топлива происходит существенное изменение химической природы веществ. Так, углеводы превращаются в спирты или газообразный водород,
иосновой таких процессов является ферментативный катализ. Как правило, они протекают с участием микроорганизмов или заранее выделенных ферментов. Некоторые из них существуют в природных условиях, другие получены с помощью методов генной инженерии (рекомбинантные виды).
Полученные из биомассы топлива также представляются необычными по химическому составу. Преимущественно это спирты (метанол, этанол, бутанол), сложные эфиры жирных кислот (метило-
вые и этиловые эфиры), газообразные продукты (СО, Н2, СН4 и др.). Авторы данного учебного пособия исходят из того, что химический курс, лежащий в основе фундаментального образования спе-
4
циалистов, не должен существенно изменяться в зависимости от специальности их подготовки. Однако при изложении основ химии необходимо обязательно учитывать связь теоретического материала с практическими задачами, которые потребуется решать специалисту в его профессиональной деятельности. Поэтому в пособии основное внимание уделено биогенным химическим элементам, которые определяют природу как биомассы, так и получаемых из нее продуктов.
Учебное пособие выполнено по плану реализации инновационной образовательной программы в рамках научно-образовательного комплекса «Наукоемкие технологии переработки нефти и газа» с учетом современных путей решения топливной проблемы.
5
1.БИОГЕННЫЕ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
ИИХ РОЛЬ В ФОРМИРОВАНИИ БИОМАССЫ
Основой производства биотоплива является биомасса, которая представлена веществами растительного и животного происхождения. В состав биомассы входят многие химические элементы, но преимущественно биогенные, т.е. способные участвовать в образовании веществ живых организмов. Изучение биологического значения химических элементов земной коры показало, что геохимические процессы и эволюция элементного состава населяющих нашу планету животных и растительных организмов являются сопряженными процессами. В то же время анализ элементного состава всех известных видов организмов свидетельствует, что все живое проявляет избирательное отношение к окружающей среде и извлекает из оболочек Земли (литосферы, гидросферы и атмосферы), как правило, определенную группу элементов, которые относят к биогенным. Об этом свидетельствует разительное отличие элементного состава животных и растительных организмов (и в том числе человека) от общего набора элементов, которые входят, например, в состав земной коры и поэтому вполне доступны для живых систем.
Вземной коре в наибольших количествах содержатся кислород (62,55 %), кремний (22,32 %), алюминий (6,47 %). Однако далеко неони определяют состав живыхсистем. Изобщегочислахимическихэлементов периодической системы всего лишь шесть используются для построения подавляющего количества биологически значимых молекул: углеродС, кислородО, водородН, азотN, фосфорРисераS.
Еще 16 микроэлементов присутствуют в клетках в различных количествах и соотношениях. К ним относятся: железо Fe, медь Сu, цинк Zn, марганец Мn, кобальт Со, йод I, молибден Мо, ванадий V, никель Ni, хром Сr, фтор F, селен Sе, кремний Si, олово Sn, бор В,
мышьяк As. Пять элементов представлены в виде определенных ионов: натрий Na+, калий K+, магний Мg2+, кальций Са2+, хлор Сl–. Ка-
ков бы ни был принцип отбора химических элементов для процессов жизнедеятельности, он не связан с их распространенностью в природе. Например, из галогенов только хлор и йод выбраны природой для
6
живых систем, хотя фтор и бром обладают не меньшей доступностью. По-видимому, в основу отбора положены требования биохимии и микробиологии. Например, шесть основных биоэлементов имеют набор свойств, достаточный для молекул живой клетки.
Из шести основных биоэлементов наибольшее значение имеет углерод.
Характерной особенностью атомов углерода является способность образовывать углеродные цепи любого размера и конфигурации. Три из четырех валентностей углерода могут участвовать в образовании трехмерного скелета, а четвертая – связывать ту или иную функциональную группу. Соединения, образованные на основе углерода, называются органическими. У них есть ряд общих свойств, имеющих большое значение для живой материи.
Органические соединения характеризуются огромным разнообразием углеродных цепей и функциональных групп и играют важную роль в процессах жизнедеятельности.
Следует отметить, что углерод, водород, азот и кислород легко реагируют друг с другом, образуют ковалентные связи, как одинарные, так и кратные, и поэтому являются основой самых разнообразных соединений. Так как прочность ковалентных связей обратно пропорциональна атомным массам связанных с их помощью атомов, то именно эти (легкие) элементы особенно прочно связываются друг с другом. Небольшие размеры их атомов позволяют создать плотные компактные молекулы, устойчивые к воздействию химических веществ окружающей среды. В свою очередь, фосфор и сера обладают крайне важным качеством – способностью образовывать макроэргические соединения, при расщеплении которых выделяется повышенное количество энергии.
Фосфор входит в состав нуклеиновых кислот, а также особой группы богатых энергией соединений (аденозинтрифосфат и др.). Сера в основном содержится в серосодержащих аминокислотах.
Азот, фосфор, сера выполняют важную биологическую функцию при формировании биомассы, они способны наряду с малорастворимыми соединениями образовывать водорастворимые и газообразные.
7

Из-за высокой стабильности молекулярного азота большинство живых существ не способны усваиватьегоизатмосферы. Однако азот– необходимый компонент аминокислот, белков и нуклеиновых кислот. Процесс усвоения газообразного азота называется фиксацией азота. Этотпроцессвприродесовершаетсядвумяпутями(рис. 1).
Рис. 1. Круговорот азота в природе
Основной путь усвоения атмосферного азота – это усвоение
в процессе |
жизнедеятельности азотфиксирующих бактерий |
в симбиозе |
с бобовыми растениями, а также сине-зеленых |
и пурпурных водорослей. Эти микроорганизмы превращают молекулярный азот в аммиак или ионы NH4+ под действием фермента нитрогеназы, использующего энергию гидролиза АТФ:
12 АТФ → 12 АДФ + 12Ф
N2(г) + 6е– + 6H+(p) нитрогеназа→ 2NH3(г)
Образующийся аммиак в результате жизнедеятельности нитрифицирующих бактерий окисляется под действием кислорода
8
и фермента нитрогеноксидазы в нитраты, которые легко усваиваются корнями растений из почвы:
2NH3 + 4O2 нитрогеноксидаза→ 2NO3– + 2H2O + 2H+
По другому пути фиксация азота происходит во время грозы, когда при электрическом разряде (молния) происходит взаимодействие атмосферных азота и кислорода и образуются нитраты, которые с дождевой водой попадают в почву и водоемы:
N2 + O2 молния→ 2NO; 2NO + O2 = 2NO2;
4NO2 + 2H2O + O2 = 4HNO3
Растения усваивают нитраты, восстанавливая их с помощью нитратредуктазы в ионы аммония:
NO3– + 10H+ + 8e– 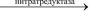 NH4+ + 3H2O
NH4+ + 3H2O
Ионы аммония в растениях благодаря реакции восстановительного аминирования образуют глутаминовую кислоту. На базе этой аминокислоты в результате реакции трансаминирования получаются остальные девятнадцать α-аминокислот, используемых для синтеза необходимых азотсодержащих биосубстратов: белков, нуклеиновых кислот и других веществ.
Животные используют растения как источник азотсодержащих биосубстратов, из которых они синтезируют свои белки и нуклеиновые кислоты. После гибели и последующего разложения растительных и животных организмов из них образуются аммиак и соли аммония. На этом замыкается малый цикл в круговороте азота. Большой цикл в круговороте азота замыкается в результате жизнедеятельности денитрифицирующих анаэробных бактерий почвы, которые восстанавливают нитраты под действием фермента нитротазы до элементарного азота, который возвращается в атмосферу:
2NO3– + 12H + + 10e– нитротаза→ N2 + 6H2O
Таким образом, круговорот азота осуществляется благодаря жизнедеятельности различных микроорганизмов, растений и животных.
9
Во всех азотсодержащих соединениях – метаболитах – атом азота связан с атомами менее электроотрицательных элементов НиС и имеет степень окисления –3. Атом азота вприродных соединениях обычно образует три ковалентные связи, т.е. его валентность равна трем. Только вкатионах этих соединений, где положительный заряд сосредоточен на атомах азота, его валентность равна четырем, причем четвертая связь возникает за счет неподеленной электронной пары атома азота подонорно-акцепторному механизму.
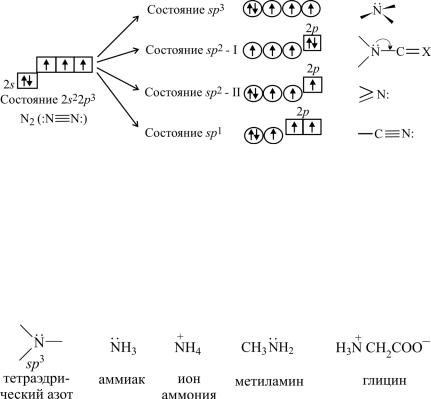
Донорная способность резко изменяется в зависимости от характера атомной орбитали, которую занимает неподеленная электронная пара, т.е. определяется электронным состоянием атома азота. Для атома азота может быть реализовано пять различных электронных состояний (рис. 2).
Рис. 2. Электронные состояния атома азота в его соединениях
Атом азота в электронном состоянии sp3 называется тетраэдрическим азотом. В этом состоянии неподеленная пара электронов атомов азота находится на гибридной sp3-орбитали, поэтому ее подвижность велика. Это позволяет атому азота активно образовывать еще одну четвертую связь по донорно-акцепторному механизму. Такие свойства характерны для атома азота в аммиаке, алифатических аминах и их производных – α-аминокислотах:
10
