
Теория сварочных процессов моделирование физико-химических процессо
..pdfC2980 = C2980 продуктов – C2980 исх. веществ
Обратите внимание на то, что энтропии S2980 для любых веществ
никогда не равны нулю.
6. Собрать итоговую формулу, оставив в виде символов только температуру и коэффициент М0, например:
GТ0 = 121250 − 4Т − 4,5М0Т.
Задавая определенные значения температуры из указанного в варианте интервала, определить коэффициент М0 по табл. П.2 и вычислить
значение GТ0 . Результаты занести в табл. 1.
|
|
|
Таблица 1 |
Результаты расчета энергии Гиббса |
G0 |
||
|
|
|
Т |
для реакции Fe + MeO ↔ FeO + Me |
|||
|
|
|
|
Температура, К |
Коэффициент М0 |
|
GТ0 , Дж |
1000 |
|
|
|
2000 |
|
|
|
3000 |
|
|
|
4000 |
|
|
|
7. Построить график зависимости Гиббса |
G0 |
от температуры по |
|
|
|
Т |
|
результатам расчета, аналогично графику на рис. 1.
8. Сделать выводы о направлении химической реакции по знаку GТ0 , выяснить, будет ли выбранный металл являться раскислителем для железа, и если да, то в каком температурном интервале.
61
Стр. 61 |
ЭБ ПНИПУ (elib.pstu.ru) |
2.Устойчивость химических соединений
вусловиях различных сварочных атмосфер
Задание 2
Рассчитать равновесное парциальное давление кислорода (упругость диссоциации) оксида при 500–3000 К согласно варианту задания и сделать выводы об устойчивости оксида в условиях различных сварочных атмосфер.
Порядок проведения расчета
Варианты заданий
Вариант |
Оксид |
Вариант |
Оксид |
Вариант |
Оксид |
Вариант |
Оксид |
1 |
FeO |
5 |
MnO |
9 |
TiO |
13 |
WO2 |
2 |
NiO |
6 |
SiO2 |
10 |
TiO2 |
14 |
MoO2 |
3 |
Cu2O |
7 |
Al2O3 |
11 |
Cr2O3 |
15 |
VO |
4 |
CuO |
8 |
MqO |
12 |
CaO |
16 |
ZrO2 |
1. Рассчитать упругость диссоциации оксида Ме в интервале 500…3000 К. Результаты представить в виде таблицы и графика
lg (PO2, атм) = f (T(K)).
2. Определить возможность очистки поверхности металла (Ме) от оксида этого металла путем нагрева до 500–3000 К в вакууме 10–2 и 10–5 мм рт.ст. и указать температуру, выше которой такая очистка возможна. (Принять PO2 = 0,21Рвак.)
3. Определить возможность образования оксида Ме в ацетиленокислородном пламени. Принять:
для окислительного пламени lg (PO2, атм) = −2 … −8; для нейтрального − lg (PO2 , атм) = −8 … −11,5;
для науглераживающего − lg (PO2, атм) = −11,5 … −17.
4. Оценить возможность образования оксида Ме при сварке покрытым электродом (принять lg (PO2, атм) = −2 … −4) и при аргоно-дуговой
сварке (lg (PO2, атм) = −5 … −6).
Пример решения для оксида СаО
1. Расчет упругости диссоциации СаО. Реакция диссоциации СаО
CaO = Ca + 0,5O2. |
(1) |
62
Стр. 62 |
ЭБ ПНИПУ (elib.pstu.ru) |
|
|
|
|
|
|
|
|
|
|
|
|
a0,5 |
a |
|
|
|
|
|
|
|
|
|||
|
Константа равновесия Kp |
= |
O2 |
|
|
Ca |
. Если СаО и Са − чистые ве- |
|||||||||||||||||
|
aCaO |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
щества, то их активность равна 1. О2 − газ, т.е. aО2 ≈ РО2, атм. |
|
) 0,5 , |
||||||||||||||||||||||
|
Следовательно, |
Kp |
(1) |
= PO0,5 |
и GT0 |
= −RT ln Kp = − (RT ln PO |
2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
(1) |
|
|
|
|
|
|
|
|
|
||||
|
откуда, переходя к lg, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
G0 |
|
|
|
|
|
|||
|
|
|
|
|
lg |
(PO2 ,атм) = |
|
|
|
|
|
T |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
(1) |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,3 R T 0,5 |
|
|
|
|
||||||
или |
при |
G0 |
в |
|
джоулях |
|
|
(т.е. |
R |
= |
8,31 |
Дж/К моль), с |
учетом |
|||||||||||
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G0 |
= − |
G0 |
|
, имеем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
T |
|
T обр CaO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G0 |
|
|
|
|
|
|
|
G0 |
|
|
||
|
|
lg |
(P ,атм) = |
|
|
|
T обр CaO |
|
= |
|
|
T обр CaO |
. |
|
(2) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
O2 |
|
|
|
|
2,38,31T 0,5 |
|
|
9,56 T |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
По табл. П.3: |
|
G0 |
|
|
= −151300 + 24,54Т [кал/моль] (298–1123 К); |
||||||||||||||||||
|
|
|
|
|
T обр CaO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Переводом |
G0 |
в джоулях получим: |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G0 |
|
|
= −633039 + 106,86Т, Дж (298 … 1123 К) |
|
(3) |
|||||||||||||||||
|
|
T обр CaO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставляя Т (500 … 3000 К) в соответствующее уравнение (3) находим GT0 обр CaO и, далее, по уравнению (2) вычисляем lg (PO2 ,атм) . Результаты приведены в табл. 1 и на рис. 1.
Таблица 1
Упругость диссоциации СаО
Т, К |
G |
|
Дж/моль |
lg (PO ,атм) |
PO |
, атм |
|
T обр CaO |
|
2 |
|
2 |
|
500 |
|
−579609 |
−121,256 |
0,55 10−122 |
||
1123 |
|
−517742 |
−48,225 |
5,95 10−49 |
||
1765 |
|
−447047 |
−26,494 |
3,20 10−27 |
||
2860 |
|
−239873 |
−8,773 |
1,68 10−9 |
||
2. Определение возможности диссоциации СаО в заданной атмосфере.
Нанести на оси координат по рис. 1. рассчитанные значения lg (PO2 ,атм) для оксида кальция это будет PO2 факт.
63
Стр. 63 |
ЭБ ПНИПУ (elib.pstu.ru) |
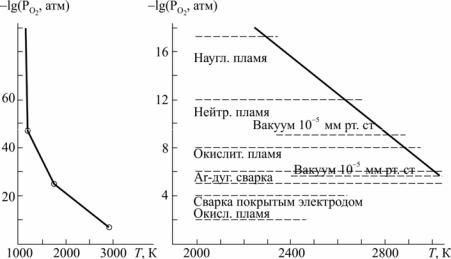
Рис. 1. Упругость диссоциации CaO (lg(PO2, атм))
Необходимо также нанести заданные значения lg ( PO2 , атм.) для различных вакуумных сред – это соответствует PO2 равн :
•если lg PO2факт более отрицателен, чем lg PO2 равн , то оксид устойчив, т.е. на поверхности металла образуется его оксид;
•если lg PO2факт менее отрицателен, чем lg PO2 равн , то оксид диссоциирует, т.е. поверхность металла можно чистить от оксида.
Таким образом, очистить Са от оксида в вакууме 10−5 мм рт. ст. возможно при Т > 2870 K, в вакууме 10−2 мм рт. ст. при Т > 3000 К. При меньших Т в заданных условиях Са будет окисляться.
3.Возможность окисления Са в других заданных атмосферах опре-
деляем также графически, путем нанесения заданных lg PO2 сварочных
атмосфер на рис. 1.
Образование оксида Са на металлическом Са возможно:
•в окислительном пламени при Т < 2900–3000 К;
•в нейтральном пламени при Т < 2700–2900 К;
•в науглероживающем при Т < 2350–2700 К.
4.При Т ≤ 2300 К в условиях аргоно-дуговой сварки и сварки покрытым электродом СаО устойчив, т.е. Са будет окисляться в твердом и жидком состояниях.
64
Стр. 64 |
ЭБ ПНИПУ (elib.pstu.ru) |
|
|
|
Листинг решения задания 2 в Mathcad 11 |
|
|
|
|
||||||||
Диссоциация химических соединений |
|
|
|
|
|
|
B |
||||||||
Расчет |
|
упругости |
диссоциации |
оксида |
железа |
K := |
P |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
(O2) |
|
dG0T := −R T lnKp |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Из таблицы П.3 задаем значения А и В и соответствующие им ин- |
|||||||||||||||
тервалы температур. |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
A1 := −6267 |
|
B1 := 15.1 |
T1 := 300, 320.. 118 |
T5 := 0, 20.. 300 |
|
|||||||||
|
A2 := −6286 |
|
B2 := 15.3 |
T2 := 1180, 1200.. 164 |
|
|
|
|
|
||||||
|
A3 := −5468 |
|
B3 := 10.3 |
T3 := 1640, 1660.. 180 |
|
|
|
|
|
||||||
|
A4 := −5732 |
|
B4 := 11.8 |
T4 := 1800, 1820.. 300 |
|
|
|
|
|
||||||
dG(T1) := (A1 + B1 T1) 4.18 |
lgP(T1) := |
dG(T1) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
9.56 T1 |
|
|
|
|
|
|
|
dG(T2) := (A2 + B2 T2) 4.184 |
lgP(T2) := |
dG(T2) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
9.56 T2 |
|
|
|
|
|
|
|
dG(T3) := (A3 + B3 T3) 4.184 |
lgP(T3) := |
dG(T3) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
9.56 T3 |
|
|
|
|
|
|
|
dG(T4) := (A4 + B4 T4) 4.184 |
lgP(T4) := |
dG(T4) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
9.56 T4 |
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− lgP(T2) |
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− lgP(T3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− lgP(T4) |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17.2 |
|
Науглераживающее пламя |
|
|
|
|
|
|
|
|
|
||||
12 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.883 |
10 |
|
Нейтрал. пламя |
|
|
|
|
|
|
|
|
|
|||
8 |
|
|
|
|
|
|
|
Вакуум 10–5 мм рт. ст. |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
6 |
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.883 |
|
|
Окислит. пламя |
|
|
|
|
|
|
|
|
|
|||
5.216 |
6 |
|
|
|
|
Вакуум 10–2 мм рт. ст. |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
Аr-дуг. сварка |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сварка покрытым электродом |
|
|
|
|
|
|
|
|||||
|
2 |
0 |
300 |
600 |
900 |
1200 |
1500 |
1800 |
2100 |
2400 |
2700 |
3000 |
|
||
|
|
|
|
|
|
T2 , T3 , T4 , T5 |
|
|
|
|
|
|
|||
|
|
|
Рис. Упругость диссоциации оксида железа FeO |
|
|
|
|
||||||||
65
Стр. 65 |
ЭБ ПНИПУ (elib.pstu.ru) |
3. Легирование металла сварного шва элементами из шлака (флюса, покрытия)
Задание 3
Для сплавов на основе Fe реакцию распределения Ti между шлаком и металлом можно представить в виде
|
(TiO2 ) + 2Fe = 2(FeO) + |
|
Ti |
|
, |
|
|
|
|
|
|
(1) |
||||||||
|
|
|
||||||||||||||||||
|
|
a2 |
a |
Ti |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
для которой |
Kp = |
|
(FeO) |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
||
a2 a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Fe |
|
(TiO2 ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где a(FeO) и a(TiO2 ) |
− активности оксидов в шлаке; a |
|
Ti |
|
и a |
|
Fe |
|
− активно- |
|||||||||||
|
|
|
|
|||||||||||||||||
сти Ti и Fe в стали (как для растворителя aFe = 1). Изменение энергии Гиббса
GTo 1 = −RT ln Kp .
Выражая активность через мольную долю и коэффициент активности (ai = γi Xi ) , получим
|
|
− |
G |
|
X 2FeO |
|
γ2FeO |
|
γ |
|
Ti |
|
X |
|
Ti |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
lg K |
= |
|
T 1 |
= lg |
( |
) |
( |
) |
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
2,3 R T |
|
γ(TiO2 ) X(TiO2 ) |
|
|
|||||||||||
|
|
|
|
|
|||||||||||||
откуда искомое равновесное содержание Ti в сплаве (в мольных долях можно) определиться по формуле
lg X |
|
|
|
= − |
Go |
+ lg γ |
|
+ lg X |
|
− lg γ |
|
|
|
− 2lg γ |
|
− 2lg X |
|
. (2) |
|
Ti |
|
T 1 |
(TiO2 ) |
(TiO2 ) |
|
Ti |
|
(FeO) |
(FeO) |
||||||||
|
|
2,3RT |
|
|||||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В этом уравнении X(FeO) , X(TiO2 ) ,T заданы. Остальные величины
требуют теоретического расчета.
Определить равновесное содержание Ti в стали 12Г2 под расплавом покрытия заданного состава при 1873 и 2100 К. Обсудить результаты: уровень легирования сварного шва титаном с помощью шлака; прогноз уровнялегирования титаном приизмененииокисленности шлака (%FeO).
Состав стали (мас.%): 0,12 % С, 2 % Mn, примеси не учитываем, 0,01 % О, остальное − Fe.
66
Стр. 66 |
ЭБ ПНИПУ (elib.pstu.ru) |

Состав покрытия (мас.%): 35 % TiO2, 10 % MnO, 22 % SiO2, 24 %
CaO, 6 % Al2O3, 2 % MgO, 1 % FeO.
Решение.
1. Распределение Ti между шлаком и сталью 12Г2 Реакцию (1) можно представить суммой реакций:
TiO |
2, ж |
= Ti |
ж |
+ O |
2 |
, |
|
Go |
= +884665 −151,1T [Дж] (см. табл. П.3); |
(3) |
||||||
|
|
|
|
|
|
|
|
T (3) |
|
|
|
|
||||
Fe |
|
+ |
1 O |
|
= FeO |
|
, |
Go |
|
= −239827 + 49,5 T [Дж] (см. табл. П.3); |
(4) |
|||||
|
ж |
|
2 |
2 |
|
|
|
|
ж |
|
T (4) |
|
|
|
||
|
|
|
|
|
|
|
Go |
= |
|
Go |
+ 2 Go |
= 405011− 52,1T [Дж] |
|
|||
|
|
|
|
|
|
|
|
T (1) |
|
|
|
T (3) |
|
T (4) |
|
|
2. Пересчетсодержаниякомпонентов вмольные (атомные) доли(Хi)
|
%i |
|
Xi = |
Ai |
, |
n |
||
|
Ai |
|
|
%i |
|
|
1 |
|
где А − мольная (атомная) масса компонента (см. табл. П.4). Пересчет состава стали (0,12 % С, 2 % Mn, 0,01 % O, Fe ост.):
XC = |
%C |
|
12 |
||
|
||
|
%C12 + %Mn55 + %O16 + %Fe56 |
= |
0,01 |
= 0,0056. |
0,01+ 0,036 + 0,0006 + 1,748 |
Аналогично получим ХMn = 0,020, XO = 0,0003, XFe = 0,974.
Пересчет состава шлака (XMexOy )
Оксид |
TiO2 |
MnO |
SiO2 |
CaO |
Al2O3 |
MgO |
FeO |
%масс. |
35 |
10 |
22 |
24 |
6 |
2 |
1 |
А(i) |
80 |
71 |
60 |
56 |
102 |
40 |
72 |
Х(i) |
0,292 |
0,094 |
0,247 |
0,286 |
0,039 |
0,033 |
0,009 |
lgXi |
−0,535 |
− |
− |
− |
− |
− |
−2,046 |
3. Расчет γTi в стали 12Г2. Расчетная формула:
ln γTi = ln γOTi + εCTi XC + εTiMn XMn + εOTi XO + εTiTi XTi .
Справочные данные (см. табл. П.5, П.6) для 1873 К:
γOTi = 0,037, eTiC = −0,725, eTiMn = 0, eTiO = −1,8, eTiTi = 0,013.
67
Стр. 67 |
ЭБ ПНИПУ (elib.pstu.ru) |
Пересчет по формуле (8) (см. главу 1) дает
|
|
|
|
|
|
|
|
|
εTiC |
= −35, εTiO = −89, |
εTiTi = 9 . |
|
|
|
||||||||
Произведение εTiTi XTi |
|
не учитываем, так как ХTi неизвестно и вели- |
||||||||||||||||||||
чина εTiTi небольшая. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
В итоге для 1873 К имеем ln γTi = −3,5188 или lg γTi |
= −1,531. |
|||||||||||||||||||||
Для 2100 К lg γTi |
= 1873 lg γTi,1873 |
= −1,365 . |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
2100 |
|
|
|
|
|
|
|
|
|
|
|||
4. Расчет lg γ оксидов Ti и Fe в шлаке по теории регулярных ионных |
||||||||||||||||||||||
растворов (см. табл. П.7). |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Расчетная формула: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
ln γ |
(TiO2 ) |
= |
|
1 |
[(X |
|
Q |
|
|
+ X |
|
|
Q |
+ X |
|
Q |
+ |
|||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
RT |
MnO |
|
MnO−TiO2 |
SiO2 |
SiO2 −TiO2 |
|
CaO |
CaO−TiO2 |
||||||||||
+ XAl2O3 |
|
QAl2O3 −TiO2 |
+ XMgO QMgO−TiO2 + XFeO QFeO−TiO2 − |
|
|
|||||||||||||||||
− XMnO (XSiO2 QMnO−SiO2 |
|
+ XCaO QMnO−CaO + XAl2O3 |
QMnO−Al2O3 |
+ |
||||||||||||||||||
+ XMgO QMnO−MgO + XFeO QMnO−FeO ) − XSiO2 |
(XCaO QSiO2 −CaO + |
|
||||||||||||||||||||
+ XAl2O3 |
|
QSiO2 −Al2O3 |
+ XMgO QSiO2 −MgO + XFeO QSiO2 −FeO ) − |
|
|
|||||||||||||||||
− XCaO (XAl2O3 QCaO−Al2O3 |
+ XMgO QCaO−MgO + XFeO XCaO−FeO ) − |
|||||||||||||||||||||
− XAl2O3 |
|
(XMgO QAl2O3 −MgO + XFeO QAl2O3 −FeO ) − XMgO XFeO QMgO−FeO ]. |
||||||||||||||||||||
Подстановка величин энергии смещения (Q, ккал) из (см. табл. П.7) |
||||||||||||||||||||||
и Х(i) дает: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln γ |
|
= |
|
1 |
[(0,486 19,5 + 0,039 5,3 + 0,033 6,4 + 0,009 6,35) − |
|||||||||||||||||
TiO2 |
|
|
||||||||||||||||||||
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
−0,094 (0,247 10 + 0,039 7,7) − 0,247 (0,286 23,1+ 0,039 18,7 + |
||||||||||||||||||||||
+0,033 29 + 0,009 8,7) − 0,286 (0,039 3,8) − 0,039 0,00912,9]; |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
T ln γ |
TiO2 |
= 1000 |
|
3,684 = 1854. |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
1,987 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
при Т = 1873 К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
lg γTiO2 = |
1854 |
|
= 0,4304; |
|
|
|
|
||||||
2,3 1873
при Т = 2100 К
lg γTiO2 = 0,3838.
68
Стр. 68 |
ЭБ ПНИПУ (elib.pstu.ru) |
Расчетная формула для определения lg γFeO в заданном шлаке (без членов с Q = 0) (см. табл. П.7):
ln γFeO |
= |
1 |
[(XSiO2 QSiO2 −FeO + XTiO2 QTiO2 −FeO + XAl2O3 QAl2O3 −FeO )− |
||||||
RT |
|||||||||
− XTiO2 |
(XAl2O3 |
QAl2O3 −TiO2 + XCaO QCaO−TiO2 + XMgO QMgO−TiO2 )− |
|||||||
− XMnO (XAl2O3 |
QAl2O3 −MnO + XSiO2 QSiO2 −MnO )− XSiO2 |
(XAl2O3 |
QSiO2 −Al2O3 + |
||||||
+ XCaO QSiO2 −CaO + XMnO QSiO2 −MnO ) − XCaO (XTiO2 QCaO−TiO2 + |
|||||||||
+ XAl2O3 QCaO−Al2O3 )]. |
|
|
|
||||||
После подстановки Xi и Qij получаем: |
|
|
|||||||
lg γFeO = |
|
|
1000 |
[(0, 247 8,7 + 0, 292 6,35 |
+ 0,039 |
12,9) − |
|||
1,987 T 2,3 |
|||||||||
|
|
|
|
|
|
||||
−0, 292 (0,039 5,3 + 0, 286 19,5 + 0,033 6, 4) −
−0,094 (0,039 7,7 + 0, 247 18,7) − 0, 247 (0,039 18,7 +
+0, 286 23,1+ 0,033 29) − 0, 286 (0, 292 19,5 + 0,039 3,8)] =
= |
|
503,3 (−1, 421) = − 715 . |
|
|
|
|
|
||||||
|
|
|
|
|
|
T |
|
T |
|
|
|
|
|
при Т = 1872 К |
|
|
|
|
|
|
|
|
|
||||
lg γFeO |
|
= −0,3818, |
γFeO,1873 = 0,415. |
|
|
|
|
|
|||||
при Т = 2100 К |
|
|
|
|
|
|
|
|
|
||||
lg γFeO |
|
= −0,3405, |
γFeO, 2100 = 0,456. |
|
|
|
|
|
|||||
5. Расчет содержания Ti в стали 12Г2, равновесной с заданным |
|||||||||||||
шлаком. |
|
|
|
|
|
|
|
|
|
||||
Подставляя в уравнение (3.2) вычисленные значения Go |
1 |
, |
lg γ |
Ti |
, |
||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
||
lg γ(TiO2 ) , lg γ(FeO) , X(FeO) , |
|
X(TiO2 ) , получим |
|
|
|
|
|
||||||
ln X |
Ti |
= −405011 + |
52,1 + 0,4304 0,535 − |
|
|
|
|
|
|||||
|
|
|
|
|
|
8,31 T |
8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
−1,531+ 2 0,3818 + 2 2,046 = − 48738 + 12,553. |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
При 1873 получим |
|
|
|
|
|
|
|
|
|
||||
ln X |
|
Ti |
|
= −13, 468, |
XTi = 1,41 10−6. |
|
|
|
69 |
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Стр. 69 |
ЭБ ПНИПУ (elib.pstu.ru) |

При 2100 К получим
ln X Ti = −10,655, XTi = 2,310−5.
Переход к мас.%
мас.%Ti = 100 XTi ATi .Xi Ai
Для низколегированной |
стали |
|
%Ti ≈ |
100 XTi ATi |
≈ 86 XTi . |
|
||
|
XFe AFe |
|
Таким образом, Вычисленное содержание Ti в стали 12Г2, равно-
весной со шлаком состава 35 % TiO2, 10 % MnO, 22 % SiO2, 24 % CaO, 6 % Al2O3, 2 % MgO, 1 % FeO при 1873 К составляет 1,2 10−4 мас.%, при 2100 К − 0,002 мас.%.
70
Стр. 70 |
ЭБ ПНИПУ (elib.pstu.ru) |
