
Порошковое материаловедение. Часть 1. Основы теоретического материало
.pdfМинистерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования «Пермский государственный технический университет»
Кафедра порошкового материаловедения Научный центр порошкового материаловедения
В.Н. Анциферов
ПОРОШКОВОЕ МАТЕРИАЛОВЕДЕНИЕ
Часть I
Основы теоретического материаловедения
Утверждено Редакционно-издательским советом университета
в качестве учебного пособия
Издательство Пермского государственного технического университета
2010
УДК 621.762.01 А74
Рецензенты:
член-корр. РАН, д-р хим. наук, проф. В.Г. Бамбуров (Институт химии твердого тела УрО РАН);
д-р техн. наук, проф. А.М. Ханов (Пермский государственный технический университет)
Анциферов, В.Н.
А74 Порошковое материаловедение. Ч. I. Основы теоретического материаловедения: учеб. пособие / В.Н. Анциферов. – Пермь: Изд-во Перм. гос. техн. ун-та, 2010. – 149 с.
ISBN 978-5-398-00442-7
Изложены основы теоретического материаловедения. Рассмотрены межатомные взаимодействия, строение кристаллических решеток, образование и структура фаз, диффузионные процессы в твердых телах. Значительное внимание уделено дефектам кристаллов. Представлены теоретические положения тепло- и электропроводности материалов. Приведены особенности упрочнения и разрушения твердых тел.
Предназначено для студентов высших учебных заведений, аспирантов, инженерно-технических и научных работников, специализирующихся в фундаментальных и прикладных областях порошковой металлургии и материаловедения.
УДК 621.762.01
ISBN 978-5-398-00442-7 © ГОУВПО
«Пермский государственный технический университет», 2010
2
Глава 1 МЕЖАТОМНЫЕ ВЗАИМОДЕЙСТВИЯ
При конденсации изолированных атомов с образованием твердого тела возникают силы, удерживающие атомы на определенном расстоянии друг от друга.
Силы, связывающие атомы между собой, в основном электрического происхождения. При образовании межатомных связей происходит перестройка электронных оболочек атомов, образующих твердое тело. При этом особенности перестройки электронных оболочек будут определяться природой взаимодействующих атомов, состоянием электронов, участвующих в образовании связи.
Считается, что в образовании межатомных связей принимают участие в основном электроны валентных оболочек, т.е. вклад валентных электронов в энергию образования твердого тела из атомов значительно больше, чем вклад внутренних электронов.
Каково все же происхождение сил, удерживающих атомы
иприводящих к образованию твердого тела?
Втвердом теле с кристаллической решеткой распределение плотности заряда, так же как и потенциала, периодично.
Когда атомы расположены далеко друг от друга, можно считать, что электроны взаимодействуют только с собственными ядрами. При сближении атомов существенным становится взаимодействие электронов с соседними атомами. Потенциальная энергия системы будет периодической пространственной функцией, амплитуда которой тем меньше, чем ближе находятся атомы, и соответствует состоянию симметрии.
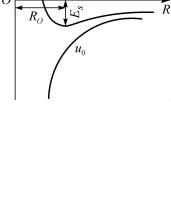
Вкачестве примера на рис. 1 представлена зависимость энергии электрона E в одновалентном металле от межатомно-
го расстояния R. Минимум E в точке R0 соответствует со-
стоянию устойчивого равновесия. Вблизи точки минимума атом испытывает со стороны соседей возвращающую силу при
3
малом отклонении его из этого положения. По мере сближения атомов с образованием твердого тела взаимодействие между ними оказывает возмущающее действие на первоначальные атомные энергетические уровни. В результате симметрия электронных состояний, существовавшая в изолированных атомах, нарушается, что приводит к расщеплению уровней, тогда единственный сильно вырожденный энергетический уровень системы невзаимодействующих атомов,
находящихся на больших расстояниях друг от друга, превращается в большое число близко расположенных друг к другу уровней энергии твердого тела с малыми межатомными расстояниями. В зоне энергетических уровней сохраняется некоторое вырождение, но не настолько значительное, как вырождение исходных уровней атомов.
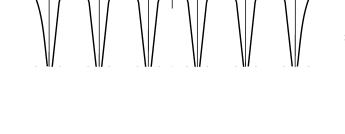
Энергетические зоны. Потенциальная энергия электрона в функции расстояния χ вдоль линии, соединяющей шесть
атомов, показана на рис. 2. Энергии, соответствующие всем возможным волновым функциям состояний 1s и 2s, представлены на рис. 1 как функции расстояния R между ядрами. Для состояний 1s имеется шесть уровней энергии, в то время как в отдельном атоме имеется только один уровень 1s. Число 6 обусловлено тем, что рассматривается линейная цепочка из шести равноотстоящих друг от друга атомов водорода, представляющих собой как бы переходную ступень от двухатомных молекул к твердым телам. В действительности первоначальному 1s-уровню атома водорода соответствует два кванто-
4
вых состояния ( ms 1/ 2 и ms 1/ 2 ), так что для цепочки из
шести атомов в группе 1s имеется двенадцать квантовых состояний. Однако каждые два таких состояния различаются только значением спина, а это соответствует столь малой разнице в энергии, что эти двенадцать уровней практически сводятся всего к шести различным уровням.
Рис. 2. Потенциальная энергия в функции расстояния вдоль линейной цепочки из шести равноотстоящих протонов
Рассмотрим частный случай общего принципа, согласно которому сближение атомов оставляет неизменным полное число квантовых состояний с данным квантовым числом. Например, атом имеет восемь возможных состояний с n 2. Если сблизить N атомов, то получится ровно 8N состояний, несмотря на то, что энергии этих состояний могут значительно измениться. В качестве другого примера можно привести следующий: поскольку в атоме имеются два состояния 2s
n 2; 0 , то твердое тело, состоящее из N атомов, имеет
2N состояний 2s.
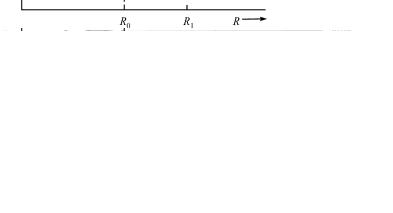
По мере увеличения числа атомов в этой одномерной модели твердого тела в областях, отмеченных на рис. 3. в качестве «разрешенных зон», появляются добавочные уровни. В этом можно убедиться, рассмотрев сначала волновые функции состояний а и б для задачи с шестью атомами. Эти волновые функции схематически представлены на рис. 4. Они представ-
5
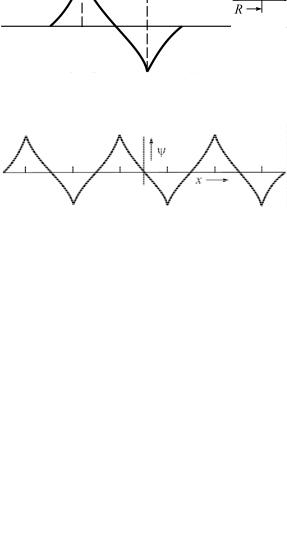
ляют собой очевидное обобщение волновых функций, изображенных на рис. 5, для задачи с двумя атомами. Функция а вообще не меняет знака, в то время как функция б меняет знак между каждыми двумя атомами. Эти функции соответствуют крайним случаям низкой энергии (а) и высокой энергии (б). Функции остальных четырех состояний изменяют знак соответственно 1, 2, 3 и 4 раза. По мере увеличения числа атомов в цепочке энергии состояний, описываемых волновыми функциями типа а и б, заметно не изменяются. Значения кинетической и потенциальной энергий здесь будут практически те же, что и в цепочке из шести атомов, поскольку форма каждой из волновых функций а и б остается почти неизменной. По мере увеличения числа атомов новые энергетические состояния появляются в качестве добавочной «тонкой структуры» между обоими крайними значениями энергии.
Рис. 3. Уровни энергии в функции расстояния между ядрами для цепочки из шести атомов водорода: справа показаны уровни для расстояния R0 (схематически)
6
а
б
Рис. 4. Схематическое изображение вещественной части волновых функций, отвечающих нижнему краю (а) и верхнему краю (б) зоны 1s, для цепочки из шести атомов водорода
а
б
Рис. 5. Симметричная и антисимметричная ψ-функции иона N2 : R= 1,062Å – наблюдаемое расстояние между ядрами
7

Когда количество вещества в цепочке достигнет 1 мг, число уровней энергии будет 1019, а интервалы между ними окажутся настолько малы (порядка 10–19 эВ), что их невозможно будет экспериментально обнаружить. Поэтому такую группу уровней называют разрешенной зоной и рассматривают ее так, как если бы в пределах этой зоны существовало непрерывное распределение дозволенных значений электронной энергии. При этом отметим еще раз, что ширина разрешенной зоны не возрастает при увеличении числа атомов в системе. Поэтому запрещенная зона на рис. 3 остается областью энергии, не содержащей никаких энергетических состояний электронов, независимо от числа атомов в твердом теле. Переход от одномерной теории к трехмерной не изменяет основного вывода о существовании разрешенных зон.
Для иллюстрации зон в твердом теле комбинируют кривые потенциальной энергии, изображенные на рис. 2, с данными о ширине зон при наблюдаемом значении постоянной решетки, которые получаются из кривых, изображенных на рис. 3. Такая комбинация приведена на рис. 6 для лития. Кривая на рис. 6 описывает изменение потенциальной энергии электрона вдоль прямой, проходящей через центры атомов.
Поскольку на рис. 6 по оси ординат отложены значения энергии, то на этот же график можно нанести полную энергию возможных состояний электронов. Уровни 1s показаны в виде узкой полоски. Она узка, так как атомная волновая функция 1s
сосредоточена вблизи ядра, и значение ψ2 для такой функции
очень малó на расстоянии от ядра, равном половине расстояния между соседними ядрами. Поэтому при сближении соседних атомов энергия 1s-уровня очень мало изменяется, поскольку малó перекрытие волновых функций 1s-состояния. Такое же положение обнаруживается на рис. 3, например, при значенииR R1 , где R1 достаточно велико (по сравнению с разме-
рами области локализации состояния 1s атома водорода) для
8
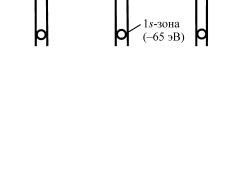
того, чтобы взаимное перекрытие волновых функций электронов соседних атомов в состоянии 1s было заметно.
Рис. 6. Энергетические зоны лития, наложенные на график зависимости потенциальной энергии от расстояния χ вдоль линии ядер
На рис. 6 зона 1s изображена так, как если бы она не простиралась дальше «классических точек поворота» 1s-электро- нов. Это сделано для того, чтобы подчеркнуть, что электроны в этой зоне находятся в среднем очень близко к ядрам. Таким образом, рисунок дает грубое представление как о пространственной протяженности волновых функций, так и о разрешенных уровнях энергии. Разумеется, волновые функции 1s не спадают скачком до нуля в точках, где кинетическая энергия обращается в нуль (а вне этих точек становится отрицательной), но они начинают здесь резко убывать, так что вероятность нахождения электрона на более далеком расстоянии очень мала.
На электронные состояния 2s взаимное перекрытие волновых функций соседних атомов влияет гораздо сильнее, чем на состояния 1s, поскольку радиальная протяженность волновых функций 2s гораздо больше (рис. 7). Поэтому зона 2s го-
9
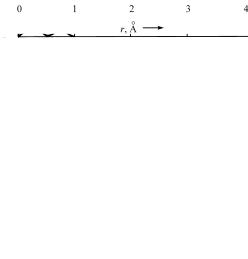
раздо шире. Ее можно было бы изобразить так, как будто она обрывается у классических точек поворота, но волновые функции простираются настолько далеко за пределы этих точек, что локализация последних теряет всякое значение. Электроны в этой зоне, по существу, принадлежат всем атомам кристалла. Электрон, находившийся первоначально вблизи некоторого атомного остова, по прошествии короткого времени с такой же вероятностью может оказаться вблизи любого другого атома (это «короткое время» требуется только из-за ко-
нечной скорости электрона и вполне достаточно времени порядка 10–15 с).
Рис. 7. Сравнение волновых функций состояний 1s и 2s атома лития: ординаты пропорциональны вероятности того, что электрон в соответствующем состоянии будет находиться в интервале радиусов, между
r и r dr
Существуют также 2p-, 3s-, 3p-, 3d- и т.д. состояния атомов лития (обычно незаполненные). В твердом теле уровни энергии всех этих состояний образуют широкие зоны, так как
10
