
Физическая и коллоидная химия. Дисперсные системы
.pdf
компонента в полярных и неполярных растворителях (в среде и ядре) различаются по какому-либо легко измеримому параметру (например, по цвету, т.е. по положению максимума в спектре поглощения), то при переходе через ККМ резко изменяются спектральные характеристики исследуемой трехкомпонентной системы.
Многочисленные методы определения ККМ различаются между собой как по чувствительности и надежности, так и по степени
влияния самого |
измерения на его результаты (смещение |
ККМ |
в присутствии |
красителя, под действием электрического |
поля |
и т.д.). Поэтому бывает полезно сравнение данных, полученных параллельно различными методами.
Определение ККМ по поверхностному натяжению. В отли-
чие от единичных молекул ПАВ, имеющих предельно асимметричную молекулярную структуру, мицеллы сфероидального типа, возникающие при ККМ, обладают значительно более симметричным строением. Благодаря ориентации мицеллообразующих частиц полярными группами наружу такие мицеллы равномерно гидратированы со всех сторон и почти не обладают поверхностной активностью. Поэтому поверхностное натяжение водных растворов ПАВ резко уменьшается с ростом концентрации вплоть до ККМ, после чего почти не меняется с повышением концентрации. На кривых зависимости поверхностного натяжения от логарифма концентрации обнаруживается резкий излом, абсцисса которого соответствует ККМ.
Метод поверхностного натяжения обладает тем преимуществом, что точность определения почти не зависит от измеряемой ККМ.
Кондуктометрический метод. Метод основан на измерении электропроводности растворов ионогенных ПАВ и отличается высокой точностью. По измеренным значениям строят графики зависимостей эквивалентной λ и удельной κ электропроводностей от концентрации (рис. 20):
λ = f ( С); κ = f(С). |
(36) |
|
71 |
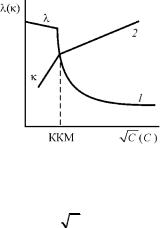
Рис. 20. Зависимости эквивалентной и удельной электропроводностей от концентрации раствора ПАВ:
1 – λ = f ( С); 2 – κ = f(С)
Резкий излом в падающей ветви кривой 1 вызван тем, что при этой концентрации (порядка нескольких миллимоль на литр) начинается формирование ионных мицелл, сопровождающееся образованием облаков из противоионов, связанных с мицеллами. Подвижность поверхностно-активных ионов, общее число проводящих частиц и заряд в системе при этом уменьшаются, и эквивалентная электропроводность понижается при возрастании концентрации резче, чем до ККМ.
Определение ККМ методом солюбилизации. Данный метод применим к ионогенным и неионогенным ПАВ и основан на том, что растворение красителя во внутренней части мицеллы обусловливает его солюбилизацию в водных растворах ПАВ, в результате чего возникает или резко усиливается окраска водного раствора ПАВ при концентрациях выше ККМ. Это можно установить визуально или с помощью колориметрических измерений. Метод прост и надежен, но дает несколько заниженные значения ККМ из-за присутствия красителя в виде дисперсии.
Интерферометрическое определение ККМ. Показатель пре-
ломления ПАВ в мицеллах отличается от показателя преломления раствора, в котором они возникают. Так как размер мицелл меньше длины волны света, то при прохождении луча через раствор показатель преломления усредняется. Поэтому рефракция мицеллизованного раствора ПАВ отличается от рефракции гипотетического раствора ПАВ (т.е. такого, который содержал бы лишь неагрегированные молекулы). Это позволяет определять ККМ по кривой концентрационной зависимости коэффициента рефракции. Однако изменение коэффициента рефракции при мицеллообразовании незначительно, поэтому измерять его необходимо очень точно.
72

Практически удобно измерять не абсолютное значение коэффициента рефракции, а ∆n – разность между величиной его для исследуемых растворов и для эталонного вещества с известным показателем преломления. Для этой цели может быть использован интерферометр – прибор, позволяющий измерять малую разность показателей преломления.
Интерферометрическим методом ККМ определяют по точке излома кривой зависимости ∆n = ƒ(С)
(рис. 21). Преимущество метода в том, что исследуемый раствор в ходе определения не подвергается каким-либо воздействиям, изменяющим условия мицеллообразования (воздействие внешнего электрического поля, влияние ионов красителей и др.).
12.ЛАБОРАТОРНЫЕ РАБОТЫ
Входе изучения дисциплины студенты выполняют пять лабораторных работ. По каждой необходимо предоставить письменный отчет. После выполнения лабораторной работы проводится коллоквиум по данной теме.
Лабораторная работа № 1 МЕТОДЫ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ СИСТЕМ
Цель работы – ознакомиться с методами получения дисперсных систем и составлением формул мицелл золей.
Вопросы для коллоквиума
1.Признаки дисперсных систем.
2.Общие условия получения стабильных лиофобных систем.
73
3.Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды.
4.Классификация дисперсных систем по размеру частиц дисперсной фазы.
5.Методы получения дисперсных систем.
6.Принцип построения коллоидной мицеллы.
Оборудование и реактивы
1.Пробирки.
2.Пипетка капельная.
3.Раствор иодида калия с концентрацией 0,01 моль/дм3.
4.Раствор нитрата серебра с концентрацией 0,01 моль/дм3.
5.Раствор сульфата меди с концентрацией 0,1 моль/дм3.
6.10%-ный раствор гидроксида аммония.
7.2%-ный раствор хлорида железа (III).
8.2%-ный раствор сульфата алюминия.
9.Раствор гидроксида натрия с концентрацией 1 моль/дм3.
10.0,1%-ный раствор гексацианоферрата (III) калия.
11.2%-ный спиртовой раствор канифоли.
12.Дистиллированная вода.
Содержание работы Опыт 1. Получение золя иодида серебра
В пробирку поместите 3–4 см3 0,01 М раствора иодида калия, добавьте 0,5 см3 0,01 М раствора нитрата серебра и перемешайте. Молекулы нерастворимого в воде иодида серебра образуют агрегаты коллоидных размеров. Для того чтобы убедиться в этом, пропустите сквозь пробирку пучок света.
Напишите уравнение реакции получения золя иодида серебра. Что изменится, если в избытке будет нитрат серебра? Напиши-
те формулу мицеллы в обоих случаях.
74
Опыт 2. Получение золей гидроксидов меди (II), железа (III) и алюминия
Для получения золя Cu(OH)2 в пробирку налейте 3–4 см3 0,1 М раствора сульфата меди (II) и по каплям 10%-ный раствор гидроксида аммония до образования золя.
Для получения золя Fe(OH)3 в пробирку налейте 2–3 см3 2%-ного раствора хлорида железа (III), добавьте 4–5 капель 1 М раствора гидроксида натрия до образования устойчивого золя.
Для получения золя Al(OH)3 в пробирку налейте 2–3 см3 2%-ного раствора сульфата алюминия, добавьте 4–5 капель 1 М раствора гидроксида натрия до образования устойчивого золя.
Напишите уравнения реакций получения и формулы мицелл золей. Определите заряды частиц.
Опыт 3. Получение золя гексацианоферрата (III) меди
В пробирку поместите 3–4 см3 0,1 М раствора гексацианоферрата (III) калия (красной кровяной соли), добавьте 1–2 капли 0,1 М раствора сульфата меди (II) и перемешайте. Образуется золь гексацианоферрата (III) меди бурого цвета:
CuSO4 + K3 [Fe(CN)6] = K Cu[Fe(CN)6]↓ + K2SO4
Напишите формулу мицеллы с учетом избытка K3 [Fe(CN)6].
Опыт 4. Получение золя канифоли методом замены растворителя
В пробирку налейте 5–6 см3 воды и добавьте 2–3 капли спиртового раствора канифоли. Объясните сущность данного метода приготовления золей.
75

Лабораторная работа № 2 ОПРЕДЕЛЕНИЕ ПОЛОВИННОГО ВРЕМЕНИ
КОАГУЛЯЦИИ ЗОЛЯ СЕРЫ
Цель работы – определить половинное время коагуляции золя серы.
Вопросы для коллоквиума
1.Агрегативная устойчивость коллоидных систем. Факторы агрегативной устойчивости. Защита лиофобных коллоидов высокомолекулярными веществами.
2.Кинетика электролитной коагуляции. Теория Смолуховского. Половинное время коагуляции.
3.Порог коагуляции. Концентрационная и нейтрализационная коагуляция. Правила коагуляции.
4.Оптические свойства коллоидных систем. Уравнение Рэлея. Закон Бугера–Ламберта–Бера. Принцип действия нефелометра.
Оборудование и реактивы
1. Фотоколориметр КФК-2 или другой аналогичный прибор
(рис. 22).
Рис. 22. Фотоколориметр КФК-2
2.Пипетки мерные.
3.2%-ный спиртовой золь серы.
76

4.Дистиллированная вода.
5.Раствор коагулятора (KCl).
Содержание работы
1.Приготовить золь серы и рассчитать его частичную концентрацию.
2.По результатам эксперимента построить графики n = f(τ)
иnn0 = f(τ).
3.Графически определить половинное время коагуляции золя
серы.
Методика выполнения эксперимента
В тщательно промытую и высушенную кварцевую кювету фотоэлектроколориметра заливают дистиллированную воду, не доливая 5–10 мм до верхнего края кюветы. При этом необходимо проследить за чистотой оптических граней кюветы: на них не должно быть потеков, капель, отпечатков пальцев.
Кювета устанавливается в луче света фотоколориметра, и ручкой настройки устанавливается нулевая оптическая плотность. После окончательной установки нулевой оптической плотности по полной кювете во вторую кювету с известным количеством воды добавляют с помощью пипетки точно отмеренное количество (по заданию преподавателя) 2%-ного спиртового раствора серы. При этом не взбалтывать осадок серы на дне бутылки!
Кювету с получившимся золем устанавливают в луче света прибора и измеряют начальную оптическую плотность D0. Полученная величина D0 нужна для вычисления по уравнению (37) начального радиуса частиц r0, из которого, в свою очередь, по уравнению (38) вычисляют начальную частичную концентрацию золя n0. Поскольку коагуляция начинается практически сразу, время от момента приготовления золя до измерения D0 должно быть минимальным. Быстро измерив начальную оптическую плотность золя, в кю-
77
вету вводят указанное преподавателем количество электролитакоагулянта (раствор НCl) и одновременно включают секундомер. Измеряют оптическую плотность золя в ходе коагуляции. В начале опыта замеры делают через 30 с, постепенно увеличивая интервалы до 1, 2, 5 и 10 мин, поскольку изменение оптической плотности происходит все медленнее. Периодически проверяют и корректируют установку нуля прибора по кювете с чистой водой. Опыт заканчивают, когда оптическая плотность перестает возрастать.
Обработка результатов
Результаты эксперимента и расчетов заносят в таблицу:
τ, мин |
D |
lgD |
n, частиц/м3 |
r, мкм |
r3 |
|
n0 |
|
n |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для расчета радиуса частиц золя используют эмпирическую формулу:
r = 77,6 + 16,6 lgD. |
(37) |
Вес частиц золя определяют по формуле:
G = C · ρз · V,
где С – концентрация спиртового раствора серы (0,02 мас. %). Удельную плотность спиртового раствора золя ρз принимают
равной 0,8 г/см3.
Начальная частичная концентрация золя определяется по формуле
n = |
3G |
, |
(38) |
|
4πr03ρч V |
||||
0 |
|
|
где ρч – плотность вещества, из которого состоят частицы, г/см3 (для серы ρ = 2,07 г/см3); V – объем полученного золя (общий объем воды и спиртового раствора серы), см3.
78

Текущая частичная концентрация частиц золя рассчитывается по формуле
n = n |
r3 |
|
|
|
0 |
, |
(39) |
||
r3 |
||||
0 |
|
|
где r0 и r – радиусы частиц в начальный и текущий моменты времени.
Далее вычисляют отношение nn0 и строят графики n = f(τ) и
nn0 = f (τ). По ним, используя формулу (29), определяют половин-
ное время коагуляции θ.
Лабораторная работа № 3 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ КОНЦЕНТРАЦИИ
МИЦЕЛЛООБРАЗОВАНИЯ В РАСТВОРАХ ПАВ
Цель работы – определить ККМ ионогенного поверхностноактивного вещества (ПАВ) по изменению электропроводности.
Вопросы для коллоквиума
1.Классификация и общая характеристика ПАВ.
2.Строение адсорбционного слоя ПАВ.
3.Термодинамика и механизм мицеллообразования.
4.Строение мицеллы ПАВ. Солюбилизация.
5.Методы определения ККМ.
6.Применение ПАВ.
Оборудование и реактивы
1. Учебно-лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
79
– модуль «Электрохимия» в комплекте с двумя стаканами (50 см3), датчик с двумя электродами для кондуктометрических измерений.
2.0,01 М раствор KCl.
3.Раствор ПАВ (0,005 М раствор олеата или 0,001 М раствор стеарата натрия).
4.Мерные колбы вместимостью 200 см3.
5.Мерные пипетки.
6.Вода дистиллированная.
Содержание работы
1.Приготовить растворы ПАВ.
2.Определить постоянную прибора.
3.Измерить электропроводность растворов ПАВ.
4.Рассчитать удельную и эквивалентную электропроводности растворов ПАВ.
5.Построить графики κ = f (C) и λ = ( C ) и по излому наf
них определить критическую концентрацию мицеллообразования.
Методика выполнения эксперимента
Путем последовательных разведений приготовляют растворы олеата натрия с концентрацией от 0,005 М до 3,125·10–4 М или стеарата натрия с концентрацией от 0,001 М до 6,25·10–5 М.
Подключают электроды к УЛК «Химия» и измеряют электропроводность воды, растворов олеата (стеарата) натрия (начиная с самого разбавленного) и 0,01 М раствора KCl.
Обработка результатов
Электропроводность растворов ПАВ Gвыч определяют, вычитая из измеренной электропроводности Gизм электропроводность воды GH2O.
80
