
Физическая и коллоидная химия. Дисперсные системы
.pdfМногие коллоидные растворы имеют окраску, это указывает на поглощение ими света в соответствующей области спектра. Поглощение в них света подчиняется закону Бугера–Ламберта–Бера:
I = I0 exp(−εCl ), |
(7) |
где С – молярная концентрация растворенного вещества; ε – молярный коэффициент поглощения вещества (не зависит от концентрации, но изменяется с длиной волны, температурой и природой растворителя); l – толщина поглощающего слоя.
Для коллоидных систем этот закон применим при некоторых условиях.
Для высокодисперсных систем закон применим, если слой жидкости не слишком толст и концентрация золя невысока.
Низкодисперсные системы сильно опалесцируют, и уравнение принимает более сложный вид (вводится коэффициент фиктивной адсорбции ε′):
|
− |
ε′Cl |
|
||
I = I0 exp |
λ |
4 |
. |
(8) |
|
|
|
|
|
|
|
6. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Молекулярно-кинетические свойства коллоидных растворов обусловлены непрерывным хаотическим движением молекул и атомов и проявляются в броуновском движении, диффузии и осмосе.
6.1. Броуновское движение
Броуновское движение открыл в 1827 г. английский ботаник Р. Броун. Рассматривая под микроскопом водную суспензию цветочной пыльцы, он обнаружил, что частицы непрерывно двигаются в поле зрения.
Броуновское движение обусловлено столкновениями молекул среды, находящихся в непрерывном тепловом движении, со взве-
21
шенными в ней частицами микроскопических или коллоидных размеров. В результате этих столкновений частица получает огромное число ударов со всех сторон. Результат этих ударов в значительной степени зависит от размеров частицы.
Частицы с большой массой обладают значительной инерционностью и малочувствительны к ударам молекул. Если частица сравнительно мала, то число получаемых ею одновременных ударов со стороны молекул среды значительно меньше, поэтому вероятность неравномерного распределения импульсов, получаемых с разных сторон, увеличивается. В результате частицы приобретают поступательное, вращательное и колебательное движение. Кроме того, интенсивность броуновского движения возрастает с повышением температуры и уменьшением вязкости среды, броуновское движение не прекращается со временем, т.е. не зависит от длительности существования системы.
Теория броуновского движения связала перемещение частиц золей под микроскопом с движением атомов и молекул и тем самым доказала их реальное существование.
6.2. Диффузия
Диффузией называется самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Процесс диффузии является необратимым, он протекает до полного выравнивания концентраций, так как хаотическое распределение частиц отвечает максимальной энтропии системы.
Для количественного описания диффузии используется первый закон Фика:
dm = −D dC |
S dτ, |
(9) |
dx |
|
|
m – количество продиффундировавшего вещества; D – коэф-
фициент диффузии; dCdx – градиент концентрации; S – площадь, че-
рез которую происходит диффузия; τ – продолжительность диффузии.
Знак минус перед правой частью уравнения (9) стоит потому, что производная отрицательна, так как с увеличением х концентрация уменьшается.
Часто для описания диффузии используется удельный поток диффузии i – количество вещества, диффундирующее за единицу времени через сечение единичной площади:
i = |
1 |
|
dm |
= −D |
dC . |
(10) |
|
S |
dτ |
||||||
|
|
|
dx |
|
Из этого уравнения виден физический смысл коэффициента диффузии D. Коэффициент диффузии численно равен количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице.
А. Эйнштейн (1908) вывел уравнение, связывающее коэффициент диффузии D с абсолютной температурой Т, вязкостью дисперсионной среды η и радиусом частиц дисперсной фазы r:
D = |
R T |
, |
(11) |
|
NA 6πηr |
||||
|
|
|
где R – универсальная газовая постоянная; NA – число Авогадро. Из (11) следует, что скорость диффузии растет с повышением
температуры. Согласно этому же уравнению скорость диффузии обратно пропорциональна размеру частиц и вязкости дисперсионной среды, т.е. чем больше размер частиц и выше вязкость среды, тем меньше скорость диффузии. Следовательно, при одинаковой температуре скорость диффузии в коллоидах будет в сотни и тысячи раз меньше, чем в истинных растворах.
Зная коэффициент диффузии, с помощью формулы Эйнштейна можно определить размеры диффундирующих частиц и даже молекулярную массу вещества дисперсной фазы.
Связь между средним квадратичным сдвигом частиц и коэффициентом диффузии дает уравнение Эйнштейна–Смолуховского:
23

|
|
X 2 = 2D τ, |
(12) |
∆ |
где ∆X 2 – средний квадратичный сдвиг частиц,
|
|
X 2 = |
x12 + x22 +... + xn2 |
, |
(13) |
|
∆ |
||||||
|
n |
|||||
|
|
|
|
|
где хi – элементарное смещение частицы по оси x.
6.3. Осмос
Осмос – самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора с меньшей концентрацией в раствор с более высокой концентрацией.
Осмотическое давление – это давление, которое необходимо приложить к раствору по ту сторону мембраны, куда движутся молекулы растворителя, чтобы предотвратить перенос растворителя, т.е. осмос. Явление осмоса характерно как для молекулярных, так и для коллоидных растворов.
Величина осмотического давления определяется только частичной концентрацией (концентрацией дисперсных частиц) и не зависит от их природы и размера. Для разбавленных дисперсных систем осмотическое давление рассчитывается по уравнению
P = ν R T , |
(14) |
осм NA
где NA – число Авогадро; Т – абсолютная температура; ν – частичная концентрация; R – универсальная газовая постоянная.
Частичная концентрация – это число отдельных частиц в единице объема дисперсной системы.
Уравнение (14) аналогично известному уравнению Вант-Гоффа для осмотического давления истинных растворов:
Р |
= |
С |
R T , |
(15) |
|
M |
|||||
осм |
|
|
|
24
где М – масса одного моля растворенного вещества; С – массовая концентрация.
Молекулярно-кинетические уравнения, справедливые для истинных растворов, применимы и к коллоидным растворам с той лишь разницей, что масса 1 моль вещества заменяется массой одной частицы. При одной и той же массовой концентрации число частиц (частичная концентрация) в коллоидном растворе значительно меньше, чем в истинном. Поэтому осмотическое давление лиофобных золей значительно меньше по сравнению с истинными растворами. Например, осмотическое давление 1%-ного раствора сахара достигает 509 мм рт. ст., а осмотическое давление 1%-ного золя
As2S3 – 0,026 мм рт. ст.
6.4. Седиментационный анализ
Частицы вещества, диспергированные в жидкой или газообразной среде, находятся под влиянием сил тяжести и диффузии. В грубодисперсных системах, где размер частиц довольно велик, сила тяжести приобретает большое значение, она заставляет частицы оседать и концентрироваться на дне сосуда. Следовательно, грубодисперсные системы кинетически неустойчивы и довольно легко седиментируют.
Истинные растворы обладают высокой кинетической устойчивостью, ибо частицы их довольно легки, поэтому диффузия преобладает над силой тяжести и происходит выравнивание концентраций во всем объеме системы.
Коллоидные системы по степени дисперсности занимают промежуточное положение. Действие силы тяжести для коллоидных частиц невелико и уравновешивается диффузией, т.е. наступает седиментационное равновесие, поэтому коллоидные частицы не оседают под действием силы тяжести и могут находиться как угодно долго во взвешенном состоянии. Следовательно, такие системы являются седиментационно устойчивыми.
25

На каждую частицу дисперсной фазы действуют три силы: сила тяжести, Архимедова сила и сила трения. Сила седиментации будет результирующей между первой и второй силой. Сила сопротивления среды, направленная противоположно, будет уравновешивать силу тяжести, и частица будет оседать равномерно со скоростью
U = |
2g (ρ−ρ0) |
r2 , |
(16) |
|
9η |
||||
|
|
|
где ρ – плотность частицы; ρ0 – плотность среды; η – вязкость среды; r – радиус сферической частицы; g – ускорение свободного падения.
Зная скорость оседания частиц, можно рассчитать их радиус:
r = |
9η U |
|
2g (ρ−ρ0 ). |
(17) |
В реальных системах частицы обычно неоднородны по размерам, и одной из задач седиментационного анализа является определение относительного содержания различных фракций и распределение частиц по размерам в полидисперсной системе.
Рассмотрим основные приемы седиментационного анализа полидисперсных систем. Весовая модификация седиментационного
анализа заключается в определении |
скорости накопления осадка |
||
|
на чашке весов. Наиболее распростра- |
||
|
ненными |
весами |
являются прибор |
|
Н.А. Фигуровского и торсионные весы. |
||
|
Прибор Фигуровского (рис. 5) |
||
|
представляет собой |
закрепленный в |
|
|
держателе шпиц, на конце которого на |
||
|
кварцевой нити подвешивают стеклян- |
||
|
ную чашечку. По мере накопления |
||
|
осадка шпиц прогибается. За прогибом |
||
|
шпица следят с помощью отсчетного |
||
Рис. 5. |
Прибор Фигуровского микроскопа. Далее строят график из- |
||
26 |
|
|
|

менения величины прогиба шпица во времени, который соответствует зависимости массы осадка от времени: m = f (τ).
В торсионных весах чашечка подвешена к коромыслу весов. За накоплением осадка следят по перемещению стрелки на циферблате.
Другой метод наблюдения седиментации предложен Е.П. Вигнером. Этот метод основан на измерении гидростатического давления столба суспензии при выделении из нее дисперсной фазы в результате седиментации. Если в одно колено сообщающихся сосудов помещена суспензия, а во второе – чистая дисперсионная среда, то высоты уровней суспензии и жидкости будут обратно пропорциональны плотностям. При оседании частиц суспензии плотность ее уменьшится и понизится уровень жидкости в колене, что позволит следить за кинетикой седиментации.
Достаточно широко распространен пипеточный метод. Этот метод основан на отборе проб фракций с помощью пипетки из градуированного цилиндра с определенной высоты слоя суспензии через установленные промежутки времени. Отобранные пробы высушивают и взвешивают. По результатам анализа строят кривую седиментации, отражающую зависимость массы осевших частиц от времени.
Если на кривой седиментации произвольно выбрать несколько точек и провести к ним касательные до пересечения с осью ординат (рис. 6), то данные отрезки будут соответствовать массам фракций частиц с определенным радиусом ri, полностью выпавших в осадок ко времени τi.
Радиус частиц ri каждой фракции ∆mi можно вычислить по
формуле |
|
|
|
|
ri = |
9Hc η |
, |
(18) |
|
2g (ρ−ρ0 ) τi |
||||
|
|
|
где Нс – первоначальная высота столба суспензии; g – ускорение свободного падения; η – вязкость жидкости; ρ, ρ0 – плотности твердой и жидкой фаз; τi – время седиментации данной фракции.
27

Рис. 6. Кривая седиментации полидисперсной системы
Состав дисперсной системы характеризует дифференциальная кривая седиментации (рис. 7). На оси абсцисс откладывают значение радиусов частиц, на ось ординат наносят функцию распреде-
ления ∆Qi . Содержание каждой фракции выразится площадью со-
∆ri
|
ответствующего |
прямоуголь- |
|||
|
ника |
∆Qi ∆ri . |
Построив на |
||
|
|
∆r |
|
|
|
|
|
|
i |
|
|
|
графике |
отдельные |
прямо- |
||
|
угольники для каждой фрак- |
||||
|
ции, соединяют плавной ли- |
||||
|
нией |
середины |
их |
верхних |
|
|
сторон. По характеру диффе- |
||||
|
ренциальной кривой |
распре- |
|||
Рис. 7. Дифференциальная кривая |
деления |
частиц |
по размерам |
||
седиментации |
судят |
|
о составе |
системы |
|
|
(рис. 8). |
Фракция, |
отвечаю- |
||
щая максимуму кривой распределения, называется преимущественной фракцией полидисперсной суспензии.
Чем уже интервал радиусов кривой распределения и чем выше ее максимум, тем суспензия ближе к монодисперсной. Чем кривая
28
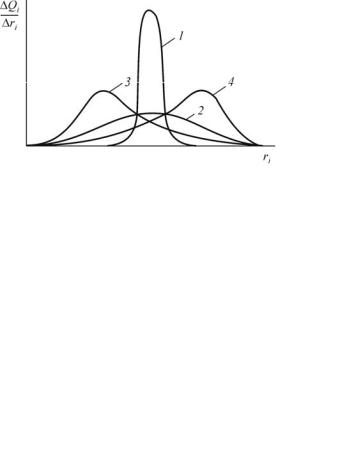
более растянута и чем ниже максимум, тем суспензия более полидисперсна.
Рис. 8. Типичные кривые распределения: 1 – система, приближающаяся к монодисперсной; 2 – наиболее полидисперсная система; 3 – система, содержащая преимущественно мелкие частицы; 4 – система, содержащая преимущественно крупные частицы
Коллоидные частицы под действием силы гравитации оседают достаточно медленно. В связи с этим А.В. Думанский предложил
для определения |
размеров частиц использовать |
центрифугу. |
|
Т. Сведберг разработал ряд конст- |
|
|
|
рукций ультрацентрифуг для опре- |
|
|
|
деления размеров коллоидных час- |
|
|
|
тиц и молекул ВМС. На ось цен- |
|
|
|
трифуги (рис. 9) надет ротор – диск |
|
|
|
с вырезами, в которые вставляются |
|
|
|
кварцевые кюветы |
с исследуемой |
|
|
системой. По мере вращения слой |
|
|
|
концентрированного золя переме- |
|
|
|
щается к периферии, а золь освет- |
Рис. 9. Принципиальное устрой- |
||
лившейся жидкости – к оси враще- |
ство ультрацентрифуги: 1 – ось; |
||
ния. Путем фотосъемки через оп- |
2 – ротор; 3 – кюветы; 4 – кожух; |
||
ределенные промежутки времени |
5 – фотокамера; |
6 – источник |
|
можно получить зависимость рас- |
света |
||
|
|
|
29 |

пределения концентрации частиц дисперсной фазы в кювете от времени.
Размер частиц можно вычислить по формуле
|
|
x |
|
|
|
|
|
9ln |
|
2 |
|
|
|
|
x1 |
|
|
|||
r = |
|
|
|
, |
(19) |
|
2 (ρ−ρ0 ) ω2 τ |
||||||
где х1 и х2 – расстояние от оси вращения до частицы в начальный и текущий момент времени; ω – угловая скорость вращения ротора центрифуги.
7. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Электрокинетические явления были открыты Ф.Ф. Рейссом при исследовании электролиза воды (рис. 10, а, б). В одном эксперименте он использовал трубку с кварцевой диафрагмой. При наложении электрического поля жидкость перемещалась в колено с отрицательно заряженным электродом.
Без диафрагмы перемещения жидкости не наблюдалось, поэтому им был сделан вывод о приобретении заряда жидкостью при контакте с частицами кварца. Явление перемещения жидкости в пористых телах под действием электрического поля получило название электроосмоса. В другом эксперименте Рейсс погружал в слой глины две стеклянные трубки, заполненные водой, и после наложения электрического поля наблюдал перемещение частиц глины в жидкости в направлении положительно заряженного электрода. Явление перемещения частиц дисперсной фазы в электрическом поле получило название электрофореза. Таким образом, было обнаружено, что частицы имеют заряд, противоположный по знаку заряду жидкости.
В 1859 г. Г. Квинке обнаружил, что при течении жидкости через пористое тело возникает разность потенциалов. Это явление по-
30
