
Физическая и коллоидная химия. Дисперсные системы
.pdf
лучило название потенциала течения (рис. 10, в). Ф.Э. Дорн наблюдал возникновение разности потенциалов при осаждении частиц кварца в центробежном поле. Это явление впоследствии назва-
ли потенциалом седиментации (рис. 10, г).
а |
б |
в |
г |
Рис. 10. Схематическое изображение опытов по электроосмосу (а); электрофорезу (б); потенциалу течения (в); потенциалу седиментации (г)
Протекание электрокинетических явлений в дисперсных системах возможно при наличии на границе раздела фаз двойного электрического слоя (ДЭС). При относительном перемещении фаз происходит разрыв ДЭС по плоскости скольжения. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остается в диффузионной среде. В результате этого дисперсионная среда и дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузионного слоя, называется электрокинетическим потенциалом (ζ-потенциалом). Дзета-потенциал является важнейшей характеристикой ДЭС: он определяет скорость относительного перемещения дисперсной фазы в дисперсионной среде, интенсивность электрокинетических явлений, устойчивость золей и т.д.
Электрокинетический потенциал можно рассчитать по формуле
ζ = |
η υ0 |
, |
(20) |
|
ε ε0 H |
||||
|
|
|
||
|
|
|
31 |
где υ0 – линейная скорость движения золя на границе скольжения; Н – напряженность электрического поля; ε0 – электрическая константа; ε – диэлектрическая постоянная среды.
Электрокинетические явления нашли широкое применение. Электрофорез применяют для нанесения тонкого слоя частиц коллоидных размеров на поверхность проводящего материала, а также для покрытия металлических деталей каучуком путем отложения на их поверхности частиц каучука, содержащихся в латексах.
Электроосмос используют при обезвоживании пористых материалов (осушка стен зданий, сыпучих материалов, при строительстве плотин, дамб), а также для обезвоживания (в комбинации с давлением) при фильтровании трудно фильтруемых сред.
8.УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ СИСТЕМ
ИИХ КОАГУЛЯЦИЯ
Коллоидные системы относятся к термодинамически неустойчивым, так как обладают избытком свободной поверхностной энергии. Дисперсная система стремится самопроизвольно повысить свою устойчивость, т.е. уменьшить избыток межфазной энергии
(∆G < 0).
Снижение поверхностной энергии достигается в результате:
–адсорбции на поверхности частиц ионов и молекул из дисперсионной среды;
–уменьшения величины суммарной поверхности коллоидных частиц в результате агрегации частиц.
Разрушение дисперсных систем под действием внешних факторов, приводящее к агрегации мицелл, называется коагуляцией.
Под действием силы тяжести укрупненные агрегаты вещества выделяются из среды в виде осадка (седиментация) или всплывают на поверхность, если их плотность меньше, чем плотность среды.
Врезультате происходит разделение коллоидной системы на фазы: дисперсная фаза отделяется от дисперсионной среды, система теряет устойчивость и разрушается.
32
Под устойчивостью системы понимают ее способность сохранять без изменения малый размер частиц и равномерное распределение их в объеме. Коллоидная устойчивость подразделяется на кинетическую (или седиментационную) и агрегативную.
Кинетическая (седиментационная) устойчивость – это способ-
ность вещества дисперсной фазы, т.е. коллоидных частиц, находиться во взвешенном состоянии, равномерно распределяться по всему объему раствора и не оседать под действием силы тяжести. Кинетическая устойчивость обеспечивается малым размером частиц (10–5–10–7 см), их способностью участвовать в хаотическом броуновском движении, затухающем с увеличением размера частиц.
Агрегативная устойчивость – это способность частиц дисперсной фазы оказывать сопротивление их слипанию и тем самым сохранять определенную дисперсность в целом, или способность коллоидной системы противостоять процессам, ведущим к уменьшению свободной поверхностной энергии на межфазной поверхности. Эта устойчивость обусловлена в основном наличием у коллоидных частиц одноименных зарядов (при сближении частиц увеличиваются силы отталкивания между ними). Другим фактором является образование на поверхности частиц сольватных оболочек из молекул растворителя.
Факторы агрегативной устойчивости отличны от факторов кинетической устойчивости. Повышение температуры, интенсифицируя броуновское движение, препятствует осаждению частиц и, следовательно, повышает кинетическую устойчивость системы. Однако при интенсификации броуновского движения увеличивается возможность слипания частиц в результате их столкновения, что снижает агрегативную устойчивость коллоидного раствора и приводит к укрупнению частиц. Это, в свою очередь, приводит к уменьшению кинетической устойчивости коллоидной системы.
Коагуляция (слипание) коллоидных частиц происходит в результате столкновений при броуновском движении. Коагуляцию вызывают: длительный диализ, механические воздействия, сильное охлаждение или нагревание, пропускание электрического тока, дей-
33
ствие ультразвука, старение, добавление электролитов и неэлектролитов.
Различают скрытую и явную коагуляцию. Скрытая (медленная) коагуляция соответствует начальной медленной стадии, когда слипание коллоидных частиц еще не приводит к образованию крупных конгломератов, поэтому ее трудно обнаружить визуально. Явная (быстрая) коагуляция сопровождается быстрым укрупнением частиц, изменением цвета системы, образованием мути и выпадением осадка.
Коагуляция зависит от следующих термодинамических факторов:
1)электростатического, заключающегося в уменьшении поверхностного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц;
2)адсорбционно-сольватного, состоящего в уменьшении поверхностного натяжения в результате взаимодействия частиц с дисперсионной средой или адсорбции стабилизаторов;
3)энтропийного, проявляющегося в стремлении дисперсной фазы к равномерному распределению по объему системы под действием теплового движения.
На коагуляцию влияют также кинетические факторы:
1)структурно-механический, связанный с тем, что на разрушение пленок, образующихся на поверхности частиц и обладаю-
щих упругостью и механической прочностью, требуются энергия
ивремя;
2)гидродинамический, заключающийся в снижении скорости движения частиц при изменении вязкости и плотности дисперсионной среды.
Каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, электростатический фактор очень чувствителен к введению электролитов. Действие структур- но-механического фактора можно предотвратить с помощью веществ, разжижающих упругие структурированные слои на поверхности частиц, а также механическим, термическим способами.
34
8.1. Коагуляция коллоидных систем электролитами
Коагуляция лиофобных дисперсных систем может происходить в результате различных внешних воздействий, например при механическом воздействии (ультразвука), действии электрического поля, при нагревании или замораживании системы. Коагуляция лиофобных золей может быть вызвана также их сильным разбавлением или концентрированием. Наиболее часто коагуляция дисперсных систем происходит при добавлении электролитов.
Различают два типа электролитной коагуляции коллоидных систем:
1)нейтрализационную, происходящую в результате снижения поверхностного потенциала частиц;
2)концентрационную, протекающую вследствие сжатия диффузной части двойного электрического слоя (потенциал поверхности в этом случае не изменяется).
Нейтрализационная электролитическая коагуляция характерна для коллоидных систем, содержащих слабо заряженные частицы. Концентрационная коагуляция обычно наблюдается в сильно заряженных дисперсных системах.
Все электролиты при определенной концентрации способны вызвать коагуляцию коллоидных систем. При этом коагуляция обусловлена потерей обоих факторов агрегативной устойчивости.
Коагуляция начинается при превышении некоторой минимальной концентрации электролита. Эта величина называется порогом коагуляции.
Порог коагуляции определяется температурой, природой добавленного электролита, знаком заряда добавляемого иона и величиной заряда этого иона.
Порог коагуляции рассчитывается следующим образом:
γ = C Vэл , |
(21) |
Vзоля
35
где γ − порог коагуляции, моль/дм3; С – молярная концентрация раствора электролита, моль/дм3; Vэл – объем раствора электролита,
дм3; Vзоля – объем золя, дм3.
Коагулирующее действие оказывает ион, заряд которого противоположен заряду коллоидной частицы. Например, для положительно заряженного золя AgI
{[(AgI)m nAg+] (n–x)NO3–}x+ xNO3–
коагуляторами будут анионы.
По правилу Шульце – Гарди величина порога коагуляции данного коллоидного раствора зависит от заряда иона-коагулятора, причем, чем выше заряд этого иона, тем ниже величина порога коагуляции. Значения порогов коагуляции для одно-, двух- и трехзарядных ионов примерно обратно пропорциональны 6-й степени их заряда:
γ = const . |
(22) |
z6 |
|
Величина, обратная порогу коагуляции, называется коагулирующей способностью. Коагулирующая способность Р катионов и анионов одинакового заряда возрастает по мере уменьшения радиуса гидратированного иона. Например, получены следующие ряды:
– для катионов щелочных металлов:
PCs+ > PRb+ > PK+ > PNa+ > PLi+ ;
– для анионов:
PCSN− > PI− > PBr− > PCl−.
Различие в коагулирующей способности ионов одного и того же заряда связано с неодинаковой степенью гидратации. Чем сильнее гидратирован ион, тем больше его размер и тем слабее его притяжение к противоположно заряженной поверхности. В результате его коагулирующая способность уменьшается.
36
Коагулирующая способность многих органических веществ намного выше коагулирующей способности неорганических, что связано с их высокой адсорбционной способностью. Высокая адсобционная способность органических ионов обусловлена тем, что они слабо сольватируются и легко поляризуются.
При коагуляции коллоидных растворов смесью электролитов возможны три случая:
а) коагулирующее действие суммируется, т.е. наблюдается аддитивное действие, как, например, для смеси электролитов
NaCl + KCl;
б) коагулирующее действие одного иона снижается в присутствии другого (антагонизм); наблюдается у ионов различного заряда, например, у ионов Al3+ и K+ при коагуляции отрицательно заряженных коллоидных частиц AgI;
в) коагулирующие способности ионов взаимно усиливаются
(синергизм).
Например, при коагуляции золя сульфида ртути коагулирующее действие смеси электролитов LiCl + CаCl2 усиливается и превышает сумму коагулирующих способностей отдельных электролитов.
При смешении двух золей с противоположными зарядами частиц в результате их электростатического притяжения наблюдается
взаимная коагуляция.
8.2. Теория устойчивости коллоидных систем
Современная физическая теория устойчивости коллоидных систем основана на общих принципах статистической физики, теории молекулярных сил и теории растворов. Ее авторами являются Б.В. Дерягин, Л.Д. Ландау, Э. Фервей, Я. Овербек (по первым буквам их фамилий теория названа теорией ДЛФО).
Согласно данной теории между любыми частицами при их сближении возникает расклинивающее давление разделяющей жидкой прослойки в результате действия сил притяжения и отталкива-
37
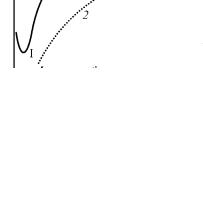
ния. Расклинивающее давление является суммарным параметром, учитывающим действие как сил притяжения, так и сил отталкивания.
Состояние системы зависит от баланса энергии притяжения (Eпр) и энергии отталкивания (Eот). Если преобладает Eот, то система устойчива. Если преобладает Eпр, то нарушается агрегативная устойчивость и происходит коагуляция.
Изменение энергии взаимодействия между двумя частицами при их сближении показано на рис. 11.
Суммарную энергию системы из двух частиц (кривая 3) получают сложением Eот и Eпр.
Рассмотрим эту результирующую кривую 3 (см. рис. 11).
Энергия сил притяжения обратно пропорциональна квадрату расстояния. Энергия сил отталкивания уменьшается с увеличением расстояния по экспоненциальному закону. При минимальных и больших расстояниях, когда экспонента убывает значительно быстрее, чем сте-
пенная функция, между частицами преобладает энергия притяжения (I и II энергетические минимумы). В II энергетическом минимуме энергия сцепления частиц недостаточна для удержания их в агрегированном состоянии. На средних расстояниях, соответствующих толщине двойного электрического слоя, преобладает энергия отталкивания с потенциальным барьером AB, препятствующим слипанию частиц.
38

8.3. Кинетика коагуляции
Скорость коагуляции зависит от концентрации электролита
(рис. 12).
На рис. 12 видны три участка. На участке 1 золь сохраняет аг-
регативную устойчивость. |
|
На участке 2 скорость коагуля- |
|
ции резко возрастает с увеличением |
|
концентрации электролита. Потен- |
|
циальный барьер коагуляции боль- |
|
ше, но соизмерим с кинетической |
|
энергией коллоидных частиц, поэто- |
|
му происходит медленная коагуля- |
|
ция. На участке 3 скорость коагуля- |
|
ции практически постоянна с увели- |
Рис. 12. Зависимость скорости |
чением концентрации электролита. |
коагуляции V от концентрации |
Это связано с тем, что энергетиче- |
электролита C |
ский барьер уже отсутствует, каждое |
|
столкновение частиц становится эффективным и приводит к слипанию частиц. Наблюдается быстрая коагуляция.
Теория быстрой коагуляции, разработанная М. Смолуховским
в1916 г., основана на следующих положениях:
1)рассматриваемая система является монодисперсной;
2)все столкновения частиц являются эффективными;
3)кинетика коагуляции подобна кинетике бимолекулярной ре-
акции.
Согласно теории Смолуховского общее число частиц уменьшается со временем и описывается уравнением второго порядка:
− dn = kn2. |
|
(23) |
|||
|
dτ |
|
|
|
|
Интегрирование уравнения дает выражение для константы |
|||||
скорости коагуляции: |
|
|
|
|
|
k = |
1 |
1 − |
1 |
, |
(24) |
τ |
|
||||
|
n |
n0 |
|
|
|
|
|
|
|
|
39 |

где n0 и n – число частиц в единице объема системы до начала коагуляции и к моменту времени τ соответственно.
Согласно теории быстрой коагуляции константа скорости коагуляции зависит от коэффициента диффузии D и может быть вычислена по уравнению
k =16πDr,
где r – радиус сферической частицы. Если подставить в это уравнение
диффузии, получим:
k = 8RT , 3NA η
(25)
величину коэффициента
(26)
где η – вязкость дисперсионной среды; NA – число Авогадро. Смолуховский ввел понятие о времени половинной коагуля-
ции – времени, в течение которого начальная концентрация частиц уменьшается в два раза. После преобразований получим уравнение:
n = |
n0 |
|
, |
(27) |
|
τ |
|||
1+ |
|
|
||
θ |
|
|
||
|
|
|
|
|
где θ – время половинной коагуляции, с.
Из уравнения (27), преобразованного к виду
n0 |
=1+ |
τ |
, |
(28) |
|
n |
θ |
||||
|
|
|
Рис. 13. Определение времени половинной коагуляции
следует, что если построенный в коор-
динатах nn0 = f (τ) график представляет
собой прямую линию (рис. 13), то это служит показателем соответствия экспериментальных данных теории Смолуховского.
40
