
Изучение физико-химических характеристик наноматериалов необходимы
..pdfся в результате самопроизвольного диспергирования и существуют без дополнительной стабилизации (мицеллярные растворы ПАВ, микроэмульсии, растворы ВМС при определенных условиях, критические эмульсии), и термодинамически неустойчивые системы или лиофобные коллоиды (золи, суспензии, эмульсии), склонные к коагуляции.
В токсикологических исследованиях Вархейта и Шведовой было наглядно продемонстрировано использование нестабильных и агломерированных дисперсий наночастиц, которые в дальнейшем привели к неточной оценке токсичности и неверным выводам. В некоторых исследованиях было изучено влияние различных дисперсионных сред при подготовке дисперсий наночастиц для токсикологических исследований. Было обнаружено, что при диспергировании наночастиц в водных растворах их гидродинамический размер часто превышает размер отдельно взятой частицы, так как приборы определяют размер агломерата. Даже если гидродинамические размеры частиц в растворе больше их первоначального размера, важно знать, в каком состоянии находятся эти частицы: агломерированном (при слабых связях между частицами) или агрегированном (жесткие связи между частицами), поскольку соответствующие биологические реакции и их последствия будут различаться. Устойчивость дисперсий наночастиц и их склонность к агломерации может быть рассмотрена
вконтексте сил, которые могут возникать между частицами: электростатические (притяжения/отталкивания), пространственные (за счет макромолекул, адсорбированных на поверхности) и силы притяжения Ван-дер-Ваальса [94, 102–103].
Эти силы межчастичного взаимодействия играют основную роль при подготовке стабильных дисперсий нанопорошков. Возможность контролировать и манипулировать типом межчастичного взаимодействия представляет собой первый шаг на пути к оптимизации приготовления стабильной дисперсии. Большинство устойчивых дисперсных систем, кроме дисперсной фазы и дисперсионной среды, содержат еще третий компонент, являющийся стабилизатором дисперсности. Стабилизатором могут быть как ионы, так и молекулы, в связи с этим различают три механизма стабилизации дисперсных систем: электростатический, пространственный (стерический) и электростерический. В основе всех механизмов лежит адсорбция, но
вслучае электростатического механизма на поверхности коллоидных
21
частиц происходит адсорбция ионов, в случае пространственного механизма – адсорбция молекул, а в случае электростерического механизма на поверхности происходит адсорбция как ионов, так и молекул. Стабильность дисперсий наночастиц и их тенденция к агломерации могут рассматриваться в контексте электростатических, стерических/пространственных и сил Ван-дер-Ваальса между частицами с использованием теории Дерягина–Ландау–Фервея–Овербека (теория ДЛФО).
В настоящем исследовании рассматривалась стабилизация дисперсий двух видов: электростатическая и пространственная. Электростатическую стабилизацию проводили при помощи одновалентного электролита (KCl). Пространственную – при помощи полимера (натрий-карбоксиметилцеллюлозы) и белков (бычий сывороточный альбумин). Также были изучены такие важные параметры стабильных дисперсий, как pH среды, изоэлектрическая точка, точка нулевого заряда, концентрация электролита и наночастиц в дисперсии.
2.1. Влияние pH и точки нулевого заряда на стабильность дисперсий
Уровень рН оказывает решающее влияние на агломерацию частиц путем воздействия на поверхностный заряд частиц, несущих переменные заряды на поверхности. Дисперсии частиц являются наименее стабильными при рН в точке нулевого заряда (ТНЗ) или в изоэлектрической точке (ИЭТ). ИЭТ – это значение pH, при котором отрицательные и положительные заряды равны и тем самым уравновешивают друг друга. ТНЗ – это понятие, имеющее отношение к явлению адсорбции, и оно описывает состояние, когда заряд на поверхности частицы равен нулю. Значения ИЭТ и ТНЗ совпадают, если нет адсорбции других ионов, помимо ионов, определяющих соотношение H+/OH– на поверхности частицы. Чаще всего это имеет место, если отсутствует специфическая адсорбция на поверхности частиц. При ее наличии, как правило, значения ИЭТ и ТНЗ не совпадают. При уровне рН (в области ИЭТ/ТНЗ) суммарный заряд на поверхности частицы, который образует ДЭС, минимален
Так как мы были заинтересованы в электростатической и пространственной стабилизации дисперсий нанопорошков, был изучен ζ-потенциал в следующих системах: в дистиллированной воде и в
22

0,002%-ном, 0,1%-ном и 0,5% -ном растворах натрий-карбоксиметил- целлюлозы (Na-КМЦ). Таким образом, была изучена зависимость ζ-потенциала от pH среды в дисперсиях с концентрацией порошка 0,5 г/л (500 ppm). Данное высокомолекулярное соединение (NaКМЦ) мы можем использовать в качестве стабилизатора для пространственной стабилизации дисперсий порошков в водной среде. Обычно при изучении токсичности вещества в экспериментах in vivo исследуемые соединения растворяют в деионизированной воде или физиологическом растворе. Для перорального введения водонерастворимых соединений предпочтительно использовать 0,5–1%-ную водную суспензию Na-КМЦ, так как у данного вещества (в применяемой концентрации) отсутствует токсический эффект и химическое взаимодействие с исследуемыми нанопорошками, поскольку при проведении экотоксикологических испытаний применение стабилизаторов может влиять на токсичность исследуемых материалов.
Зависимость ζ-потенциал порошка системы ZrO2-2Y2O3-4CeO2 от рН показана на рис. 7.
|
25 |
|
|
|
|
|
|
|
|
мВ |
15 |
|
|
|
|
|
|
|
|
5 |
|
|
|
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
-5 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
потенциал,-15 |
|
|
|
|
|
|
|
|
|
Дзета- |
-25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-35 |
|
|
|
|
|
|
|
|
|
-45 |
|
|
|
|
|
|
|
|
|
-55 |
|
|
|
|
|
|
|
|
|
Рис. 7. Потенциометрическое титрование дисперсии нанопорошков |
||||||||
системы ZrO2-2Y2O3-4CeO2, диспергированных в дистиллированной |
|||||||||
воде и в растворах Na-КМЦ с разной концентрацией: – без Na-КМЦ; |
|||||||||
|
|
– 0,002 % Na-КМЦ; |
– 0,1 % Na-КМЦ; |
– 0,5 % Na-КМЦ |
|
||||
|
|
|
|
|
|
23 |
|
|
|
Измеренная изоэлектрическая точка (ИЭТ) порошка системы ZrO2-2Y2O3-4CeO2, диспергированного в дистиллированной воде, примерно равна 4,2. Частицы имеют положительный ζ-потенциал при рН ниже 4,2 и отрицательный ζ - потенциал при рН выше 4,2 (см. рис. 7). Эту дисперсию можно считать метастабильной в области pH > 5. Увеличение толщины ДЭС вызывает увеличение электростатического взаимооталкивания, что приводит к росту ζ-потенциала. Значения ζ-потенциала выше ± 30 мВ могут служить индикатором того, что дисперсию можно считать стабильной. Значения ниже
± 30 мВ свидетельствуют о метастабильном состоянии, а при низких значениях ζ-потенциала (ниже ± 10 мВ, вблизи от ТНЗ) заряд на частицах минимален, толщина ДЭС минимальна, поэтому частицы быстро агломерируют и оседают, следовательно, дисперсию можно считать нестабильной [62–65].
В исследовании порошка системы ZrO2-2Y2O3-4CeO2 (см. рис. 7), диспергированного в растворе Na-КМЦ (с различной концентрацией), ИЭТ лежит вне области графика, т.е. в области ниже pH 3. При добавлении Na-КМЦ в качестве пространственного стабилизатора ζ-потенциал дисперсии нанопорошка находится в области 30 мВ. Полученные данные свидетельствуют о том, что у частиц, диспергированных в растворах Na-КМЦ (где электростатический заряд далек от ТНЗ), толщина ДЭС больше, что вызывает увеличение электростатического взаимооталкивания. Данный процесс приводит к росту ζ-потенциала. Следовательно, мы можем считать, что приготовленная дисперсия нанопорошков является стабильной.
ζ-потенциал порошка системы ZrO2-2Y2O3-4CeO2-3Al2O3 как функция от рН показан на рис. 8.
Аналогичный анализ нанопорошка системы ZrO2-2Y2O3-4CeO2- 3Al2O3 показал, что измеренная ИЭТ порошка, диспергированного в дистиллированной воде, примерно равна 7. Частицы имеют положительный ζ-потенциал при рН ниже 7 и отрицательный ζ-потенциал при рН выше 7 (см. рис. 8). Потенциометрическая кривая дисперсии наночастиц лежит в области метастабильного состояния и нестабильного состояния.
Для этой же дисперсии наночастиц, стабилизированной Na-КМЦ в области от pH 3 до 4,5, мы имеем метастабильную дисперсию, а в области выше pH 4,5 – электростатически стабильную дисперсию. При наличии оксида алюминия в составе порошка характер кривых не изменился.
24

|
20 |
|
|
|
|
|
|
|
|
мВ |
0 |
|
|
|
pH |
|
|
|
|
|
|
|
|
|
|
|
|||
, |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
-потенциал |
|||||||||
-20 |
|
|
|
|
|
|
|
||
-40 |
|
|
|
|
|
|
|
||
Дзета |
|
|
|
|
|
|
|
||
-60 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Рис. 8. Потенциометрическое титрование дисперсии нанопорошков системы ZrO2-2Y2O3-4CeO2-3Al2O3, диспергированных в дистиллированной воде и в растворах Na-КМЦ с разной концентрацией:  – без Na-КМЦ;
– без Na-КМЦ;  – 0,1 % Na-КМЦ;
– 0,1 % Na-КМЦ;  – 0,5 % Na-КМЦ;
– 0,5 % Na-КМЦ;  – 0,002 % Na-КМЦ
– 0,002 % Na-КМЦ
Na-КМЦ была выбрана для пространственной (стерической) стабилизации дисперсий порошков. Однако полученные данные (см. рис. 7 и 8) свидетельствуют о том, что Na-КМЦ также стабилизирует дисперсию электростатически (ζ-потенциал находится в области выше –30 мВ). Основываясь на данных, приведенных в исследовании [66], мы можем утверждать, что Na-КМЦ относится к классу ионных полусинтетических полимеров. Помимо пространственной стабилизации, она также может стабилизировать дисперсию электростатически. Таким образом, мы можем сделать вывод, что Na-КМЦ является электростерическим стабилизатором.
Полученные данные позволяют понять, в какой области pH следует работать для получения наиболее стабильных дисперсий. Когда рН среды далёк от ИЭТ, абсолютное значение ζ-потенциала растёт. Электростатическая сила отталкивания в этом случае преобладает над силой Ван-дер-Ваальса и препятствует агломерации. При приближении рН среды к ИЭТ сила отталкивания ослабевает из-за низкого электростатического заряда, а гидродинамический размер растёт. Эти условия благоприятны для формирования крупных агломератов, которые осаждаются из раствора в кратчайший срок под действием гравитационных сил.
25
Также можно утверждать, что добавка 3 % Al2O3 влияет на такие параметры, как ζ-потенциал, изоэлектрическая точка и точка нулевого заряда, и необходимо учитывать эти результаты при стабилизации дисперсии как электростатическим, так и пространственным методами. В случае с небольшой добавкой оксида алюминия (3 %) образующийся при диссоциации ион алюминия не только принимает участие в образовании коллоидов гидроксидов, но и активно действует в процессе обменной адсорбции катионов, вытесняя из диффузионного слоя менее активные катионы. В результате меняются фи- зико-химические свойства всей системы, но, что самое важное, изменяется pH изоэлектрической точки. Так, в системе без добавки оксида алюминия значение ИЭТ лежит в области pH 4,2. Для системы с добавкой 3 % оксида алюминия новые значения ИЭТ при рН 7.
2.2. Стабильность дисперсий в зависимости от концентрации порошка в присутствии пространственного стабилизатора
При планировании токсикологических исследований наночастиц особенно важно учитывать реальные концентрации, с которыми могут столкнуться люди при работе с наночастицами или при использовании продукции, включающей наночастицы. Необходимо и очень важно учитывать концентрации, потому что применение слишком высоких концентраций может привести к ошибочным выводам о степени опасности. Также зависимость токсического действия от концентрации поступающих наночастиц неоднозначна: может происходить как усиление эффекта за счет увеличения числа частиц, так и его уменьшение из-за блокировки проникновения частиц через биологический барьер [62].
В соответствии с европейскими документами Организации экономического содружества и развития (ОЭСР) [66–69] для изучения острой и хронической токсичности наноматериалов на животных (мышах) обычно используются следующие объемные концентрации: 1, 10, 12, 24, 36, 52 и 60 г/л (ЛД50 – летальная доза, вызывающая 50 % смертельных случаев).
Далее были проведены исследования по изучению стабильности дисперсий в зависимости от концентрации порошка в дисперсии (на основе выбранных концентраций). Исходя из полученных результа-
26

тов потенциометрического титрования (см. рис. 7, 8) были выбраны параметры: концентрация Na-КМЦ – 0,5 % и уровень pH – 7, поскольку при данной концентрации стабилизатора дисперсия была наиболее стабильна (ζ-потенциал выше ±30 мВ).
На рис. 9 представлены данные о стабильности дисперсий в 0,5%-ном растворе Na-КМЦ с различной концентрацией порошка.
Доля от ожидаемого Zr, %
25
20 
15
10 
5 |
0
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
Время, ч |
|
|
|
|
а
Доляот ожидаемого Zr, %
30
25
20 
15 
10 


 5
5 





0
0 1 2 3 4 5 6
Время, ч
б
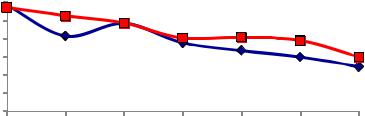
Рис. 9. Стабильность дисперсий в зависимости от концентрации порошка:
а– дисперсия наноразмерного порошка системы ZrO2-2Y2O3-4CeO2;
б– дисперсия наноразмерного порошка системы ZrO2-2Y2O3-4CeO2-3Al2O3:
 – 1 г/л;
– 1 г/л;  – 10 г/л;
– 10 г/л;  – 12 г/л;
– 12 г/л;  – 24 г/л;
– 24 г/л;  – 36 г/л;
– 36 г/л;
 – 52 г/л;
– 52 г/л;  – 60 г/л
– 60 г/л
27

Из полученных результатов теста на стабильность дисперсии мы видим, что в обоих случаях (как без добавки, так и с добавкой оксида алюминия) дисперсия нестабильна (см. рис. 9, а, б). Данный тест проводился в течение 6 часов, каждый час образцы дисперсии брались для анализа. И на графиках (см. рис. 9) показана зависимость общего теоретически ожидаемого количества частиц от времени.
Дисперсия порошка без оксида алюминия с концентрацией 1 г/л является наиболее стабильной, так как на протяжении всего эксперимента мы имеем около 20 % от общего теоретически ожидаемого количества частиц (рис. 9, а). В случае порошка с добавкой оксида алюминия дисперсия с концентрацией порошка 1 г/л также является самой стабильной, так как на протяжении всего эксперимента мы имеем около 25 % от общего теоретически ожидаемого количества частиц (рис. 9, б). Наименее стабильными являются дисперсии с концентрациями порошка 10, 12, 24, 36, 52 и 60 г/л, так как обнаружены только 10 и 15 % частиц от общего теоретически ожидаемого количества для порошка без добавки и с добавкой оксида алюминия соответственно.
|
|
35 |
|
|
|
|
|
|
Доляот ожидаемого |
|
30 |
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
Zr, % |
20 |
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
||
10 |
|
|
|
|
|
|
||
5 |
1 |
2 |
3 |
4 |
5 |
6 |
||
|
|
0 |
||||||
|
|
|
|
|
Время, ч |
|
|
|
|
Рис. 10. Изучение степени стабильности дисперсий порошков, |
|||||||
стабилизированных Na-КМЦ: – без Al2O3; – c 3мас.% Al2O3 |
||||||||
На основании полученных данных (см. рис. 9) было принято решение в дальнейшем проводить тестирование дисперсий с концентрацией порошка 0,05 г/л (50 ppm), так как концентрации выше 1 г/л приводят к сильным межчастичным взаимодействиям. Частицы находятся на таком маленьком расстоянии друг от друга, что очень бы-
28
стро агрегируют и осаждаются, это приводит к нестабильному состоянию дисперсии даже в присутствии стабилизатора (Na-КМЦ).
На рис. 10 представлены результаты исследования степени стабильности дисперсии с использованием стабилизатора Na-КМЦ. Из данных графика видно, что нет сильных различий в степени стабильности между порошком без добавки оксида алюминия и с добавкой, диспергированным в 0,5%-ном растворе Na-КМЦ. Даже при использовании концентрации порошка 0,05 г/л (50 ppm) и в области pH 7дисперсии не являются достаточно стабильными, так как лишь около 25 % частиц от общего теоретически ожидаемого количества остались во взвешенном состоянии в дисперсии. Значит, дисперсии, стабилизированные Na-КМЦ, стабильны лишь на 25 %.
2.3.Исследование стабилизации дисперсий
сиспользованием белков
Как уже обсуждалось ранее, для пространственной стабилизации в водной среде помимо Na-КМЦ могут быть использованы в качестве стабилизатора белки, такие как мышиный, бычий или человеческий сывороточный альбумин. В работе [70] были успешно использованы белки для стабилизации дисперсий нанопорошка оксида титана. Поэтому для более подробного изучения пространственной стабилизации было принято решение использовать белки в качестве стабилизатора.
Доля от ожидаемого Zr, %
30 
25
20
15
10
5
0
0 |
1 |
2 |
3 |
4 |
5 |
6 |
Время, ч
Рис. 11. Изучение степени стабильности дисперсий порошков, стабилизированных бычьим сывороточным альбумином (BSA):
 – без Al2O3;
– без Al2O3;  – c 3 мас. % Al2O3
– c 3 мас. % Al2O3
29
На рис. 11 представлен график теста на степень стабильности дисперсий порошков систем ZrO2-2Y2O3-4CeO2 и ZrO2-2Y2O3-4CeO2- 3Al2O3, стабилизированных бычьим сывороточным альбумином (BSA). Из экспериментальных данных видно, что в начале теста в дисперсионной системе присутствует примерно 30 % частиц от общего теоретически ожидаемого количества, но потом с каждым часом количество взвешенных частиц в дисперсии снижается и к концу эксперимента достигает примерно 15 % от общего теоретически ожидаемого количества.
Сравнивая полученные результаты исследования стабильности дисперсий, стабилизированных при помощи структурно-механи- ческого метода (см. рис. 10 и 11), можно утверждать, что Na-КМЦ дает относительно стабильную дисперсию (около 25 % от общего теоретически ожидаемого количества частиц) на протяжении всего эксперимента (в течение 6 часов). Белки не могут полностью стабилизировать данные дисперсионные системы. Уже в первые часы частицы в дисперсии агломерируют и осаждаются, следовательно, дисперсия не является стабильной.
2.4. Электростатическая стабилизация дисперсий при помощи электролита
Как известно, одним из видов получения стабильной дисперсии является электростатическая стабилизация дисперсионных систем при помощи электролитов. Поэтому изначально было изучено, как будет влиять добавка электролита (с разной концентрацией) на стабильность дисперсий порошка систем ZrO2-2Y2O3-4CeO2 и ZrO2- 2Y2O3-4CeO2-3Al2O3. Для данной части исследования также было решено продолжать использовать концентрацию порошка, равную 0,05 г/л (50 ppm), и производить тестирование в области pH 2, так как предыдущие испытания показали, что данная область pH является наиболее стабильной для порошков обеих систем (как без добавки, так и с добавкой оксида алюминия). Были рассмотрены два вида электролита с различными концентрациями: 1) двухвалентный
Ca(NO3)2 0; 1; и 10 мМ и 2) одновалентный KCl 0,5; 1; 2; и 5 мМ.
Уровень pН является основной движущей силой для регулирования рН-переменного поверхностного заряда частиц. Многовалентные катионы приводят к дестабилизации дисперсии отрицательно
30
