
3895
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное образовательное учреждение высшего профессионального образования
«Хабаровская государственная академия экономики и права»
Кафедра естественнонаучных дисциплин
АНАЛИТИЧЕСКАЯ ХИМИЯ
И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Программа, задания и методические указания по выполнению аудиторной контрольной работы для студентов 2,3-го курсов специальности 260800.62 «Технология продуктов общественного питания» заочной и заочной сокращенной форм обучения
Хабаровск 2012
ББК Г 4
Х 12
Аналитическая химия и физико-химические методы исследования: программа, задания и методические указания по выполнению аудиторной контрольной работы для студентов 2, 3-го курсов специальности 260800.62 «Технология продуктов общественного питания» заочной и заочной сокращённой форм обучения / Л. П. Павлюченкова. – Хабаровск : РИЦ ХГАЭП, 2012. – с.
Рецензент зав. кафедрой фармацевтической и аналитической химии Дальневосточного государственного медицинского университета канд. фарм. наук, доцент Г.С. Сим
Утверждено издательско-библиотечным советом ХГАЭП в качестве методических указаний для студентов
© Хабаровская государственная академия экономики и права, 2012
СОДЕРЖАНИЕ
Предисловие…………………………………………………………………………...4
Программа по дисциплине «Аналитическая химия и физико-химические методы исследования»…………………………………………………………………………5
Методические рекомендации по выполнению аудиторной контрольной работы………………………………………………………………………………….7
Ситуационные задания по дисциплине «Аналитическая химия и физикохимические методы исследования»………………………………………………….9
Вопросы к зачету………………………………………………………………….…37
Приложение А. Формулы расчёта массы навески и результатов титриметрического анализа при прямом титровании………………………………………...……40
Приложение Б Формулы пересчёта концентрации растворов……………………41
Приложение В. Значения предельной подвижности 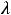 ˚ некоторых ионов в водных растворах при 25˚ С…………………………………………………….……………42
˚ некоторых ионов в водных растворах при 25˚ С…………………………………………………….……………42
Библиографический список…………………………………………………………43
3
ПРЕДИСЛОВИЕ
Аналитическая химия является одной из важных химических дисциплин, необходимых для подготовки специалистов-технологов общественного питания. Данная дисциплина включает в себя теоретические основы, принципы и методы химического и физико-химического анализа веществ.
Химический анализ базируется на таких разделах химии, как строение атома, химическая связь, химическая кинетика и термодинамика, равновесие в реакциях кислотно-основного взаимодействия, комплексообразования, окисления-восстановления и осаждения.
Физические и физико-химические методы анализа основаны на законах физики, электрохимии, физической и коллоидной химии, требуют знаний по органической химии и математике.
В данных методических указаниях приводится программа курса «Аналитическая химия и физико-химические методы исследования», контрольные задания, вопросы для подготовки к зачёту, общие рекомендации по выполнению аудиторной контрольной работы и список литературы.
Контрольная работа по аналитической химии представлена в виде ситуационной задачи. Задания для контрольной работы составлены в соответствии с программой курса для специальности 260800.62 «Технология продуктов общественного питания» государственного образовательного стандарта и включают основные разделы дисциплины.
4
ПРОГРАММА ПО ДИСЦИПЛИНЕ «АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ
МЕТОДЫ ИССЛЕДОВАНИЯ»
Раздел 1. Основные положения аналитической химии
1.1.Аналитическая химия и химический анализ.
1.2.Цели и задачи химического анализа.
1.3.Классификация методов анализа.
1.4.Характеристика методов анализа: диапазон определяемых содержаний, предел обнаружения, избирательность, воспроизводимость, правильность.
Раздел 2. Качественный химический анализ
2.1.Способы и условия проведения качественных реакций.
2.2.Специфичность, избирательность и чувствительность (предел обнаружения) качественных реакций. Способы повышения чувствительности реакций.
2.3.Классификация катионов и анионов.
2.4.Характерные реакции катионов и анионов.
Раздел 3. Количественный титриметрический анализ
3.1. Основные понятия количественного титриметрического анализа: стандартный раствор, эквивалентная точка, точка конца титрования.
3.2.Требования к реакциям в титриметрии.
Классификация методов: кислотно-основное, окислительно-восстановительное, осадительное, комплексонометрическое титрование (комплексонометрия).
3.3.Аналитические весы, измерительная аналитическая посуда.
3.4.Способы выражения концентрации стандартных (титрованных) растворов: молярная, нормальная (эквивалентная), титр, титр соответствия. Поправочный коэффициент. Фактор эквивалентности.
3.5.Способы приготовления титрантов. Стандартизация титрантов.
5
3.6.Виды (приемы) титрования: прямое, обратное (по остатку), заместительное. Способы определения: отдельных навесок, аликвотных частей (пипетирование).
3.7.Метод кислотно-основного титрования (протолитометрия). Индикаторы. Теория кислотно-основных индикаторов. Интервал перехода окраски индикатора. Кривая титрования. Выбор индикатора. Область применения метода.
3.8.Окислительно-восстановительное титрование. Требования к реакциям. Условия проведения окислительно-восстановительного титрования. Классификация методов. Фиксирование точки эквивалентности.
3.9.Перманганатометрическое титрование. Условия проведения титрования. Титрант метода, его стандартизация. Фиксирование точки эквивалентности. Область применения.
3.10.Иодометрическое титрование. Условия определения восстановителей и окислителей. Титранты метода. Фиксирование точки эквивалентности.
3.11.Осадительное титрование. Аргентометрическое титрование. Метод Мора, Фаянса-Ходакова, Фольгарда. Индикаторы и условия титрования. Область применения.
3.12.Комплексонометрическое титрование.
Хелатные комплексы с этилендиаминтетрауксусной кислотой. Сущность метода, металлохромные индикаторы. Условия титрования. Область применения метода.
Раздел 4. Физико-химический анализ
4.1.Классификация физико-химических методов.
4.2.Методы определения количественного содержания.
Прямые: метод градуировочного графика, метод добавок, метод косвенных определений.
4.3. Молекулярно-абсорбционная спектроскопия. Закон светопоглощения Бугера-Ламберта-Бера. Молярный и удельный коэффициент поглощения. Схема прибора. Оптимальные условия фотометрирования. Оценка метода.
6
4.4.Атомно-абсорбционный анализ.
4.5.Люминесцентный анализ. Флуориметрия. Правило Стокса-Люммеля. Квантовый и энергетический выход. Закон Вавилова. Виды тушения флуорисценции. Качественный и количественный флуориметрический анализ. Область применения.
4.6.Рефрактометрия.
Показатель преломления. Приборы. Область применения.
4.7. Электрохимические методы анализа.
Классификация. Потенциометрия (прямая и косвенная). Электроды сравнения и индикаторные. Ионоселективные электроды, их характеристики. Область применения. Кривые потенциометрического титрования.
4.8. Вольтамперметрия.
Полярография, ее достоинства и недостатки. Инверсионная вольтамперметрия. Качественный и количественный анализ. Амперметрическое титрование. Область применения метода.
4.9.Кондуктометрия и кондуктометрическое титрование.
4.10.Хроматография.
Классификация методов. Колоночная, бумажная, тонкослойная, аппаратурная. Газовая хроматография. Высокоэффективная жидкостная хроматография. Ионообменная хроматография. Электрофорез. Область применения.
Согласно ПОЛОЖЕНИЮ об аудиторной контрольной работе (АКР) студентов заочной формы обучения
1.АКР – важный этап процесса обучения перед зачётом или экзаменом.
2.АКР проводится в письменной форме, за счёт времени, отводимого на изучение дисциплины, не более двух академических часов на группу.
3.АКР содержит задания только по материалу разделов программы данной дисциплины.
4.Общая оценка работы («зачтено», «не зачтено») оформляется в зачётно-экзаменационной ведомости, выданной деканатом.
5.Выполнение АКР, не явившимися, и повторное решение не зачтённых работ проводится в специальные дни для ликвидации задолженности.
7
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ АУДИТОРНОЙ КОНТРОЛЬНОЙ РАБОТЫ
К выполнению аудиторной контрольной работы приступают после выполнения работы по неорганической химии и изучения программного материала, приведённого в учебных пособиях, разработанных на кафедре ЕНД и изданных РИЦ ХГАЭП (см. библиографический список).
Во время работы с литературой следует выделить и запомнить новые понятия, термины и формулы. Для лучшего усвоения материала следует вести краткий конспект, который будет полезен при повторении материала перед зачётом.
Задания контрольной работы представлены в виде ситуационной задачи, в которой для предложенного химического соединения (объекта исследования) необходимо привести реакции идентификации (обнаружения) ионов и составить методику количественного определения титриметрическим методом.
При выполнении задания по качественному анализу следует привести по 2–3 реакции на каждый ион. Наряду с написанием уравнения реакции обнаружения иона, необходимо указать аналитический эффект, условия и способы проведения реакции. Желательно сопоставить реакции по селективности и чувствительности.
Для выполнения задания по количественному титриметрическому анализу необходимо знать закон эквивалентов, уметь находить фактор эквивалентности по уравнению реакции, выучить определение молярной, нормальной (эквивалентной) концентрации, титра и титра соответствия. Зная эти понятия, легко перейти к расчётным формулам для определения массы и массовой доли (в %) при прямом, заместительном и обратном титровании, используя приём отдельных навесок или пипетирования (см. приложения А, Б).
Так как при выполнении анализа титриметрическим методом измеряются масса и объём, необходимо познакомиться с особенностями работы с измерительной аналитической посудой и правилами взвешивания на аналитических весах.
Титриметрические методы анализа классифицируют по типу химической реакции: кислотно-основное титрование, окислительно-восстановительное, осадительное, комплексонометрическое. В каждом методе используются различные индикаторные или безиндикаторные способы фиксирования точки
8
эквивалентности. Выбор индикатора и условий титрования (чаще всего рН среды) имеет принципиальное значение для составления методики количественного определения. Каждая методика при любом титриметрическом определении сопровождается систематическими погрешностями. Следует найти и указать причины их возникновения.
При обосновании методик идентификации и количественного определения заданного объекта титриметрическим методом придерживайтесь рекомендуемого в задании алгоритма.
Для выбора физико-химического анализа заданного объекта исходите из его химических свойств и области применения метода. Там, где используете прямое определение приведите способы идентификации и количественного определения. Если физико-химический метод используете только для фиксирования точки эквивалентности при титровании, представьте графическое изображение кривой титрования и покажите точку эквивалентности.
СИТУАЦИОННЫЕ ЗАДАЧИ ДЛЯ ВЫПОЛНЕНИЯ АУДИТОРНОЙ КОНТРОЛЬНОЙ РАБОТЫ ПО ДИСЦИПЛИНЕ
«АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ»
Задание 1
Химический анализ
Обоснуйте методику обнаружения и количественного титриметрического определения железа (II) в твёрдом образце FeSO4∙7H2O и последовательно выполните следующие задания:
1. Приведите реакции обнаружения иона железа (II) и сульфат-иона.
1.2. Напишите соответствующие уравнения реакций обнаружения ионов, укажите аналитический эффект и условия проведения этих реакций.
2. Дайте характеристику титриметрического перманганатометрического определения иона железа (II).
2.1. В какой среде проводится перманганатометрическое титрование?
9
2.2.Запишите уравнение реакции взаимодействия FeSO4 с титрантом, расставьте необходимые стехиометрические коэффициенты, учитывая тип реакции. Укажите, какое это титрование (прямое, обратное, заместительное).
2.3.Каким образом фиксируется точка эквивалентности в этом методе?
2.4.Определите фактор эквивалентности и молярную массу эквивалентов
FeSO4.7H2O .
2.5.Рассчитайте титр соответствия титранта по соли, если используете 0,05н. раствора титранта.
М(FeSO4.7H2O)=278,01 г/моль.
2.6.Рассчитайте массу навески FeSO4∙7H2O, необходимую для приготовления (Vобщ) 100,0 см3 раствора, который затем будет титроваться 0,05н. раствором титранта. С какой точностью взвешивают навеску на аналитических
весах, с такой же точностью рассчитайте массу навески.
2.7.Рассчитайте титр соответствия Т(КМnO/Fe). М Fe=55,84 г/моль.
2.8.Составьте в общем виде формулу расчёта массовой доли w (в %) Fe в соли с учетом способа титрования.
2.9.Рассчитайте массовую долю w (в %) Fe в анализируемом образце, если масса практической навески соли меньше теоретически рассчитанной на 0,0021 г, на титрование аликвоты (Vа) 15,00 см3 (чем отмерите?) раствора анализируемой соли пошло в среднем (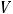 ) 13,85 см3 (чем измерите?) 0,05 н. раствора титранта, поправочный коэффициент («К») которого равен 1,20.
) 13,85 см3 (чем измерите?) 0,05 н. раствора титранта, поправочный коэффициент («К») которого равен 1,20.
2.10 За счёт чего могут возникать систематические погрешности в титриметрии и в перманганатометрии в частности?
Физико-химический анализ
Предложите методику анализа физико-химическим методом, используя один из электрохимических методов. В чём сущность этого метода? Как проведёте идентификацию и количественное определение этим методом?
10
