
3895
.pdfЗадание 10
Химический анализ
Обоснуйте методику обнаружения и количественного титриметрического определения KBr в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения катиона калия и бромид-иона.
2.Дайте характеристику титриметрического аргентометрического определения KBr по методу Мора.
2.1.Запишите уравнение реакции взаимодействия KBr с титрантом.
2.2.Какой индикатор используют в методе Мора? Запишите соответствующее уравнение реакции с этим индикатором. Какое изменение наблюдают в точке конца титрования?
2.3.Рассчитайте молярную массу эквивалентов KBr с учётом фактора эквивалентности.
М(KBr)=119,00 г/моль.
2.4.Рассчитайте титр соответствия, если используете 0,1М раствор титранта.
2.5.Рассчитайте массу навески, необходимую для приготовления (Vобщ) 100,00 см3 (чем измерите?) раствора, который затем будет оттитрован 0,1М
раствором титранта. С какой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) KBr в образце.
2.7.Рассчитайте w (в %) KBr, если практическая масса навески меньше теоретически рассчитанной на 0,0035 г и на титрование аликвоты (Vа) 10,00 см3
(чем измерите?) раствора KBr пошло в среднем ( ) 8,95 см3 0,1М раствора титранта, поправочный коэффициент («К») которого равен 1,015.
) 8,95 см3 0,1М раствора титранта, поправочный коэффициент («К») которого равен 1,015.
2.8. За счёт чего возникают систематические погрешности в титриметрии?
21
Физико-химический анализ
Предложите методику анализа КBr физико-химическим методом анализа, используя электрохимический потенциометрический анализ. В чём сущность этого метода? Как выглядит кривая титрования?
Задание 11
Химический анализ
Обоснуйте методику обнаружения и количественного титриметрического определения KJ в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения катиона калия и иодид-иона.
2.Дайте характеристику титриметрического аргентометрического определения KJ методом Фаянса-Ходакова.
2.1.Запишите уравнение реакции взаимодействия KJ с титрантом.
2.2.Какие индикаторы используются в методе Фаянса-Ходакова?
2.3.Рассчитайте молярную массу эквивалентов KJ с учётом фактора эквивалентности.
М(KJ)=166,00 г/моль
2.4.Рассчитайте титр соответствия, если используете 0,05М раствор титранта.
2.5.Рассчитайте массу навески KJ, необходимую для приготовления (Vобщ) 250,0 см3 раствора, который затем будет оттитрован 0,05М раствором титранта.
Скакой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) KJ в образце.
2.7.Рассчитайте w (в %) KJ, если практическая масса навески больше теоретически рассчитанной на 0,0014 г и на титрование аликвоты (Vа) 20,00 см3 раствора KJ израсходовано в среднем (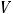 ) 19,36 см3 0,05М раствора титранта,
) 19,36 см3 0,05М раствора титранта,
22
поправочный коэффициент («К») которого равен 0,9932.
2.8.Какую мерную посуду используете по этой методике? Каким требованиям она должна удовлетворять?
2.9.За счёт чего возникают погрешности в титриметрии, не зависящие от эксперта?
Физико-химический анализ
Предложите методику анализа KJ физико-химическим методом анализа, используя электрохимический анализ. В чём сущность выбранного метода? Как выглядит кривая титрования?
Задание 12
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического анализа Fe (II) в твёрдом образце соли Fe(NH4)2(SO4)2 . 6H2O, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона Fe(II), аммония и сульфат-иона.
2.Дайте характеристику титриметрического перманганатометрического определения ионов железа (II).
2.1.Запишите уравнение реакции взаимодействия определяемого иона с титрантом ( в ионном виде).
2.2.Определите фактор эквивалентности и молярную массу эквивалентов
соли.
М[Fe(NH4)2(SO4)2 . 6H2O]=382,13 г/моль
2.3. Рассчитайте титр соответствия титранта по соли, если используете 0,1н. раствор титранта.
2.4. Рассчитайте массу навески соли Fe(NH4)2(SO4)2 . 6H2O, которая затем будет растворена в произвольном объеме воды, подкислена и оттитрована 0,1н. раствором титранта с условием, что на титрование пойдёт примерно 15 см3
23
титранта. (Какой это приём титрования?). С какой точностью взвешивают навеску на аналитических весах?
2.5.Каким образом будет зафиксирована точка эквивалентности?
2.6.Рассчитайте титр соответствия Т(KMnO4/Fe).
М(Fe)=55,84 г/моль
2.7.Составьте в общем виде формулу расчёта массовой доли w (в %) Fe(II) в соли Fe(NH4)2(SO4)2 . 6H2O с учётом способа титрования.
2.8.Рассчитайте w (в %) Fe, если практическая масса навески меньше теоретически рассчитанной на 0,0015 г и на титрование этой навески пошло 14,92 см3 (чем измерите?) 0,1н. раствора титранта с поправочным коэффициентом («К»), равным 0,9930.
2.9.За счёт чего могут возникать систематические погрешности в титриметрии и перманганатометрии в частности?
Физико-химический анализ
Предложите методику анализа Fe(NH4)2(SO4)2 физико-химическим методом, используя электрохимические свойства Fe2+. В чём сущность выбранного метода? Как проведёте идентификацию и количественное определение этим методом?
Задание 13
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения Na2S2O3 . 5Н2О в твёрдом образце, для чего последовательно выполните следующие задания и ответьте на нижеследующие вопросы.
1.Приведите реакции обнаружения иона натрия и тиосульфат-иона.
2.Дайте характеристику титриметрического иодометрического определения тиосульфата натрия.
24
2.1.Запишите уравнение реакции Na2S2O3 с титрантом.
2.2.Как фиксируют точку эквивалентности в этом методе?
2.3.Рассчитайте молярную массу эквивалентов Na2S2O3 . 5Н2О с учётом фактора эквивалентности (см. уравнение реакции).
2.4. Рассчитайте титр соответствия, если используете 0,05н. раствор титранта.
2.5.Рассчитайте массу навески тиосульфата натрия, необходимую для приготовления (Vобщ) 100,00 см3 раствора, который будет взаимодействовать с 0,05н. раствором титранта. С какой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу определения массовой доли w (в %) Na2S2O3 . 5Н2О в образце.
2.7.Рассчитайте w (в %) Na2S2O3 . 5Н2О, если практическая масса навески больше теоретически рассчитанной на 0,0042 г и на титрование 15,00 см3 титранта, помещённого в колбу для титрования, пошло из бюретки 14,65 см3
раствора тиосульфата натрия. Поправочный коэффициент 0,05н. раствора титранта («К») равен 0,9916. Какой это приём титрования?
2.8.За счёт чего возникают систематические погрешности в титриметрии?
Физико-химический анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании Na2S2O3 раствором иода. В чём сущность предложенного метода? Какой вид имеет кривая титрования этим методом?
Вариант 14
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения (NH4)2C2O4 . H2O в твёрдом образце, для чего последовательно выполните следующие задания и ответьте на нижеследующие вопросы.
25
1.Приведите реакции обнаружения иона алюминия и оксалат-иона.
2.Дайте характеристику титриметрического перманганатометрического определения оксалата аммония.
2.1.В какой среде проводят перманганатометрическое титрование, чем создаётся эта среда?
2.2.Запишите уравнение реакции взаимодействия оксалата аммония с титрантом.
2.3.Как зафиксируете точку эквивалентности?
2.4.Определите фактор эквивалентности и молярную массу эквивалентов (NH4)2C2O4 . H2O с учётом типа реакции.
М[(NH4)2C2O4 . H2O] = 142,11 г/моль.
2.5. Рассчитайте титр соответствия, если используете 0,05н. раствор титранта.
2.6.Рассчитайте массу навески (NH4)2C2O4 . H2O, необходимую для приготовления (Vобщ) 200,00 см3 (чем измерить?) раствора, который будет титроваться 0,05н. раствором титранта. С какой точностью взвешивают навеску
на аналитических весах?
2.7.Составьте в общем виде формулу расчёта массовой доли w (в %) (NH4)2C2O4 . H2O в образце с учётом способа титрования.
2.8.Рассчитайте w (в %) (NH4)2C2O4 . H2O, если практическая масса навески меньше теоретически рассчитанной на 0,0036 г и на титрование аликвоты (Vа)
20,00 см3 (чем отмерите?) пошло 18,25 см3 0,05н. раствора титранта, поправочный коэффициент («К») которого равен 0,9832.
2.9. За счёт чего могут возникать погрешности данного количественного определения, не зависящие от эксперта?
Физико-химический анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании (NH4)2C2O4 раствором перманганата калия. В
26
чём сущность этого метода? Какой вид имеет кривая титрования этим методом?
Задание 15
Химический анализ
Обоснуйте методики обнаружения и количественного определения KNO2 в твёрдом образце, для чего последовательно выполните следующие задания и ответьте на нижеследующие вопросы.
1.Приведите реакции обнаружения иона калия и нитрит-иона.
2.Приведите характеристику титриметрического перманганатометрического определения KNO2 .
2.1.В какой среде чаще всего проводится перманганатометрическое титрование, чем создаётся эта среда?
2.2.Запишите уравнение реакции взаимодействия KNO2 с титрантом.
2.3.Каковы особенности перманганатометрического определения KNO2? Какой приём титрования в связи с этим целесообразно применить?
2.4.Каким образом будет зафиксирована точка эквивалентности?
2.5.Вернитесь к уравнению реакции KNO2 с титрантом и определите фактор эквивалентности нитрита калия. Рассчитайте молярную массу эквивалентов
KNO2 .
М(KNO2) = 85,1 моль/дм3.
2.6. Рассчитайте титр соответствия, если используете 0,05н. раствор титранта.
2.7.Рассчитайте массу навески KNO2, необходимую для приготовления 200,00 см3 (Vобщ) раствора, который затем будет титроваться 0,05н. раствором титранта. С какой точностью взвешивают навеску на аналитических весах?
2.8.Составьте в общем виде формулу расчёта массовой доли w (в %) KNO2 в образце с учётом способа титрования.
2.9.Рассчитайте w (в %) KNO2 в образце, если практическая масса навески
27
больше теоретически рассчитанной на 0,0022 г и на титрование 10,00 см3 (чем измерите?) 0,05 н. раствора титранта, поправочный коэффициент («К») которого равен 0,9935, после его помещения в колбу для титрования и подкисления пошло 10,05 см3 раствора KNO2. (Какой это приём титрования?)
2.10 За счёт чего могут возникнуть систематические погрешности данного определения?
Физико-химический анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании KNO2 раствором перманганата калия. В чём сущность этого
метода? Какой вид имеет кривая титрования этим методом?
Вариант 16
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения Н2С2О4 . 2Н2О в твёрдом образце, загрязнённом солью NH4Cl, выполните следующие задания и ответьте на нижеследующие вопросы.
1.Приведите реакции обнаружения иона аммония, оксалат- и хлорид-ионов.
2.Приведите характеристику титриметрического перманганатометрического определения щавелевой кислоты.
2.1.В какой среде проводят пермангантометрическое определение щавелевой кислоты?
2.2.Запишите уравнение реакции взаимодействия щавелевой кислоты с титрантом.
2.3.Как зафиксировать точку эквивалентности в перманганатометрии?
2.4.Определите фактор эквивалентности и молярную массу эквивалентов Н2С2О4.2Н2О.
28
М(Н2С2О4.2Н2О)=126,066 г/моль.
2.5. Рассчитайте титр соответствия, если используете 0,05н. раствор титранта.
2.6.Рассчитайте массу навески Н2С2О4 . 2Н2О, необходимую для приготовления 200,00 см3 раствора, который будет титроваться 0,05н. раствором
титранта. С какой точностью взвешивают навеску на аналитических весах?
2.7.Составьте в общем виде формулу расчёта массовой доли w (в %) Н2С2О4 . 2Н2О в образце с учётом способа титрования.
2.8.Рассчитайте w (в %) Н2С2О4 . 2Н2О, если практическая масса навески
меньше теоретически рассчитанной на 0,0011 г и на титрование аликвоты (Vа) 10,00 см3 (чем отмерить?) пошло 9,45 см3 0,05н. раствора титранта, поправочный
коэффициент («К») которого равен 0,9802.
2.9.За счёт чего могут возникнуть погрешности при данном определении, не зависящие от эксперта?
Физико-химический анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании Н2С2О4 раствором перманганата калия. В чём сущность этого метода? Какой вид имеет кривая титрования этим методом?
Задание 17
Химический анализ
Обоснуйте методики идентификации и количественного титриметрического определения Mg(NO3)2 .6H2O в твёрдом образце, для чего последовательно выполните следующие задания и ответьте на нижеследующие вопросы.
1.Приведите реакции обнаружения иона магния и нитрат-иона.
2.Приведите характеристику титриметрического комплексонометрического определения соли магния.
2.1. Какой титрант применяют в методе |
комплексонометрического |
29
титрования? Какой тип соединения образует титрант с ионом магния? Запишите уравнение реакции в ионном виде.
2.2.В какой среде следует проводить титрование?
2.3.С использованием каких индикаторов можно фиксировать точку эквивалентности?
2.4. Рассчитайте титр соответствия, если используете 0,05М раствор титранта.
2.5. Рассчитайте массу навески Mg(NO3)2 . 6H2O, необходимую для приготовления (Vобщ) 100,00 см3 раствора соли, который затем будет титроваться 0,05М раствором титранта.
М[Mg(NO3)2 . 6H2O]=256,406 г/моль.
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) соли в образце с учётом способа титрования.
2.7.Рассчитайте w (в %) Mg(NO3)2 . 6H2O, если практическая масса навески
меньше теоретически рассчитанной на 0,0031 г и на титрование аликвоты (Vа) 20,00 см3 (чем отмерите?) раствора анализируемой соли пошло 19,25 см3 (чем измерите?) 0,05М раствора титранта, поправочный коэффициент которого равен
0,0053.
2.8. Какие виды погрешности возникают при титриметрическом определении?
Физико-химический анализ
Предложите методику анализа Mg(NO3)2 физико-химическим методом, используя оптические свойства флуоресцирующего комплекса иона магния с 8- оксихинолином. В чём сущность этого метода? Как проведёте идентификацию и количественное определение этим методом?
Задание 18
Химический анализ
30
