
3895
.pdfЗадание 2
Химический анализ
Обоснуйте методику обнаружения и количественного титриметрического определения AgNO3, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона серебра и нитрат-иона.
2.Дайте характеристику титриметрического определения AgNO3 по методу Фольгарда.
2.1.Запишите уравнение реакции AgNO3 с титрантом. Какое это титрование (прямое, обратное, заместительное)?
2.2.Какой индикатор используется в данном методе?
2.3.Рассчитайте молярную массу эквивалентов AgNO3 с учётом фактора эквивалентности (см. уравнение реакции).
М(AgNO3)=169,87 г/моль.
2.4. Рассчитайте титр соответствия, если используете 0,05М раствора титранта.
2.5.Рассчитайте массу навески, необходимую для приготовления (Vобщ) 100,00см3 раствора, который затем будет оттитрован 0,05М раствором титранта.
Скакой точностью взвешивают навески на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) AgNO3 в образце.
2.7.Рассчитайте w (в %) AgNO3, если масса практической навески меньше теоретически рассчитанной на 0,0028 г, на титрование аликвоты (Vа) 15,00 см3 раствора AgNO3 израсходовано в среднем (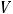 ) 14,45 см3 0,05М раствора титранта, поправочный коэффициент («К») которого равен 0,9865.
) 14,45 см3 0,05М раствора титранта, поправочный коэффициент («К») которого равен 0,9865.
2.8. Какую мерную посуду используете в этой методике? Каким требованиям она должна удовлетворять?
11
2.9. За счёт чего возникают систематические погрешности в титриметрии?
Физико-химический анализ
Предложите методику анализа физико-химическим методом, используя один из электрохимических методов. В чём сущность этого метода? Как проведёте идентификацию и количественное определение этим методом?
Задание 3
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения NaNO2 в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1. Приведите реакции обнаружения иона натрия и нитрит-иона.
1.1. Напишите соответствующие уравнения реакций обнаружения ионов, укажите аналитический эффект и условия проведения реакций.
2. Дайте характеристику титриметрического перманганатометрического определения NaNO2.
2.1.В какой среде проводят перманганатометрическое титрование, чем создаётся эта среда?
2.2.Запишите уравнение реакции взаимодействия NaNO2 с титрантом.
2.3.Каковы особенности перманганатометрического титрования NaNO2? Какое это титрование? Как зафиксировать точку эквивалентности?
2.4.Определите фактор эквивалентности и молярную массу эквивалентов
NaNO2.
М(NaNO2)=68,99 г/моль.
2.5. Рассчитайте титр соответствия, если используете 0,05н. раствора титранта.
2.6. Рассчитайте массу навески NaNO2, необходимую для приготовления 200,0 см3 раствора, который будет затем титроваться 0,05н. раствором титранта.
12
Скакой точностью взвешивают навеску на аналитических весах?
2.7.Составьте в общем виде формулу расчёта массовой доли w (в %) NaNO2 в образце с учётом способа титрования.
2.8.Рассчитайте w (в %) NaNO2, если практическая масса навески меньше теоретически рассчитанной на 0,0053 г, на титрование 10,00см3 подкисленного
0,05н. раствора титранта (поправочный коэффициент которого равен 1,009), помещённого в колбу для титрования, пошло 9,86 см3 раствора NaNO2. Какой это приём титрования?
2.9.Какую измерительную посуду используете для данной методики титрования? Каким требованиям должна отвечать измерительная посуда в титриметрии?
2.10.За счёт чего могут возникать систематические погрешности в титриметрии и в перманганатометрии в частности?
Физико-химический анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании NaNO2 перманганатом калия. В чём сущность предлагаемого метода? Какой вид имеет кривая титрования по этому методу?
Задание 4
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения FeCl3 в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона железа (III) и хлорид-иона.
2.Дайте характеристику титриметрического иодометрического определения
FeCl3.
2.1. Первая реакция протекает по уравнению
2 FeCl3+2KJ=2FeCl2+J2+2KCl.
13
Затем выделившийся иод оттитровывают титрантом (каким?). Запишите уравнение реакций взаимодействия J2 с титрантом. (Какой это способ титрования по отношению к FeCl3?).
2.2.Как фиксируют точку эквивалентности в этом методе?
2.3.Рассчитайте фактор эквивалентности и молярную массу эквивалентов
FeCl3.
М(FeCl3) = 162,206 г/моль.
2.4.Рассчитайте титр соответствия., если используете 0,05н. раствор титранта.
2.5.Рассчитайте массу навески FeCl3, необходимую для приготовления (vобщ) 100,00 см3 его раствора, который затем будет титроваться 0,05н. раствором
титранта. С какой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) FeCl3 в образце.
2.7.Рассчитайте w (в %) FeCl3, если практическая масса навески больше теоретически рассчитанной на 0,0032 г, и после добавления к 10,00 см3
исследуемого раствора иодида калия и кислоты на титрование выделившегося J2 затрачено 9,82см3 0,05н. раствора титранта, поправочный коэффициент («К»)
которого равен 0,9985.
2.8.Какую измерительную посуду использовали в данной методике? Каким требованиям она должна удовлетворять?
2.9.За счёт чего могут возникать погрешности данного определения?
Физико-химический анализ
Предложите методику анализа FeCl3 физико-химическим способом, используя абсорбционный анализ. В чём сущность этого метода? Как проведёте идентификацию и количественное определение этим методом?
Задание 5
Химический анализ
14
Обоснуйте |
методики |
обнаружения |
и |
количественного |
титриметрического определения Na2CO3 в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона натрия и карбонат-иона.
2.Дайте характеристику титриметрического кислотно-основного определения Na2CO3.
2.1.Запишите уравнение реакции с титрантом.
2.2.Определите фактор эквивалентности и молярную массу эквивалентов
Na2CO3.
М(Na2CO3) = 105,99 г/моль.
2.3.Определите среду в точке эквивалентности (кислая, нейтральная, щелочная) и в соответствии с этим выберите индикатор (фенолфталеин или метиловый оранжевый).
2.4.Рассчитайте титр соответствия, если используете 0,1н. раствор титранта.
2.5.Рассчитайте массу навески Na2CO3, необходимую для приготовления (Vобщ) 200,0 см3 раствора, который будет титроваться 0,1н. раствором титранта.
Скакой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) Na2CO3 в образце.
2.7.Рассчитайте w (в %) Na2CO3, если практическая масса навески меньше теоретически рассчитанной на 0,0011 г и на титрование аликвоты (Vа) 20,00см3 анализируемого раствора (чем отмерите?) пошло в среднем ( ) 19,65 см3 0,1н. раствора титранта (чем измерите?), поправочный коэффициент («К») которого равен 0,9985.
) 19,65 см3 0,1н. раствора титранта (чем измерите?), поправочный коэффициент («К») которого равен 0,9985.
2.8.За счёт чего могут возникать систематические погрешности в титриметрии и в кислотно-основном титровании в частности?
Физико-химический анализ
Предложите |
физико-химический |
способ |
фиксирования |
точки |
15
эквивалентности |
при |
титровании |
Na2CO3 |
кислотой, |
используя |
электрохимический анализ. В чём сущность предложенного метода? Какой вид имеет кривая титрования по этому методу?
Задание 6
Химический анализ
Обоснуйте методики обнаружения и количественного определения Na2B4O7 . 10H2O в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона натрия и тетраборат- (борат-) иона.
2.Дайте характеристику титриметрического кислотно-основного определения тетрабората натрия.
2.1.Запишите уравнение реакции взаимодействия Na2B4O7 с титрантом.
2.2.Определите фактор эквивалентности и молярную массу эквивалентов
Na2B4O7 . 10H2O.
М(Na2B4O7 . 10H2O)=381,37 г/моль.
2.3. Определите среду в точке эквивалентности (нейтральная, кислая или щелочная) и в соответствии с этим выберите индикатор (фенолфталеин или метиловый оранжевый).
2.4. Рассчитайте титр соответствия, если используете 0,1н. раствор титранта.
2.5.Рассчитайте массу навески тетрабората натрия, которая затем будет растворена в произвольном объёме воды и оттитрована 0,1н. раствором титранта
сусловием, что на титрование должно пойти примерно 20 см3 титранта. (какой это прием титрования?). С какой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) Na2B4O7
. 10H2O в образце с учётом способа титрования.
2.7.Рассчитайте w (в %) Na2B4O7 . 10H2O, если практическая масса навески
16
меньше теоретически рассчитанной на 0,0014 г и на титрование навески пошло 19,56 см3 (чем измерите?) 0,1н. раствора титранта с поправочным коэффициентом («К»), равным 0,9987.
2.8. За счёт чего могут возникать систематические погрешности в титриметрии и кислотно-основном титровании в частности?
Физико-химичесикй анализ
Предложите физико-химический способ фиксирования точки эквивалентности при титровании Na2B4O7 кислотой, используя электрохимический анализ. В чём сущность этого метода? Какой вид имеет кривая титрования по этому методу?
Задание 7
Химический анализ
Обоснуйте методики обнаружения и количественного определения КОН в твёрдом образце, загрязнённом KCl. Ответьте последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона калия и хлорид-иона.
2.Дайте характеристику титриметрического кислотно-основного определения КОН.
2.1.Запишите уравнение реакции взаимодействия КОН с титрантом.
2.2.Определите фактор эквивалентности и молярную массу эквивалентов
КОН.
М(КОН)=56,10 г/моль.
2.3. Определите среду в точке эквивалентности (рН>7, рН<7, рН=7) и выберите индикатор.
2.4.Рассчитайте титр соответствия, если используете 0,1н. раствор титранта.
2.5.Рассчитайте массу навески КОН, необходимую для приготовления (Vобщ) 100,00 см3 раствора, который будет титроваться 0,1 н. раствором титранта. С
17
какой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) КОН в твёрдом образце.
2.7.Рассчитайте w (в %) КОН, если практическая масса навески больше теоретически рассчитанной на 0,0021 г и на титрование (Vа) 20,00 см3 раствора КОН пошло в среднем (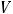 ) 20,24 см3 0,1н. раствора титранта, поправочный коэффициент («К») которого равен 1,012.
) 20,24 см3 0,1н. раствора титранта, поправочный коэффициент («К») которого равен 1,012.
2.8.Какой это способ титрования?
2.9.Перечислите измерительную посуду, которой воспользуетесь.
2.10.Чем обусловлены систематические погрешности в кислотно-основном титровании?
Физико-химический анализ
Предложите методику физико-химического способа фиксирования точки эквивалентности при титровании КОН соляной или серной кислотой, используя электрохимический анализ. В чём сущность предложенного метода? Какой вид имеет кривая титрования?
Задание 8
Химический анализ
Обоснуйте методики обнаружения и количественного титриметрического определения NaOH в твёрдом образце, загрязнённом Na3PO4, для чего последовательно выполните нижеследующие задания.
1.Приведите реакции обнаружения иона натрия и фосфат-иона.
2.Дайте характеристику титриметрического кислотно-основного определения
NaOH.
2.1.Запишите уравнение реакции взаимодействия NaOH с титрантом.
2.2.Определите среду в точке эквивалентности (рН=7; рН>7; рН<7). Выберите индикатор.
18
2.3. Определите фактор эквивалентности и молярную массу эквивалентов
NaOH.
М(NaOH)=39,99 г/моль.
2.4. Рассчитайте титр соответствия, если используете 0,2н. раствор титранта.
2.5.Рассчитайте массу навески NaOH, необходимую для приготовления (Vобщ) 200,00 см3 раствора, который будет титроваться 0,2н. раствором титранта.
Скакой точностью взвешивают навеску на аналитических весах?
2.6.Составьте в общем виде формулу расчёта массовой доли w (в %) NaOH в образце.
2.7.Рассчитайте w (в %) NaOH, если практическая масса навески больше теоретически рассчитанной на 0,0012г и на титрование (Vа) 15,00 см3 (чем измерите?) раствора NaOH пошло в среднем (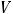 ) 13,85 см3 0,2н. раствора титранта, поправочный коэффициент («К») которого равен 0,9834.
) 13,85 см3 0,2н. раствора титранта, поправочный коэффициент («К») которого равен 0,9834.
2.8.Какой это способ титрования?
2.9.За счёт чего возникают погрешности в кислотно-основном титровании, не зависящие от эксперта?
Физико-химический анализ
Предложите методику физико-химического способа фиксирования точки эквивалентности при титровании NaOH соляной или серной кислотой, используя потенциометрическое титрование. В чём сущность этого метода? Какой вид имеет кривая титрования этим методом?
Задание 9
Химический анализ
Обоснуйте методики идентификации и количественного титриметрического определения NaCl в твёрдом образце, для чего последовательно выполните нижеследующие задания.
1. Приведите реакции обнаружения иона натрия и хлорид-иона.
19
2. Дайте характеристику титриметрического аргентометрического определения NaCl по методу Мора.
2.1.Запишите уравнение реакции взаимодействия NaCl с титрантом.
2.2.Какой индикатор используют в методе Мора? Запишите соответствующее уравнение реакции с этим индикатором. Какое изменение наблюдают в точке конца титрования?
2.3.В какой среде можно проводить определение галогенидов по методу
Мора?
2.4.Рассчитайте фактор эквивалентности и молярную массу эквивалентов
NaCl.
М(NaCl)=58,443 г/моль.
2.5.Рассчитайте титр соответствия, если используете 0,1М раствор титранта.
2.6.Рассчитайте массу навески NaCl, необходимую для приготовления (Vобщ) 100,00 см3 (чем измерите?) раствора, который затем будет титроваться 0,1М
раствором титранта. С какой точностью взвешивают навеску на аналитических весах?
2.7.Составьте в общем виде формулу расчёта массовой доли w (в %) NaCl в образце.
2.8.Рассчитайте w (в %) NaCl, если практическая масса навески меньше теоретически рассчитанной на 0,0021 г и на титрование аликвоты (Vа) 10,00 см3 (чем измерите?) раствора хлорида натрия затрачено в среднем (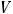 ) 9,75 см3 0,1М раствора титранта, поправочный коэффициент («К») которого равен 1,007.
) 9,75 см3 0,1М раствора титранта, поправочный коэффициент («К») которого равен 1,007.
2.9.За счёт чего могут возникать систематические погрешности данного определения?
Физико-химический анализ
Предложите методику анализа NaCl физико-химическим методом, используя электрохимический анализ. В чём сущность выбранного метода? Как выглядит кривая титрования?
20
