
5605
.pdfжидкость в резервуаре 3, пропитывающая мембрану, состоит из жидкого органического ионита, имеющего кислотные, основные или хелатообразующие функциональные группы, растворённого в подходящем растворителе, который с водой не смешивается. Электрод такого типа для определения кальция содержит в качестве жидкого ионита раствор кальциевой соли додецилфосфорной кислоты в додецилфосфонате.
Недостатком ИСЭ с жидкими мембранами является их механическая непрочность. Эти недостатки частично устранены в плёночных (так называемых отверждённых) электродах, в которых электродоактивное вещество и растворитель – пластификатор внедрены в полимерную матрицу. Срок службы таких ИСЭ увеличивается до года.
Сконструированы газочувствительные мембранные электроды для определения CO2, NH3, NO, H2S и других газов. В основе действия газовых электродов лежит реакция с участием воды, в результате которой изменяется характер среды, например:
CO2 + H2O = H+ + HCO3-,
NH3 + H2O = NH4+ + OH-.
Индикаторными ИСЭ на выделяющиеся при этих реакциях иониты (Н+, ОН-) служат стеклянные рН-электроды.
Позднее появились ферментные, бактериальные и иммуноэлектроды, сочетающие чувствительность и селективность биохимической реакции со скоростью и простотой измерений потенциометрического метода. Дальнейший прогресс в развитие ионометрии связан, во-первых, с разработкой новых ИСЭ, с созданием аналитических методик определения ионов низко- и высокомолекулярных органических соединений, которые раньше методами ионометрии не обнаруживались (например, сахара, белки и др.). Другое направление – улучшение конструкции электродов, например, создание твёрдотельных электродов с твёрдым внутренним контактом между мембраной и металлическим токоотводом. Эти электроды не имеют внутреннего жидкостного заполнения. Примером такой конструкции служ ит твёрдотельный бромидоселективный электрод с мембраной из смеси AgBr и
Ag2S (рисунок 3.1.7).
51
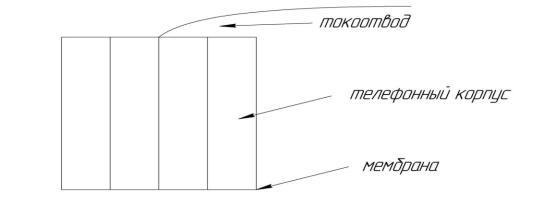
Рисунок 3.1.7 – Твёрдотельный бромид – селективный электрод с мембраной из смеси AgBr и Ag2S
Благодаря большому разнообразию ИСЭ потенциометрическое определение ионов находит применение во многих областях: технике, медицине, экологической службе, сельском хозяйстве, пищевой промышленности. Так, ионометрически определяют ионы кальция в биологических жидкостях, воде, пищевых продуктах (детское питание, полуфабрикаты сахарного производства); ионы йода – в морской капусте и в других водорослях, нитрит-ионы – во всех видах пищевой продукции, в удобрениях и растениях; хлорид-ионы – в пищевых продуктах (хлебе, сырах, маргарине), лекарствах, воде; бромиды – в бромсодержащих пестицидах и почве.
3.2. Вольтамперометрия
Вольтамперометрия – включает группу электрохимических методов, основанных на исследовании вольтамперных кривых, которые получаются, если при электролизе раствора анализируемого вещества повышать напряжение и фиксировать при этом силу тока. Электролиз проводят с использованием легко поляризуемого электрода с маленькой поверхностью, на которой происходит электроокисление или электровосстановление вещества. Электродом сравнения обычно служит слабо поляризуемый электрод.
Если вольтамперометрические измерения проводят при помощи ртутного капающего электрода, то этот метод исследования принято называть полярографией. Полярография была открыта в 1922 г. чешским химиком Ярославом Гейровским, удостоенным в 1959 г. Нобелевской премии в области химии за развитие этого метода. При помощи полярографического метода обычно исследуются вещества, способные к электровосстановлению, реже –
52
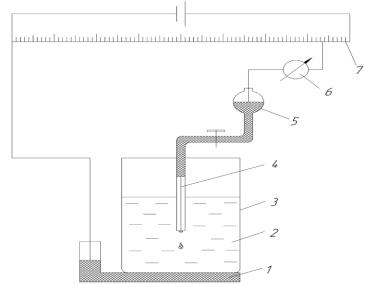
вещества, окисляющиеся при электролизе. Обычная область концентрации анализируемых веществ составляет 1∙10-2 - 1∙10-4 моль/дм3. электролиз проводят в полярографической ячейке, состоящей из сосуда-электролизёра и двух электродов (рисунок 3.2.1).
Рисунок 3.2.1 – Схема полярографической установки
1– донная ртуть (анод);
2– анализируемый раствор;
3– электролизёр;
4– ртутный капающий электрод (катод);
5– резервуар ртути;
6– гальванометр;
7– реохорд
Микроэлектродом, как уже было сказано, является ртуть, вытекающая по капле из тонкого стеклянного капилляра, макроэлектродом служит либо слой ртути на дне электролизёра (донная ртуть), либо внешний стандартный электрод, чаще всего насыщенный каломельный электрод. Обыкновенно макроэлектрод функционирует в качестве катода, на котором происходит электрохимическое восстановление анализируемого вещества, например, иона металла. При этом на катоде (электроде сравнения) изменений не происходит. При подаче на электроды постепенно возрастающего напряжения, вначале через электролизёр протекает очень слабый ток, называемый остаточным. На графике зависимости силы тока от напряжении (рисунок 3.2.2) наблюдаетсяпрямая линия, идущая почти параллельно оси абсцисс. Когда достигается потенциал восстановления, характерный для данного электроактивного вещества - деполяризатора, начинает
53
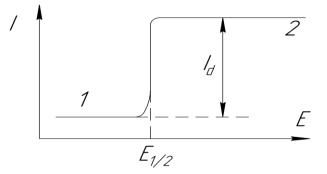
происходить электролиз, что приводит к увеличению тока, проходящего через раствор.
Рисунок 3.2.2 – Полярограмма:
1 – остаточный ток; 2 – диффузионный ток (Id)
При этом раствор около ртутного катода быстро обедняется ионами, наступает концентрационная поляризация. Концентрация ионов у катода снижается практически до нуля, в то время как в глубине раствора она остаётся постоянной, а новые количества ионов доставляются к поверхности электрода путём диффузии.
Диффузия пропорциональна разности концентраций, которая теперь равна концентрации ионов в глубине раствора. Через раствор в это время протекает максимально возможный ток, называемый предельным диффузионным током Id. На графике получается ступень или полярографическая волна, дальнейшего роста тока не наблюдается (на графике – вновь прямая параллельная оси абсцисс). В целом графическое изображение процесса разрядки иона на микроэлектроде называют полярограммой (рисунок 3.2.2).
Величина диффузионного тока прямо пропорциональна концентрации деполяризатора в растворе. Эта зависимость лежит в основе количественного полярографического анализа. Расчёт содержания проводят по методам стандарта, градуировочного графика или методом добавок. Обычная область концентраций анализируемых веществ составляет 1∙10-2 - 1∙10-4 моль/дм3, предел обнаружения составляет 1∙10-5 моль/дм3. Точка перегиба на полярографической волне, от которой начинается быстрое увеличение силы тока, называется потенциалом выделения вещества. Но для целей качественного анализа используют не потенциал выделения, а более постоянную и характерную для определённого вида деполяризатора величину, называемую потенциалом полуволны Е½.
54
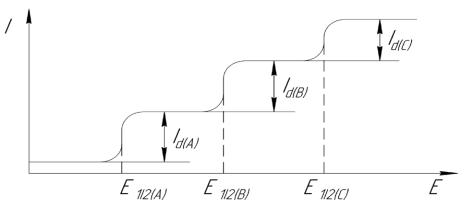
Если потенциалы полуволн достаточно отличаются, то на полярограмме смеси нескольких деполяризаторов можно наблюдать раздельные волны, соответствующие последовательному восстановлению компонентов смеси (рисунок 3.2.3).
Рисунок 3.2.3 – Полярограмма раствора при наличии восстанавливающих веществ А, В и С
Вусловиях классической полярографии чётко выраженные волны наблюдаются при разности потенциалов полуволны не менее 0,1 В при равных концентрациях деполяризаторов. Таким образом, метод полярографии отличается высокой селективностью. Основной областью применения полярографии является анализ неорганических веществ, хотя возможно определение и органических веществ. В практике пищевого анализа методом полярографии определяют ионы меди, олова и свинца в консервах; нитриты и нитраты в рассолах, а также определяют сульфгидрильные группы мяса методом амперометрического титрования (т.е. при полярографическом фиксировании эквивалентной точки).
Внастоящее время метод классической полярографии заменяют другими методами вольтамперометрии в первую очередь из-за токсичности паров ртути и, во-вторых, из-за недостаточной чувствительности метода для определения, например, микропримесей тяжёлых металлов и других токсичных компонентов.
3.2.1. Инверсионная вольтамперометрия
Развитие вольтамперометрии за последние 2 – 3 десятилетия привело к возникновению новых методов и приёмов, направленных на снижение предела обнаружения определяемых веществ и повышение разрешающей способности и селективности метода. Существенное снижение предела обнаружения, вплоть до 1∙10-9 М, даёт метод инверсионной вольтамперометрии (ИВ).
55
Сущность метода заключается в следующем. Определяемое вещество из очень разбавленного анализируемого раствора концентрируют электролизом на поверхности индикаторного электрода. Таким электродом может быть ртутноплёночный электрод, представляющий собой фторопластовый стержень с запрессованной серебряной проволокой. Перед работой на поверхности серебра наносят плёнку ртути толщиной 10 – 20 мкм путём опускания части рабочей поверхности электрода в металлическую ртуть. Ртутные электроды (рабочая область потенциалов от + 0,4 до – 1,6 В) пригодны для определения металлов электроотрицательнее ртути. Используют также графитовые и различные модифицированные металлом электроды. Графитовые электроды имеют наиболее широкую область рабочих потенциалов (от + 1,2 до -1,4 В).
Способ концентрирования вещества (иона, молекулы, комплекса) в методе ИВ зависит от типа элемента, электрода и фонового электролита. Так, ионы металлов восстанавливают на ртутном или графитовом электродах с последующим электрорастворением:
Mn+ + ne → М М – ne → Mn+.
Таким образом, на ртутных электродах можно определить: Sb, Bi, Cu, Pb, Sn, Cd, Zn. На графитовых и модифицированных металлом электродах определяют в основном Hg, As, Ag, Au. Ионы металла могут быть сконцентрированы на поверхности электрода в виде осадка малорастворимого соединения (Fe, Mn, Pb …) или в виде комплекса (Ni, Co, Fe, Cu, Al…). Методом ИВ определяют анионы и некоторые органические вещества, образующие малорастворимые соединения с ионами Hg2+2, Cl-, Br-, NCS-, I-, SO42-, S2-. В настоящее время методом ИВ определяют более 100 органических и неорганических соединений.
Рассмотрим пример определения иона металла на ртутно-пленочном электроде. Для накопления металла в амальгаме, электролиз проводят при потенциале более отрицательном (на 0,2 – 0,4 В), чем потенциал полуволны для исследуемого иона металла, при энергичном перемешивании раствора. Для полного выделения вещества из раствора понадобилось бы больше времени, что неприемлемо для анализа, поэтому электролиз ведут в течение какого-то разумного строго фиксированного времени. В зависимости от концентрации это время варьирует от 5 до 60 минут. Например, электролиз иона кадмия из 1∙10-8 М раствора проводят в течение 15 минут при потенциале около – 0,9 В, что на 0,3 В меньше потенциала полуволны (Е½) иона. Во время электролиза протекает реакция восстановления:
56
Cd2+ + 2e → Cd(Hg).
В результате этого происходит накопление кадмия на электроде в виде амальгамы. По окончании электролиза прекращают перемешивание и после успокоения раствора (через 30 секунд), линейно изменяют потенциал в сторону более положительных значений по сравнению с потенциалом электролиза (включают развёртку потенциала). При потенциале – 0,65 В наблюдается растворение полученного продукта (анодное растворение):
Cd(Hg) – 2e → Cd2+ + Hg,
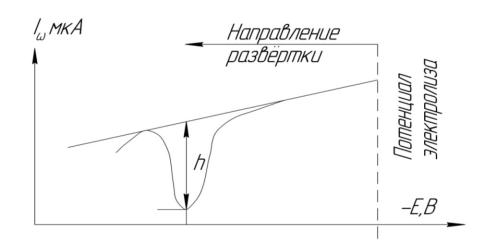
что сопровождается быстрым ростом анодного тока (Id). После достижения максимума ток уменьшается вследствие истощения концентрации элементного кадмия на электроде. Графическое изображение этого процесса называют анодной инверсионной вольтамперограмма (рисунок 3.2.1.1).
Рисунок 3.2.1.1 – Анодная инверсионная вольтамперограмма
Сила анодного тока (или высота полярографической волны h) пропорциональна концентрации иона металла в растворе. Концентрацию иона металла находят по градуировочному графику, построенному по стандартным растворам. При достаточно тщательной работе можно достичь точности определения порядка 2 %. Метод инверсионной вольтамперометрии пригоден для определения нескольких веществ при совместном присутствии. В этом случае электролиз ведут при потенциале предельного тока наиболее трудно восстанавливающегося вещества. При правильно выбранном фоновом электролите на инверсионной вольтамперограмме можно наблюдать раздельные пики компонентов смеси. На рисунке 3.2.1.2 представлена инверсионная вольтамперограмма пробы воды, содержащей следовые количества ионов меди, свинца, кадмия и цинка.
57
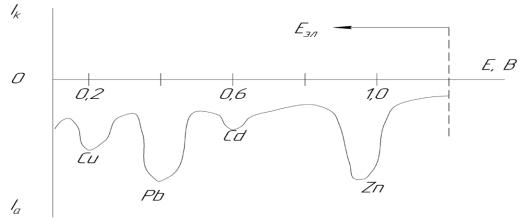
Рисунок 3.2.1.2 – Анодная инверсионная вольтамперограмма образца речной воды, содержащей 0,5 мкг/дм3 Сd, 5 мкг/дм3 Cu и 15 мкг/дм3 Pb и Zn
Предварительный электролиз вели при – 1,2 В на плёночном ртутнографитовом электроде в течение 5 минут.
Интерес к методам ИВ с каждым годом растёт благодаря его широким возможностям и появлению относительно недорогой вольтамперометрической аппаратуры как за рубежом, так и в России. Отечественными приборами снабжены многие лаборатории.
Инверсионная вольтамперометрия конкурирует с широко распространённым методом атомно-абсорбционной спектроскопии по таким характеристикам, как предел обнаружения, селективность и точность.
Методом ИВ определяют пестициды в почве и сельскохозяйственной продукции. Разработаны методы определения токсичных элементов (Cd, Zn, Pb, Cu) в пищевых продуктах (в зерне, кофе, какао, чае, мясе, рыбе, крупах). Диапазон определяемых содержаний метода инверсионной вольтамперометрии представлен в таблице 3.2.1.1.
Таблица 3.2.1.1 – Диапазон определяемых содержаний токсичных элементов
Определяемый элемент |
Диапазон содержаний мг/дм3 |
Zn |
1 – 100 |
Cd |
0,05 – 50 |
Cu |
0,04 – 10 |
Pb |
0,05 - 30 |
Возможно определение Sn и Pb в соках, вине, овощах, пищевых добавках; витаминов В1, В2, С и антибиотиков в продуктах; Hg – в детских игрушках. Более широкое внедрение метода ИВ в практику позволит успешно решать проблемы качества потребительских товаров.
58
3.3. Кондуктометрия
Кондуктометрический анализ основан на использовании зависимости между электропроводностью (электрической проводимостью) растворов электролитов и их концентрацией.
Электрической проводимостью называют способность вещества проводить электрический ток под действием электрического поля. Единицей измерения является сименс (См).
Перенос электричества в проводниках первого рода – металлах – осуществляется движением электронов по проводнику в направлении от отрицательного полюса источника тока к положительному. В проводниках второго рода – растворах электролитов – перенос электричества осуществляется движением ионов. Анионы движутся к аноду, катионы – к катоду. Об электропроводности растворов электролитов судят на основании измерения их электрического сопротивления в электрохимической ячейке, которая представляет собой стакан с двумя впаянными в него электродами, между которыми и находится испытуемый электролит. Через ячейку пропускают переменный электрический ток. Электроды изготавливают из металлической платины, покрытой губчатой платиной.
Закон Ома остается справедливым и для растворов электролитов:
E = JR = Jρl/S,
где Е – разность потенциалов между электродами, В; J – сила тока, А; R – сопротивление, Ом; ρ – удельное сопротивление, Ом∙см; l – расстояние между электродами, см; S – сечение (площадь поверхности), см2.
Величина æ = 1/ρ, обратная удельному сопротивлению электролита,
называется удельной электрической проводимостью.
Удельная электрическая проводимость равна электрической проводимости 1см3 раствора, находящегося между параллельными электродами площадью 1см2 при расстоянии между ними 1 см, измеряется в См/см.
Удельная электропроводность зависит от природы электролита и растворителя, концентрации раствора, температуры.
Кроме удельной электропроводности в кондуктометрии используют
эквивалентную электропроводность (подвижность) λ.
Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Её
59

единицей измерения является См∙см2 / (моль экв). При этом за молярную массу эквивалента принимается молярная масса одинаковых частиц с единичным зарядовым числом, например, H+, Br-, 12 Ca2+, 13 Fe3+, 12 CO32 – и т.д.
Эквивалентная электропроводность увеличивается с уменьшением концентрации раствора электролита и как удельная возрастает с повышением температуры.
Удельная и эквивалентная проводимость связаны соотношением: λ = 1000 æ / с,
где с – молярная концентрация эквивалента, моль/л.
В соответствии с законом независимого движения ионов Кольрауша эквивалентная электропроводность раствора электролита при бесконечном разбавлении λ∞ (или λ◦) равна сумме предельных подвижностей катиона λ◦+ и аниона λ◦- , т.е. их подвижностей при бесконечном разбавлении раствора.
λ∞ = λ◦++ λ◦–.
Предельная подвижность иона в заданном растворителе при заданной температуре является константой.
В таблице 3.3.1 приведены в качестве примера подвижность λ◦ некоторых ионов в водных растворах при 25◦С.
Таблица 3.3.1 – Значения предельной подвижности λ◦ некоторых ионов в водных растворах при 25◦С
Катион |
λ◦, См. моль-1 ∙ см2 |
Анион |
λ◦, См. моль-1 ∙ см2 |
H+ |
349,8 |
OH- |
198,3 |
NH4+ |
73,3 |
½ CrO42- |
85 |
K+ |
73,5 |
½ SO42- |
80,8 |
½ Pb2+ |
70 |
Br- |
78,1 |
⅓ Fe3+ |
68 |
I- |
76,8 |
½ Ba2+ |
63,6 |
Cl- |
76,5 |
Ag+ |
62,2 |
NO3- |
71,5 |
½ Ca2+ |
59,5 |
½ CO32- |
69,3 |
½ Zn2+ |
54 |
⅓ PO43- |
69 |
½ Mg2+ |
53 |
HCO3- |
44,5 |
Na+ |
50,11 |
CH3COO- |
40,9 |
Зависимость электропроводности от концентрации раствора используют в количественном кондуктометрическом анализе. Применяют как прямую кондуктометрию, так и кондуктометрическое титрование. Измерение электрической проводимости проводят с помощью приборов кондуктометров,
60
