
5605
.pdf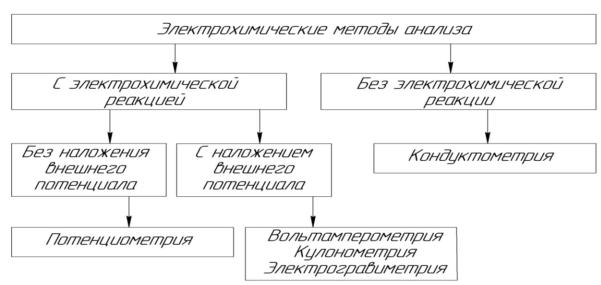
внешнего потенциала и без наложения потенциала. Подобную классификацию можно представить в виде схемы:
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент, в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации вещества, и электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами – потенциометрами.
В методах с наложением постороннего (внешнего) потенциала применяют электролитическую ячейку, названную так потому, что на электродах ячейки под действием наложенного потенциала происходит электролиз-окисление или восстановление веществ. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора. Приборы для электрохимических определений, кроме электрохимической ячейки, мешалки, нагрузочного сопротивления, включают устройства для измерения разности потенциалов, тока, сопротивления раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр, микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал слабый, его усиливают с помощью различных технических усилителей. В приборах методов с наложением потенциала важной частью является устройство для подачи на
41

ячейку соответствующего потенциала стабилизированного постоянного или переменного тока (в зависимости от метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
3.1. Потенциометрия
Потенциометрия – это ряд методов анализа и определения физикохимических характеристик электролитов и химических реакций, основанных на измерении электродных потенциалов и электродвижущих сил гальванического элемента.
Ионометрия – потенциометрический метод определения концентрации (активности) ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в исследуемый раствор, относительно электрода сравнения.
Потенциометрический метод анализа был разработан в конце 19 века, после того как Нернст вывел (в 1889 г.) уравнение, связывающее электродный потенциал Е с активностью (концентрацией) компонентов обратимой окислительно-восстановительной системы:
E E 0 |
0,059 |
lg |
aox |
, |
|
|
|||
|
n |
|
aчed |
|
где Е0 – стандартный потенциал редокс-системы;
n – число электронов, принимающих участие в электродной реакции;
аох, ачed – активности окисленной и восстановленной форм редокс-системы (соответственно).
Если электрод состоит из вещества, ионы которого находятся в растворе, тогда
E E0 |
0,059 |
lg a |
|
. |
|
м |
|||
|
n |
|
||
|
|
|
||
Электродом сравнения называют электрод с известной постоянной величиной электродного потенциала. Обычно в качестве электродов сравнения используют каломельный или хлоридсеребряный (часто называемый хлорсеребряным, что не совсем точно) электроды.
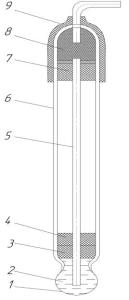
Основной частью хлоридсеребряного электрода является погруженная в насыщенный раствор KCl серебряная проволока, покрытая сло ем AgCl (рисунок 3.1.1).
42
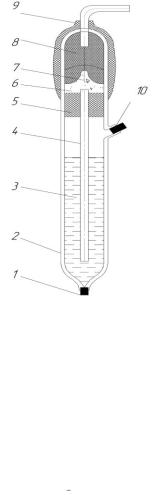
Рисунок 3.1.1 – Хлоридсеребряный электрод (типа ЭВЛ – 1 МЗ) 1 – нить асбестовая; 2 – корпус; 3 – насыщенный раствор KCl;
4 – электролитический ключ; 5 – 8-резиновые пробки; 6 – полость; 7 – контактный полуэлемент; 9 – колпачок; 10 – пробка
Контакт электрода с раствором осуществляется через мостик из асбестовой нити, смоченной раствором KCl, с потенциометром – через серебряную проволоку. В основе электрода лежит окислительно-восстановительная реакция:
AgCl(т) + е = Ag + Cl-.
Всоответствии с уравнением Нернста потенциал хлоридсеребряного электрода зависит от активности хлорид-ионов в растворе:
Е= Е0 AgCl/Ag, Cl- - 0,591gaCl-.
Внасыщенном растворе KCl потенциал электрода постоянный и равен 0,199 В.
Индикаторным электродом (или электродом определения) называют электрод, который обратим относительно активности анализируемого потенциалопределяющего иона. Так, при измерении рН потенциал индикаторного электрода должен зависеть от активности (концентрации) ионов водорода в растворе.
В качестве индикаторных электродов в последние годы используются
ионоселективные мембранные электроды. Создание ионоселективных электродов (ИСЭ) способствует интенсивному развитию прямого потенциометрического определения многих ионов в растворе. В настоящее время выпускается около 30 ИСЭ.
Кроме давно применяемого стеклянного ионоселективного электрода для определения рН, используются электроды, чувствительные к ионам F-, Cl-, Br-, I-,
43
CN-, S2-, NO3-, NH4+, Pb2+, Cu2+, Ca2+, Ni2+, Na+, K+, а также ИСЭ для определения газов (CO2, NH3, HCl, H2S, HCN, NO), мочевины и других азотосодержащих соединений. Важнейшей составной частью ионоселективного электрода является полупроницаемая мембрана. Это тонкая плёнка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора и обладающая способностью пропускать ионы только одного знака заряда (катионы или анионы). Во многих случаях эти мембраны проницаемы для ионов только одного сорта в присутствии других ионов того же знака заряда. Можно, например, изготовить электрод для определения ионов Na+ в присутствие ионов других щелочных металлов.
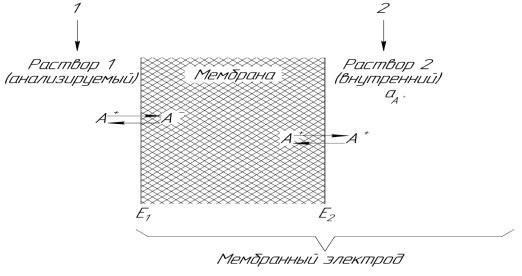
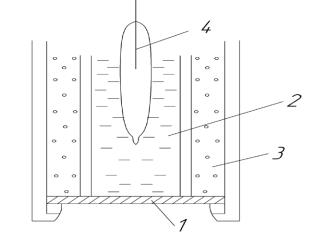
Поместим полупроницаемую мембрану между двумя растворами с разными концентрациями иона А+. Один из этих растворов – анализируемый (или внешний) – имеет концентрацию с1, другой – стандартный (или внутренний) – с2. На внешней и внутренней поверхностях мембраны будет происходить обмен ионами, т.е. ионы из раствора будут проникать в фазу мембраны (рисунок 3.1.2).
Рисунок 3.1.2 – Мембранный электрод Электроды сравнения (1 – внешний, 2 – внутренний)
Таким образом, электродная реакция на мембранном электроде сводится к обмену ионами А+ между раствором и мембраной:
А+ (раствор) = А+ (мембрана) и не связана с переходом электронов. Из-за того что активности ионов в растворе и в фазе мембраны различны, на обеих поверхностях мембраны возникнут граничные потенциалы Е1 и Е2. Если во внешний и внутренний растворы поместить электроды сравнения, то можно
44
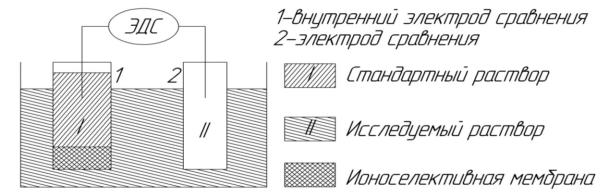
измерить разность потенциалов ∆Е, (рисунок 3.1.3), равную мембранному потенциалу Ем:
Ем = Е1 – Е2 = 0,0591∙lg(a1/a2).
Поскольку активность ионов А+ во внутреннем растворе постоянна, то Ем = const + 0,0591∙lg a1, т.е. потенциал мембранного электрода зависит от активности А+ в анализируемом растворе.
Рисунок 3.1.3 – Схема измерения потенциала ИСЭ
Следовательно, при потенциометрических измерениях с использованием
ИСЭ собирают гальванический элемент: |
|
|
|
|
||||
электрод |
|
стандартный |
|
мембрана |
|
анализируемый |
|
электрод |
|
|
|
|
|||||
сравнения 1 |
|
раствор |
|
|
раствор |
|
сравнения 2 |
|
|
|
|
|
|
||||
Электродвижущую силу (ЭДС) собранного гальванического элемента можно измерить, применяя любые потенциометрические устройства, сконструированные на основе токоусилительных систем. Для этой цели служат иономеры и рН-метры.
Прежде чем применить ИСЭ для аналитической цели, необходимо провести его электрохимическое излучение, которое предусматривает установление основных характеристик, таких как интервал выполнения электродной функции, селективность и время отклика.
Так, методом построения градуировочного графика определяют область прямой концентрационной зависимости потенциала электрода (линейный участок электродной функции). Градуировочный участок строят в координатах Е – PaA (-lgА), применяя стандартные растворы анализируемого иона (рисунок 3.1.4).
45
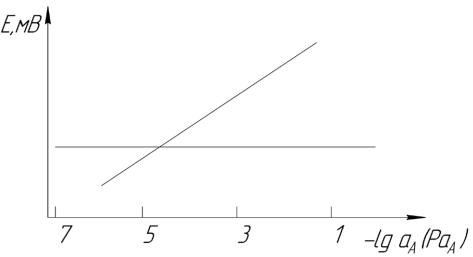
Рисунок 3.1.4 – Интервал выполнения электродной функции и предел обнаружения ионоселективного электрода
При низких концентрациях для очень хороших электродов при концентрации порядка 10-7 М наблюдается отклонение от линейной зависимости (рисунок 3.1.4 – при концентрации меньше 1∙10-5 моль/дм3), т.е. электрод утрачивает электронную функцию. Точка перегиба на графике характеризует предел обнаружения с помощью данного электрода (в приведённом примере – 1∙10-5 моль/дм3). Полученную для стандартных растворов графическую зависимость в дальнейшем используют в качестве рабочего графика при определении активности или концентрации иона в анализируемых пробах.
Селективность электрода относительно определяемого иона А+ в присутствии постороннего иона В+ характеризуется потенциометрическим коэффициентом селективности КА,В. Если КА,В < 1, то электрод селективен относительно А; если КА,В > 1, то относительно В (иногда коэффициент селективности выражают обратным соотношением КА,В, тогда соответственно меняют знак на обратный). Чем меньше КА,В, тем выше селективность электрода относительно иона А. Например, коэффициент селективности хлоридселективного электрода по отношению к бромид-ионам равен 8∙10-2, к йодид ионам - 1∙10-4. Это означает, что хлорид-ионы можно определять с помощью данного электрода в присутствии 800 кратного избытка ионов брома и 10 000 кратного избытка ионов йода.
Время отклика ИСЭ характеризует время достижения постоянного потенциала электрода. Время отклика для разных электродов может колебаться от нескольких секунд до нескольких минут. Это зависит от природы мембраны, а также от методики измерения потенциала, т.е. от того, переносят электрод из
46
более разбавленного раствора в более концентрированный или наоборот. Для большинства электродов время отклика составляет 1 минуту.
В зависимости от материала, использованного для изготовления мембран, различают электроды с твёрдыми, стеклянными или жидкими мембранами. Стеклянные мембраны изготавливают из специальных стёкол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определяемому иону. Первым электродом со стеклянной мембраной был электрод, селективный относительно ионов водорода, который вытеснил все другие электроды, применявшиеся для измерения рН среды.
Стеклянный электрод (рисунок 3.1.5) состоит из стеклянной трубки с припаянным тонкостенным стеклянным шариком (рН – чувствительная мембрана) на конце. В трубке находится раствор с постоянным значением рН (0,1 М HCl) и внутренний хлоридсеребряный электрод.
Теория стеклянного электрода была разработана Б. П. Никольским. При длительном вымачивании стеклянного электрода на обеих поверхностях мембраны образуется тонкий слой из гидратированного геля. Все пустоты занимаются ионами Н+, вытеснившими находившиеся там ионы Na+ (которые входят в состав стекла). Перед работой стеклянный электрод некоторое время вымачивают в 0,1 М HCl.
Рисунок 3.1.5 – Стеклянный электрод 1 – мембрана; 2 – раствор; 3 – парафин; 4,7 – резиновые пробки; 5 нить;
6 – корпус; 8 – эпоксидный компаунд; 9 – колпачок
Подготовленный таким образом электрод, в котором протоны поверхности стекла находятся в равновесии с протонами раствора, может быть использован
47
для определения рН. Электродная реакция на стеклянном электроде сводится к обмену ионами водорода между раствором и стеклом:
Н+ (раствор) ↔ Н+ (стекло).
При погружении стеклянного электрода в раствор, рН которого отличается от рН внутреннего раствора, на стеклянной мембране возникает мембранный потенциал Ем, который можно измерить, поместив в исследуемый раствор внешний хлоридсеребряный электрод:
Ем = Е0 (стекла) + 0,059 рН.
Стандартный потенциал стеклянного электрода Е0 обычно не определяют. При использовании заводских рН-метров эта операция заменяется настройкой по стандартным буферным растворам, т.к. шкала рН-метра проградуирована непосредственно в единицах рН.
Основными достоинствами стеклянного электрода являются простота работы, применяемость в широкой области рН (от 0 до 12), быстрое установление равновесия и возможность определения рН в окислительновосстановительных системах. Срок жизни электрода измеряется годами.
Потенциометрическое определение рН находит широкое применение в технохимическом контроле пищевых производств, так как в основе технологии производства многих пищевых продуктов лежат биохимические и микробиологические процессы, существенно зависящие от рН среды. Определяют рН в соках, кофе, мясе, рыбе и других продуктах.
Систематические исследования зависимости электродных свойств стекла от его состава показали, что определённым его изменением (введение оксидов бора, алюминия) можно получить стекло, электроды из которого селективны по отношению к ионам натрия, калия, аммония, серебра. Из них более широкое применение вследствие высокой селективности нашёл натрий-селективный электрод. С помощью этого электрода можно определять, например, NaCl в пищевых продуктах.
Помимо стеклянных электродов используют ИСЭ с твёрдой мембраной. Такую мембрану создают прессованием в виде диска или таблетки монокристаллических (например LaF3) или поликристаллических труднорастворимых в воде солей (например Ag2S или AgBr). В этих мембранах обычно один из двух составляющих соль ионов способен перемещаться в кристаллической решётке по её дефектам. Поэтому электроды с твёрдой мембраной используются в качестве датчиков для определения тех ионов,
48
которые входят в состав мембраны, а также тех ионов, которые способны взаимодействовать с активными центрами материала мембраны.
Первый твёрдофазный высокоселективный мембранный электрод был сконструирован с использованием монокристалла LaF3 для определения активности ионов фтора. Он нашёл применение для определения фторид-иона в питьевой, морской и сточных водах, зубных пастах, в витаминах, моче, слюне, в костях, зубах и т.д.
Электроды, чувствительные к ионам Ag+, S2-, Cu2+, Cd2+, Pb2+, I-, Br- получены на основе Ag2S (поскольку перечисленные ионы или замещают ион серебра, или связываются с ним на поверхности кристалла).
Монокристаллический AgCl лежит в основе электрода, селективного по отношению к ионам хлора. Этот электрод используется для определения хлоридионов в воде, почве, биологических жидкостях, пищевых продуктах. Достоинством этих электродов является длительный срок работы. Однако число ионных кристаллических соединений, обладающих ионной селективной проводимостью, ограничено.
Твёрдые мембранные электроды могут быть не только гомогенными, но и гетерогенными. Гетерогенные мембраны содержат какой-либо связующий материал (матрицу) для придания электроду необходимой механической прочности. В качестве такой инертной матрицы используют парафин, силиконовый каучук, эпоксидные смолы, поливинилхлорид и другие материалы. Диспергированные в них соли, например CaCrO4, BaSO4, AgI, Ag2S, обеспечивают возможность определения ионов, входящих в состав названных солей. Потенциал таких электродов недостаточно устойчив и селективность невелика.
В электродах с жидкой мембраной раствор сравнения отделён от анализируемого тонким слоем органической жидкости, представляющих собой раствор жидких ионитов или в качестве растворителей используют обычно различные эфиры, например октиловый или дециловый эфиры фосфорной кислоты, дибутилфосфат и др. Потенциалопределяющими ионами являются катионы или анионы ионных ассоциатов, т.е. электрод с катионным ассоциатом чувствителен и к катионам и к анионам, входящим в состав ассоциата. Для уменьшения растворимости ассоциата в водной фазе, т.е. для удерживания его в основном в фазе органического растворителя, обычно применяют ассоциаты потенциалобразующих ионов с противоионами большой молекулярной массы, что обеспечивает большую гидрофобность ассоциата. В качестве примера
49
мембраны с ионным ассоциатом для определения анионов можно привести ассоциаты крупных 1,10-фенантролинатов никеля, железа и некоторых других металлов с анионами многих кислот. Селективность таких анионочувствительных электродов определяется следующим рядом:
ClO4- > SCN- > I- > NO3- > Br- > Cl- > F-.
На основании этого ряда можно установить возможность определения одного из анионов в присутствии других. Так, например, определению нитратионов мешают все анионы, стоящие в ряду влево от него, и не мешают те, которые расположены вправо от него.
Электродоактивным соединением, чувствительным к ионам кальция, является кальциевая соль эфира фосфорной кислоты, к ионам калия – его хелатный комплекс с антибиотиком валомицином. Ассортимент жидкостных ИСЭ постоянно увеличивается. Известны электроды селективные к катионам (Cu2+, Mg2+, Mn2+, NH4+), к анионам (CO32-, SO42- и др.), а также к ионногенным органическим соединениям. Среди них наиболее важным для решения экологических проблем являются электроды, селективные к поверхностноактивным веществам (определение загрязнения моющими средствами) и к ацетилхолину (определения загрязнения фосфорорганическими ядохимикатоми).
Схема жидкостного ионоселективного электрода показана на рисунке 3.1.6.
Рисунок 3.1.6 – Ионоселективный электрод с жидкой мембраной: 1 – мембрана; 2 – внутренний стандартный раствор; 3 – ионит; 4 – внутренний электрод сравнения
Внутренний хлоридсеребряный электрод 4 погружён во внутренний раствор 2, содержащий определяемый катион. Пористая мембрана 1 с одной стороны соприкасается с раствором сравнения хлоридсеребряного электрода, с другой – с анализируемым раствором. Ионочувствительная
50
