
- •Билет № 1.
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •28)Углеводы. Классификация. Функции
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •24) Общее представление о липидах. Классификация липидов
- •1) Структурная
- •2) Запасная (энергетическая)
- •3) Защитная
- •4) Важный компонент пищевого сырья
- •2 Классификация липидов
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •16) Спирты и фенолы. Многотомные спирты.
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •27)Особенности растворов вмс: набухание и растворение
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •Полисахариды. Классификация. Функции
- •1. Клеточная локализация и функция
- •2. Строение миоглобина
- •3.Связывание гема с апомиоглобтом
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •17. Механизм действия буферных систем. Буферные системы крови
- •48)Вторичная структура белка
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •54)Классификация сложных белков
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25)Физико-химические свойства белков
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
2. Восстановление.
Восстановление сахаров приводит к многоатомным спиртам. В качестве восстановителя используют водород в присутствии никеля, алюмогидрид лития и др.
II. Реакции по гидроксильным группам
1. Алкилирование (образование простых эфиров).
2. Ацилирование (образование сложных эфиров).
3. Как и все многоатомные спирты, глюкоза с гидроксидом меди (II) дает интенсивное синее окрашивание (качественная реакция).
III. Специфические реакции
Кроме приведенных выше, глюкоза характеризуется и некоторыми специфическими свойствами - процессами брожения. Брожением называется расщепление молекул сахаров под воздействием ферментов (энзимов). Брожению подвергаются сахара с числом углеродных атомов, кратным трем. Существует много видов брожения, среди которых наиболее известны следующие:
a) спиртовое брожение
b) молочнокислое брожение
c) маслянокислое брожение
Упомянутые виды брожения, вызываемые микроорганизмами, имеют широкое практическое значение. Например, спиртовое – для получения этилового спирта, в виноделии, пивоварении и т.д., а молочнокислое – для получения молочной кислоты и кисломолочных продуктов.
Билет №4
Закон действующих масс
Необходимым условием химического взаимодействия между частицами (молекулами, ионами) исходных веществ является их столкновение друг с другом. Число столкновений тем больше, чем выше концентрация каждого из исходных веществ или чем больше произведение концентрации реагирующих веществ.
Зависимость скорости реакции от концентраций реагирующих веществ описывается законом действия масс, открытым Н.Н. Бекетовым, К. Гульдбергом и П. Вааге в 1865-1867 гг.: «При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ».
В общем виде для гомогенной реакции аА+ вВ → сАВ
V = k [A]m[B]n = kCAmCBn,
где k - коэффициент пропорциональности, который называется константой скорости реакции; СА, СВ - молярные концентрации реагирующих веществ; m - порядок реакции по веществу А; n - порядок реакции по веществу В; m + n - общий порядок реакции; k = V, если [А] = [В] = 1 моль/л.
Константа скорости реакции k - это скорость химической реакции при условии, что концентрации реагирующих веществ равны 1 моль/л.
Величина константы скорости реакции зависит от природы реагирующих веществ, температуры, наличия катализаторов и не зависит от концентрации веществ.
Закон действия масс непосредственно справедлив для простых реакций. Если реакции сложные и представляют собой совокупность процессов, закон может быть применен к любому из них в отдельности.
В случае гетерогенных реакций в уравнение закона действия масс входят концентрации только веществ, находящихся в газовой фазе или в растворе.
Например: S (т) + O2 (г) → SO2 (г); V = k [O2]m
Математическое выражение закона действующих масс называют кинетическим уравнением реакции.
36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
Гетерополисахариды — полисахариды, построенные из остатков различных моносахаридов, встречаются в растительных и животных организмах.
Гиалуроновая кислота - гетерополисахарид, имеющий очень важное значение для высших организмов. В соединительной ткани это основной компонент внеклеточного желатинообразного вещества, заполняющего межклеточное пространство тканей. Она содержится в больших количествах в синовиальной жидкости суставов. Стекловидное тело и пуповина новорожденных также богаты гиалуроновой кислотой.
В структурном отношении молекула представляет собой линейный полисахарид, образованный дисахаридными повторяющимися звеньями, состоящими из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединенных β-1,3-гликозидной связью. Повторяющиеся дисахаридные звенья связаны между собой β-1,4-связью.
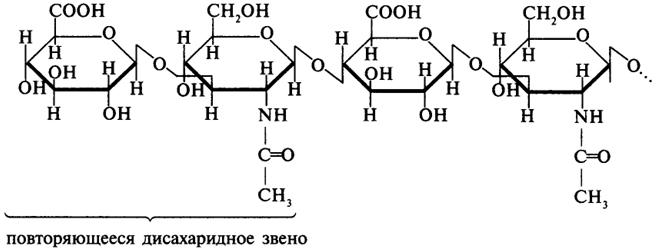
Био роль:
Цементирующее, связывающее вещество различных межклеточных элементов
Препятствует проникновению бактерий
Входит в состав суставной и синовиальной жидкостей
Выполняет роль смазки
Стекловидное тело глаза на 100% состоит из гиалуроновой кислоты
Хорошо связывает воду и катионы
Обеспечивает тургор тканей человека
Хондроитинсульфаты являются составной частью костной ткани, хрящей, сухожилий, роговицы глаз, сердечных клапанов и других подобных тканей. Хорошо связывают воду и катионы.
Состоят из дисахаридных остатков N-ацетилированного хондрозина, соединенных β-1,4-гликозидными связями. В состав хондрозина входят D-глюкуроновая кислота и D-галактозамин, связанные между собой β-1,3-гликозидной связью.

Билет № 5.
С повышением температуры скорость химического процесса обычно увеличивается. В 1879 г. голландский ученый Я. Вант-Гофф сформулировал эмпирическое правило: с повышением температуры на 10 К скорость большинства химических реакций возрастает в 2-4 раза.
Математическая запись правила Я. Вант-Гоффа:
γ10 = (kт+10)/kт, где kт - константа скорости реакции при температуре Т; kт+10 - константа скорости реакции при температуре Т+10; γ10 - температурный коэффициент Вант-Гоффа. Его значение колеблется от 2 до 4. Для биохимических процессов γ10 изменяется в пределах от 7 до 10.
Все биологические процессы протекают в определенном интервале температур: 45-50°С. Оптимальной температура является 36-40°С. В организме теплокровных животных эта температура поддерживается постоянной благодаря терморегуляции соответствующей биосистемы. При изучении биосистем пользуются температурными коэффициентами γ2, γ3, γ5. Для сравнения их приводят к γ10.
Зависимость скорости реакции от температуры, в соответствии с правилом Вант-Гоффа, можно представить уравнением:
V2/V1 = γ ((T2-T1)/10)
Энергия активации. Значительное возрастание скорости реакции при повышении температуры нельзя объяснить только увеличением числа столкновений между частицами реагирующих веществ, т.к., в соответствии с кинетической теорией газов, с возрастанием температуры количество столкновений увеличивается в незначительной степени. Увеличение скорости реакции с повышением температуры объясняется тем, что химическая реакция происходит не при любом столкновении частичек реагирующих веществ, а только при встрече активных частиц, обладающих в момент столкновения необходимым избытком энергии.
Энергия, необходимая для превращения неактивных частичек в активные, называется энергией активации (Eа). Энергия активации – избыточная, по сравнению со средним значением, энергия, необходимая для вступления реагирующих веществ в реакцию при их столкновении. Энергию активации измеряют в килоджоулях на моль (кДж/моль). Обычно Е составляет от 40 до 200 кДж/моль.
Энергетическая диаграмма экзотермической и эндотермической реакции представлена на рис. 2.3. Для любого химического процесса можно выделить начальное, промежуточное и конечное состояния. На вершине энергетического барьера реагенты находятся в промежуточном состоянии, которое называется активированным комплексом, или переходным состоянием. Разность между энергией активированного комплекса и начальной энергией реагентов равна Еа, а разность между энергией продуктов реакции и исходных веществ (реагентов) - ΔН, тепловому эффекту реакции. Энергия активации, в отличие от ΔН, всегда величина положительная. Для экзотермической реакции (рис. 2.3, а) продукты расположены на более низком энергетическом уровне, чем реагенты (Еа < ΔН).


Активированный комплекс
Рис.
2.3. Энергетические диаграммы реакций: А
– экзотермической Б - эндотермической
Еа является основным фактором, определяющим скорость реакции: если Еа > 120 кДж/моль (выше энергетический барьер, меньше активных частиц в системе), реакция идет медленно; и наоборот, если Еа < 40 кДж/моль, реакция осуществляется с большой скоростью.
В биохимических процессах энергия активации в 2-3 раза меньше, чем в неорганических. Вместе с тем Еа реакции с участием чужеродных веществ, ксенобиотиков, значительно превышает Еа обычных биохимических процессов. Этот факт является естественной биозащитой системы от влияния чужеродных веществ, т.е. естественные для организма реакции происходят в благоприятных условиях с низкой Еа, а для чужеродных реакций Еа высокая. Это является генным барьером, характеризующим одну из главных особенностей протекания биохимических процессов.
