
- •Билет № 1.
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •28)Углеводы. Классификация. Функции
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •24) Общее представление о липидах. Классификация липидов
- •1) Структурная
- •2) Запасная (энергетическая)
- •3) Защитная
- •4) Важный компонент пищевого сырья
- •2 Классификация липидов
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •16) Спирты и фенолы. Многотомные спирты.
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •27)Особенности растворов вмс: набухание и растворение
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •Полисахариды. Классификация. Функции
- •1. Клеточная локализация и функция
- •2. Строение миоглобина
- •3.Связывание гема с апомиоглобтом
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •17. Механизм действия буферных систем. Буферные системы крови
- •48)Вторичная структура белка
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •54)Классификация сложных белков
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25)Физико-химические свойства белков
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
16) Спирты и фенолы. Многотомные спирты.
Однотомные спирты получают
1) Гидратацией алкенов в кислой среде
2) Гидролизом галогенпроизводных
3) Восстановлением карбонильных соединений
4) Взаимодействием первичных админов с азотистой кислотой.
Однотомные фенолы могут быть получены взаимодействием ароматических сульфокислот с гидроксидами щелочных металлов.
Медико-биологическое значение и применение в народном хозяйстве.
Этиловый спирт в больших количествах вызывает состояние, близкое к наркозу, используется для приготовления настоек и обеззараживающего средства
Метиловый спирт - сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту
ФЕНОЛЫ применят как дезинфицирующие средства.
ФЕНОЛ или карболовая кислота - первый антисептик введенный в хирургию, может вызвать ожог кожи, широко используется для производства пластмасс, лекарственных средств.
Многотомные спирты
Этиленгликоль C2H6O2 - токсичная жидкость
Глицерин C3H8O3 - нетактичная вязкая бесцветная жидкость сладкого вкуса
Получение многотомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
17)Химические свойства спиртов
1)Горение:
C2H5OH + 3O2
![]() 2CO2
+3H2O + Q
2CO2
+3H2O + Q
2)Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na
+ 2H—O—H
2NaOH
+ H2![]()
2Na + 2R—O—H 2RONa + H2
3)Реакции с галогеноводородами:
C2H5OH
+ HBr
![]() C2H5Br
+ H2O
C2H5Br
+ H2O
4)Внутримолекулярная дегидратация (t > 140oС, образуются алкены):
C2H5OH
![]() C2H4
+ H2O
C2H4
+ H2O
5)Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры):
2C2H5OH C2H5OC2H5 + H2O
6)Окисление (мягкое, до альдегидов):
CH3CH2OH
+ CuO
![]() CH3—CHO
+ Cu + H2O
CH3—CHO
+ Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
Билет № 15
Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
Слабые кислоты и основания, в отличие от сильных (диссоциирующих практически полностью), распадаются на ионы в очень небольшой степени. Поэтому, например, в растворе слабой кислоты, можно выделить:
общую кислотность – концентрация растворённой кислоты, которую можно определить титрованием раствором щёлочи до полной нейтрализации;
активную кислотность – концентрации свободных протонов в растворе;
потенциальную или резервную кислотность, заключённоую в недиссоциированных молекулах кислоты.
Аналогично, слабые основания обладают тремя видами щёлочности.
Кроме того, слабые электролиты подчиняются закону разведения Оствальда, согласно которому степень диссоциации слабого электролита обратно пропорциональна корню квадратному из его концентрации:
α
=![]() ,
,
где К – константа диссоциации, С – молярная концентрация;
или прямо пропорциональна корню квадратному из его разведения:
α
=![]() , где
V – разведение
, где
V – разведение
Как вы помните из курса средней школы, реакция среды в растворах солей определяется их способностью к гидролизу. Так, соли, образованные слабой кислотой и сильным основанием, подвергаясь гидролизу по аниону, смещают равновесие диссоциации воды в сторону образования гидроксид-анионов. Среда становится щелочной. Например:
СН3СОО- + Na+ + Н2О → СН3СООН + Na+ + ОН-
Соли, образованные слабым основанием и сильной кислотой, подвергаясь гидролизу по катиону, смешает равновесие диссоциации воды в сторону образования протонов.
Например: NН4+ + Сl- + Н2О → NН4ОН + H+ + Cl-
Слабые кислоты: H2S, HF, CH3COOH, HNO2 (HnЭOm m-n<2)
Слабые
основания: NH4OH,
Me(OH)n (Me-![]() ,
кроме щелочных и щелочно земельных).
,
кроме щелочных и щелочно земельных).
Слабые кислоты и основания диссоциируют обратимо, равновесно, по ступеням, причём каждая последующая ступень протекает слабее предыдущей. Количественно диссоциацию слабых электролитов выражают с помощью α:
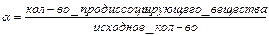
![]() -
степень электролитической диссоциации,
Kд - константа диссоциации (константа
равновесия). Константа диссоциации -
вид константы равновесия, которая
показывает склонность к диссоциации.
-
степень электролитической диссоциации,
Kд - константа диссоциации (константа
равновесия). Константа диссоциации -
вид константы равновесия, которая
показывает склонность к диссоциации.
<<1 и Kд<1
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Диссоциация слабой кислоты:
Диссоциация CH3COOH происходит в 1 стадию:
CH3COOH↔CH3COO-+Н+;
![]()
Дисоциация H3AsO4 протекает в 3 стадии:
1ст. H3AsO4↔H++ H2AsO4-
Кд1= C(H2AsO4-)×C(H+)/C(H3AsO4)=6×10-3
2ст. H2AsO4↔H++ HAsO4-2
Кд2=1×10-8
3ст. HAsO4↔H++ AsO4-3
Кg3=3×10-12
Кд1> Кд2 >Кд3>
α1> α2> α3
Диссоциация слабых оснований протекает аналогично
NH4OH↔NH4++OH-
Кд=1,7×10-5
Закон разбавления Оствальда.
Закон:
![]() -степень
электролитической диссоциации слабых
электролитов, увеличивается при
разбавлении раствора.
-степень
электролитической диссоциации слабых
электролитов, увеличивается при
разбавлении раствора.
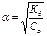 ;
;
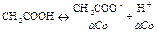
Со
– исходные вещества;
![]() –
продиссоциированные вещества
–
продиссоциированные вещества
Со-
![]() -
не диссоциированные вещества;
-
не диссоциированные вещества;
![]()
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
