
- •Билет № 1.
- •1. Основные понятия термодинамики. Термодинамические системы: определение, классификация
- •26) Сложные липиды – глицерофосфолипиды. Строение и функции фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина и фосфатидилинозитола.
- •23. Дисперсные системы, их классификации
- •Классификация дисперсных систем по агрегатному состоянию фаз
- •28)Углеводы. Классификация. Функции
- •3. Скорость химической реакции, факторы на нее влияющие
- •3. Температура. При повышении температуры на каждые 10°c скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
- •29)Моносахариды. Классификация. Хим. Свойства. Окислительно-восстановительные реакции.
- •I. Реакции по карбонильной группе
- •1. Окисление.
- •2. Восстановление.
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •36)Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биологическая роль
- •24) Общее представление о липидах. Классификация липидов
- •1) Структурная
- •2) Запасная (энергетическая)
- •3) Защитная
- •4) Важный компонент пищевого сырья
- •2 Классификация липидов
- •2.12. Химическое равновесие. Обратимые и необратимые реакции
- •2.13. Константа химического равновесия. Прогнозирование смещения химического равновесия
- •15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
- •27)Соединения стероидной природы: холестерин, желчные кислоты. Строение и роль.
- •8. Физико-химические свойства воды, определяющие её роль в природе и организме. Биологически важные свойства воды. Примеры водородных связей в биологических системах
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
- •18) Альдегиды, особенности строения карбонильный группы. Химические свойства альдегидов: образование
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •19) Классификация карбоновых кислот: по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •39)Нуклеотиды: строение, номенклатура, характер связи. Гидролиз нуклеотидов.
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •21) Вжк: классификация, номенклатура, структура и физические свойства. Заменимые и незаменимые вжк, витамин f, функции в организме.
- •13. Ионное произведение воды и водородный показатель. Методы определения pН растворов. Индикаторы и их свойства
- •22) Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме.
- •16) Спирты и фенолы. Многотомные спирты.
- •25) Простые липиды: триацилглицеролы (таг): состав, номенклатура, свойства. Гидролиз таг. Биологическая роль.
- •7. Катализ гомогенный и гетерогенный . Особенности ферментативного катализа
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •12. Коллоидно-осмотическое давление крови. Гипотеза Старлинга как один из механизмов возникновения отеков
- •27)Особенности растворов вмс: набухание и растворение
- •18. Типы окислительно-восстановительных (редокс) реакций в организме
- •19. Строение комплексных соединений. Классификация и номенклатура
- •1. По знаку заряда комплекса:
- •2. По принадлежности комплексного соединения к определенному классу соединений:
- •3. По природе лиганда:
- •4. По внутренней структуре комплекса:
- •25. Коллоидные растворы: строение коллоидной частицы, устойчивость коллоидных систем. Факторы, влияющие на устойчивость коллоидных систем. Коагуляция
- •Полисахариды. Классификация. Функции
- •1. Клеточная локализация и функция
- •2. Строение миоглобина
- •3.Связывание гема с апомиоглобтом
- •41) Первичная структура нуклеиновых кислот. Нуклеотидный состав днк и рнк.
- •22. Сорбция. Понятия адсорбции и абсорбции. Физическая и химическая адсорбция. Зависимость величины адсорбции от различных факторов
- •42)Понятие о вторичной структуре днк. Комплементарность нуклеиновых оснований. Водородные связи в комплементарных парах нуклеиновых оснований.
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •43)Аминокислоты номенклатура и классификация.
- •1. Моноаминомонокарбоновые.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •45)Химические свойства аминокислот.Биологически важные свойства аминокислот.
- •I. Общие свойства
- •II. Свойства карбоксильной группы (кислотность)
- •III. Свойства аминогруппы (основность)
- •1. С сильными кислотами → соли:
- •IV. Качественная реакция
- •1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
- •17. Механизм действия буферных систем. Буферные системы крови
- •48)Вторичная структура белка
- •16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
- •37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
- •10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
- •54)Классификация сложных белков
- •24. Грубодисперсные системы: классификация, применение в медицине
- •25)Физико-химические свойства белков
- •11. Биологическое значение осмотического давления. Поведение эритроцитов в растворах различной концентрации. Применение в медицине растворов различной осмолярности
- •49)Третичная и четвертичная структуры белков. Олигомерные белки.
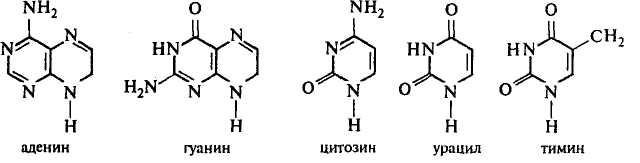
37)Азотистые основания пуриновые (аденин, гуанин) и пиримидиновые (тимин, урацил, цитозин). Строение, лактим-лактамная таутомерия.
Азо́тистые основа́ния — гетероциклические органические соединения, производные пиримидина и пурина, входящие в состав нуклеиновых кислот. Для сокращенного обозначения пользуются большими латинскими буквами. К азотистым основаниям относят аденин (A), гуанин (G), цитозин (C), которые входят в состав как ДНК, так и РНК. Тимин (T) входит в состав только ДНК, а урацил (U) встречается только в РНК.
Аденин и гуанин являются производными пурина, а цитозин, урацил и тимин — производными пиримидина.
Тимин, который присутствует только в ДНК, и урацил, который встречается только в РНК, обладают сходной химической структурой. Урацил отличается от тимина отсутствием метильной группы у 5-го атома углерода.
Азотистые основания, соединяясь ковалентной связью с 1' атомом рибозы или дезоксирибозы, образуют N-гликозиды, которые называют нуклеозиды. Нуклеозиды, в которых к 5'-гидроксильной группе сахара присоединены одна или несколько фосфатных групп, называются нуклеотидами. Эти соединения являются строительными блоками молекул нуклеиновых кислот — ДНК и РНК.
После образования молекулы нуклеиновой кислоты входящие в её состав азотистые основания могут вступать в различные химические реакции под действием ферментов а также факторов внешней среды.
Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности.
Антипараллельность цепей ДНК: противоположная направленность двух нитей двойной спирали ДНК; одна нить имеет направление от 5' к 3', другая - от 3' к 5'.
ЛАКТИМ-ЛАКТАМНАЯ ТАУТОМЕРИЯ
Этот вид таутомерии характерен для азотсодержащих гетероциклов с фрагментом N=C—ОН.
Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает.

Билет 28(НЕ БЫЛО)
10. Диффузия и осмос. Осмотическое давление. Закон Вант-Гоффа. Осмолярность биологических жидкостей. Осмотически-активные компоненты плазмы крови
Диффузия – это самопроизвольный процесс выравнивания концентрации растворённого вещества в объёме.
Она обусловлена 2 факторами: 1) наличием рыхлой структуры и пустот в растворителе (например, в 1 л воды её молекулами занято только примерно 370 мл), 2) тепловым движением частиц раствора.
Диффузия прекращается, если концентрация во всех частях раствора становится одинаковой. Скорость диффузии зависит от:
абсолютной температуры;
градиента концентрации;
вязкости растворителя;
размера диффундирующих частиц.
Скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя, размера и массы диффундирующих частиц. Поэтому растворы высокомолекулярных соединений (ВМС - белков, полисахаридов и др.) имеют очень низкий коэффициент диффузии.
Осмос – это односторонняя диффузия растворителя через полупроницаемую мембрану в сторону раствора с большей концентрацией растворённого вещества.
Осмос вызывается осмотическим давлением – силой, отнесённой к единице поверхности мембраны. Осмотическое давление имеется у любого раствора. Оно обусловлено стремлением частиц растворителя путём диффузии распределиться в максимально большем объёме.
Осмотическое давление растворов неэлектролитов пропорционально молярной концентрации (при постоянной температуре) и абсолютной температуре (при постоянной концентрации) раствора:
Росм = RCT,
где: R – универсальная газовая постоянная равная 8,31 Дж/(моль×К), C – молярная концентрация раствора, T – его абсолютная температура.
Закон Вант-Гоффа: учитывая, что С = n/V, получаем: РосмV = nRT. Для растворов электролитов вводится поправочный коэффициент i, показывающий во сколько раз истинная концентрация растворённых частиц, осмотическое давление, понижение температуры замерзания, повышение температуры кипения, понижение давления насыщенного пара растворителя больше, чем в эквивалентном растворе неэлектролита
Осмоляльность крови в значительной степени зависит от концентрации ионов натрия и хлора, в меньшей степени глюкозы и мочевины. В норме осмоляльность сыворотки крови 275-296 мосмоль/кг Н2О, осмоляльность мочи обусловлена мочевиной, ионами натрия, калия, аммония. Осмоляльность мочи колеблется значительно: от 50 до 1400 мосмоль/кг Н2О. При суточном диурезе около 1,5 л осмоляльность мочи здорового человека составляет 600-800 мосмоль/кг Н2О.
При патологических состояниях осмоляльность крови может как снижаться, так и повышаться. Гипоосмоляльность характеризует снижение концентрации натрия в крови при передозировке диуретиков, избыточной продукции антидиуретического гормона, при хронической сердечной недостаточности, циррозе печени с асцитом, глюкокортикоидной недостаточности. Гиперосмоляльность связана с гипернатриемией и наблюдается при сахарном диабете, недостаточности калия, гиперкальциемии, при декомпенсированном сахарном диабете (гипергликемической коме), при гиперальдостеронизме, избыточном введении кортикостероидов, при хронической почечной недостаточности наблюдается увеличение концентрации мочевины (каждые 5 ммоль/л мочевины увеличивают осмоляльность крови на 5 мосмоль/кг Н2О), параллельно происходит снижение концентрации натрия в крови, поэтому осмоляльность крови значительно не меняется.
