
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Биохимия в рисунках
.pdf
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
им. М.ГОРЬКОГО
ДОНЕЦК 2012
УДК 6612.015+577.1 (075.8) ББК 28.9
563
Утверждено Учёным Советом Донецкого национального медицинского университета им. М. Горького (протокол № от 25.05.2012)
А в т о р ы:
З.М.Скоробогатова, Ю.Д.Турсунова, И.И.Зинкович, А.Г.Матвиенко, И.В.Ниженковская, Е.В.Хомутов, Е.М.Бакурова, О.П.Шатова, Я.Г.Жебеленко, М.А.Сташкевич, С.А.Зуйков.
Биохимия в рисунках и схемах
Учебно-наглядное электронное пособие для студентов медицинских ВУЗов. – Донецьк, 2012. – 215 с.
Учебно-наглядное электронное пособие по биологической химии для студентов высших фармацевтических и медицинских учебных заведений III - IV уровней аккредитации подготовленный сотрудниками кафедры химии которые имеют значительный опыт преподавания биоорганической и биологической химии на фармацевтическом факультете Донецкого национального медицинского университета им. М.Горького. Пособие состоит из отдельных разделов, посвященных биохимии ферментов, витаминам, энергетическому обмену, общим путям катаболизма, обмену углеводов, липидов, белков, нуклеотидов, основам молекулярной биологии, а также биохимии гормонов, крови и печени. В соответствующих разделах учебного пособия предоставленная наглядная информация в виде цветных иллюстраций и схем о структуре, функциях, биохимических преобразованиях органических молекул в организме человека. Объясняются причины возможных нарушений метаболеских процессов в организме человека, а также показанные механизмы действия ряда лечебных средств, созданных на основании знаний о структурах биоорганических соединений и биохимии обмена веществ.
УДК 6612.015+577.1 (075.8) ББК 28.9
563

СОДЕРЖАНИЕ
РАЗДЕЛ 1. ЭНЗИМОЛОГИЯ.
I. Общая характеристика ферментов …………………………………………….5 II. Классификация ферментов ……………………………………………...…….5 III. Строение ферментов …………………………………………………….…....6 IV. Функциональная организация ферментов …………………………….…….6 V. Свойства ферментов …………………………………...………………………7 VI. Изоферменты ………………………………………………………………….9 VII. Полиферментные системы ……………………………………….………….9 VIII. Общие представления о катализе ………………………………………...10 IX. Механизм дейcтвия ферментов ………………………………………...…...11 X. Кинетика ферментативных реакций …………………………………...…... 12 XI. Регуляция активности ферментов……………………………………….…. 13 XII. Активация ферментов………………………………………………..…….. 13 XIII. Ингибирование ферментов ………………………………………………. 16 XIV. Применение ферментов в медицине …………………………………….. 18
РАЗДЕЛ 2. ВИТАМИНЫ……………………………………………………… 20
Классификация и номенклатура витаминов …………………………………. 20
РАЗДЕЛ 3. ВВЕДЕНИЕ В ОБМЕН ВЕЩЕСТВ. БИОЭНЕРГЕТИКА……31 I. Сопряжение эндергонических процессов с экзергоническими…………… 32 II. Стадии катаболизма биомолекул …………………………………………....34 III. Пути потребления кислорода в реакциях биологического окисления …..36 IV. Биологическое окисление…………………………………………………....37 V. Молекулярная организация цепи переноса электронов……………………39 VI. Механизм окислительного фосфорилирования………………………….. 40 VII. Общие пути катаболизма. Окислительное декарбоксилирование пирувата…………………………………………………………………………. 45 VIII. Цикл трикарбоновых кислот…………………………………………….. 46
РАЗДЕЛ 4. ОБМЕН УГЛЕВОДОВ…………………………………………… 50
I. Основные процессы в обмене углеводов …………………………………... 51
II. Переваривание углеводов …………………………………………………… 52
III. Синтез гликогена – гликогенез …………………………………………….. 53
IV. Распад гликогена в тканях ………………………………………………….. 55 V. Дихотомический распад глюкозы – непрямое окисление глюкозы.
Анаэробный гликолиз…………………………………………………………. 57

VI. Аэробный гликолиз и глюконеогенез. ………………………………………… 59 VII. Спиртовое брожение ………………………………………………………….. 63
VIII. Апотомический распад глюкозы – прямое окисление глюкозы(пентозо-
фосфатный путь) ……………………………………………………………………...64
IX. Взаимопревращения моносахаров –включение других гексоз в обмен глюкозы
………………………………………………………………………………67
РАЗДЕЛ 5. ОБМЕН ЛИПИДОВ ……………………………………………….. 69 I. Основные классы липидов……………………………………………………… 69
II. Переваривания липидов ……………………………………………………….. 70 III. Транспортные формы экзогенных липидов – хиломикроны ……………. 73 IV. Внутриклеточный липолиз…………………………………………………….. 74 V. Окисление высшх жирных кислот……………………………………………… 75 VI. Метаболизм кетоновых тел……………………………………………………. 77
VII. Синтез холестерина……………………………………………………………..78 VIII. Липопротеиды – транспортные формы липидов …………………………… 80 IX. Биосинтез липидов – липогенез ……………………………………………….. 82
X. Патология липидного обмена…………………………………………………… 87
РАЗДЕЛ 6. ОБМЕН ПРОСТЫХ БЕЛКОВ……………………………………… 89 I. Переваривание белков…………………………………………………………….. 91 II. Пути превращения аминокислот………………………………………………… 95 III. Обмен аммиака…………………………………………………………………... 98 IV. Пути обезвреживания аммиака……………………………………………….... 99 V. Декарбоксилирование аминокислот…………………………………………… 104 VI. Особенности обмена ароматических аминокислот в разных тканях……… . 106 VII. Обмен глицина и серина ……………………………………………………... 107
РАЗДЕЛ 7. ОБМЕН НУКЛЕОТИДОВ………………………………………… 109 I. Переваривание нуклеопротеинов ……………………………………………… 110 II. Биосинтез пуриновых нуклеотидов …………………………………………… 111 III. Распад пуриновых нуклеотидов ……………………………………………… 114 IV. Синтез пиримидиновых нуклеотидов ……………………………………….. 116
РАЗДЕЛ 8. ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ …………………… 119 I. Репликация (биосинтез ДНК) …………………………………………………... 121 II. Репарация ………………………………………………………………………. 129 III. Генные мутации ………………………………………………………………..130

IV. Молекулярные основы транскрипции …………………………………... 131 V. Трансляция - биосинтез белка …………………………………………... 138 VI. Посттрансляционная модификация белков …………………………….. 141 VII. Действие антибиотиков на биосинтез белка …………………………... 143
РАЗДЕЛ 9. ВВЕДЕНИЕ В ЭНДОКРИНОЛОГИЮ ……………………... 145 I. Классификация гормонов ………………………………………………….. 147 II. Механизмы взаимодействия гормонов с клеткой ……………………….. 148 III. Гормоны гипоталамо-гипофизарной системы ………………………….. 154 IV. Гормоны щитовидной железы …………………………………………... 160 V. Гормоны поджелудочной железы ………………………………………… 164 VI. Гормоны мозгового вещества надпочечников………………………….. 169 VII. Стероидные гормоны…………………………………………………….. 170 VIII. Гормональная регуляция обмена кальция……………………………... 180 IX. Эйкозаноиды ………………………………………………………………. 183 X. Изменение метаболизма в зависимости от режима питания …………... 185
РАЗДЕЛ 10. БИОХИМИЯ КРОВИ ……………………………………….. 188 I. Белки плазмы крови ………………………………………………………… 190 II. Небелковые азотистые вещества крови …………………………………... 193 III. Кислотно-основное состояние крови …………………………………… 194 IV. Буферные системы крови ………………………………………………… 195 V. Свертывающая система крови ……………………………………………. 198 VI. Фибринолиз …………………………………………………………….…. 201 VII. Противосвертывающая система ………………………………………… 202 VIII. Обмен хромопротеинов ………………………………………………… 203 IX. Биосинтез и распад гемоглобина ………………………………...……… 204
РАЗДЕЛ 11. БИОХИМИЯ ПЕЧЕНИ ………………………………….....…207 I. Регуляция углеводного обмена………………………………………………..…. 208 II. Регуляция липидного обмена…………………………………………………… 209 III. Регуляция белкового обмена…………………………………………… ……... 210
IV. Обезвреживающая функция печени…………………………………………… 211
РАЗДЕЛ 1. ЭНЗИМОЛОГИЯ
“Медицина говорит на языке энзимологии” (А. Браунштейн).
I. Общая характеристика ферментов.
Ферменты (энзимы) - это биологические катализаторы белковой природы, которые ускоряют химические реакции в клетке.
Ферменты, благодаря своей белковой природе, отличаются от других катализаторов тремя уникальными свойствами:
 высокой эффективностью;
высокой эффективностью;
 специфичностью действия;
специфичностью действия;
 способностью к регуляции.
способностью к регуляции.
Доказательства белковой природы ферментов:
денатурируют под действием химических и физических факторов;
при гидролизе распадаются на аминокислоты; обладают амфотерными свойствами; обладают электрофоретической подвижностью; не подвергаются диализу через
полупроницаемую мембрану; осаждаются высаливанием; имеют большую молекулярную массу; обладают высокой специфичностью;
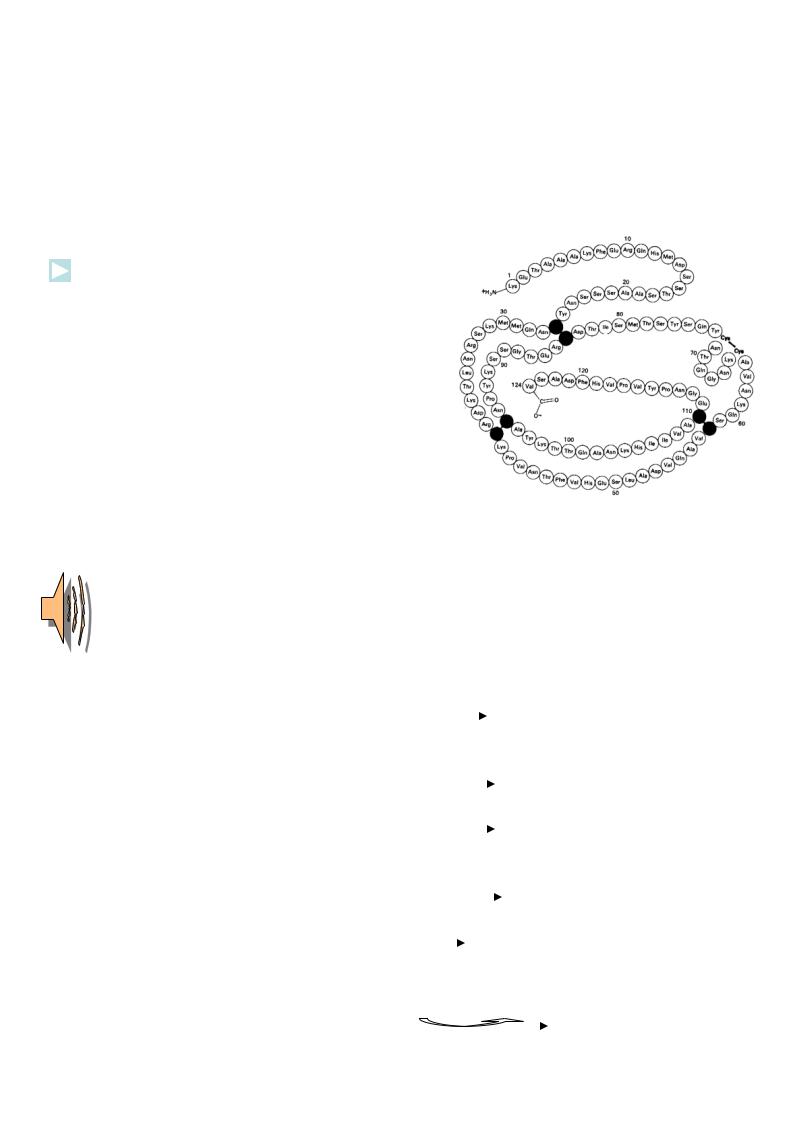
прямое доказательство - синтез белков-ферментов.
Первичная структура первого синтезированного белка фермента рибонуклеазы (1969г)
II.Классификация ферментов
Воснове классификации лежит тип катализируемой реакции
|
Класс |
Тип катализируемой реакции |
|
||||||||||
1. |
Оксидоредуктазы |
Окислительно-восстановительные реакции |
|
||||||||||
|
|
Авосст + Ввосст |
|
|
|
|
|
|
|
Аокис + Ввосст |
|
||
|
|
|
|
|
|
|
|
||||||
2. |
Трансферазы |
Перенос групп атомов от донорной молекулы к акцепторной |
|||||||||||
|
|
А-Х + В |
|
|
|
|
|
|
А + В-Х |
|
|||
|
|
|
|
|
|
|
|
||||||
3. |
Гидролазы |
Гидролиз связей |
|
|
|
|
|
|
|||||
|
|
А-В + Н2О |
|
|
|
|
|
А-Н + В-ОН |
|
||||
|
|
|
|
|
|
|
|||||||
4. |
Лиазы |
Разрыв связей между атомами С, О, N, S способом, отличным |
|||||||||||
|
|
от гидролиза или окисления |
|
|
|
|
|
|
|||||
|
|
А(Х)-В(Y) |
|
|
|
|
|
AX + BY |
|
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
5. |
Изомеразы |
Взаимопревращение изомеров |
|
||||||||||
|
|
А |
|
|
изоА |
|
|||||||
|
|
|
|
||||||||||
6. |
Лигазы |
Образование связей в реакции соединения двух молекул |
|
||||||||||
(синтетазы) |
(используется энергия АТФ) |
АДФ |
|
||||||||||
|
|
|
|
АТФ |
5 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А + В |
|
|
|
|
А-В |
||||||
|
|
|
|
|
|
|
|||||||
Вещество, на которое действует энзим (Е), называется субстрат (S), в результате ферментативной реакции образуется продукт (Р):
S |
|
Р |
Е |
III. Строение ферментов
ферменты
|
|
|
|
сложные |
|
||
простые |
|
|
|
|
|||
ферменты |
|
|
|
ферменты |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
апофермент |
|
|
кофактор |
||
|
|
|
|
|
|
|
|
• По структуре ферменты делятся на простые и сложные.
Простые ферменты представлены только полипептидными цепями и при гидролизе дают только аминокислоты (например, ферменты ЖКТ: пепсин, липаза, амилаза) .
Сложные ферменты кроме белковой части - апофермента, имеют также небелковый компонент - кофактор.
Если кофактор прочно связан с белковой частью и не отделяется при выделении
фермента, он называется простетической группой (например, ионы металлов), а весь сложный фермент - холоферментом.
Если кофактор легко диссоциирует, он называется коферментом (часто это производные витаминов). В сложных ферментах ни кофактор, ни белковая молекула в
отдельности каталитической активностью не обладают.
IV. Функциональная организация ферментов
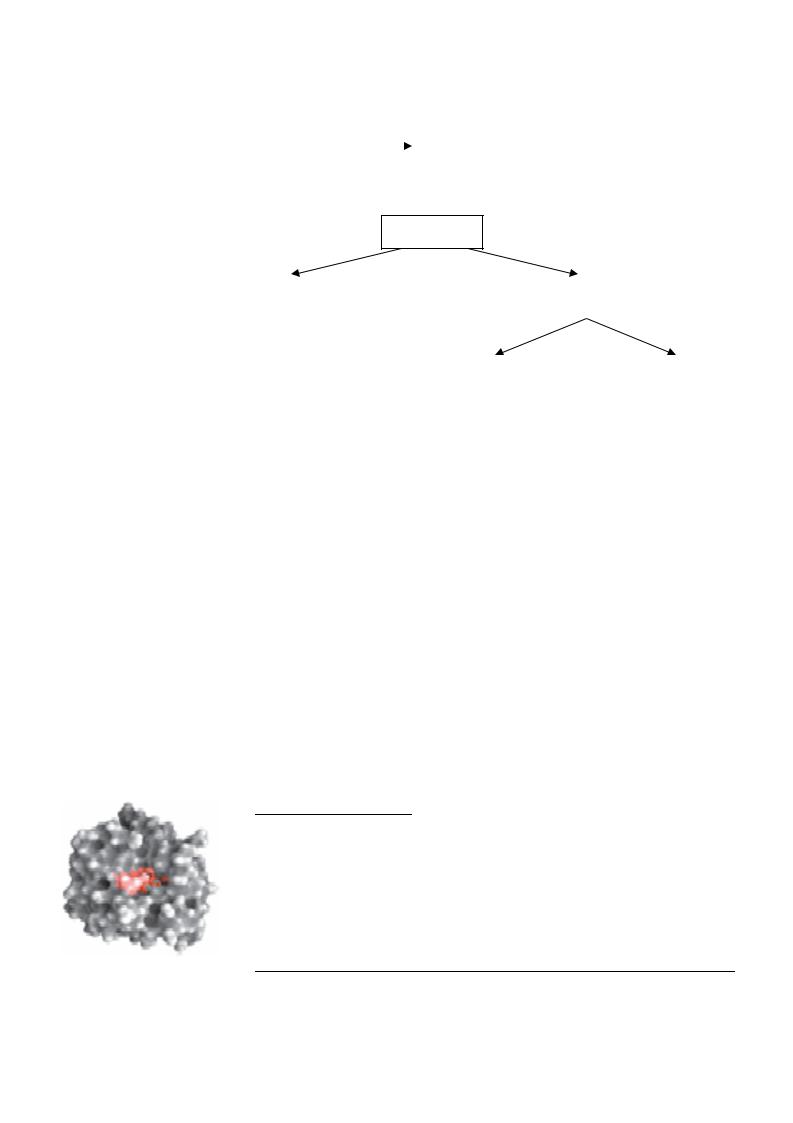
Белковая природа ферментов определяет их функциональные особенности. Прежде всего, это макромолекулы, как правило, значительно превышающие по размерам реагирующие вещества, т.е. субстраты. Поэтому ферменты работают не всей своей поверхностью, а только частью - активным центром.
Активный центр - это участок молекулы фермента
(уникальная комбинация аминокислотных остатков), непосредственно участвующая в катализе. Эти аминокислотные остатки находятся в разных местах полипептидной цепи, но при пространственной укладке (т.е. при образовании трехмерной третичной структуры) они сближаются, образуя активный центр. Таким образом, активный центр формируется на уровне третичной
структуры, поэтому денатурация ведет к потере каталитической активности.
6
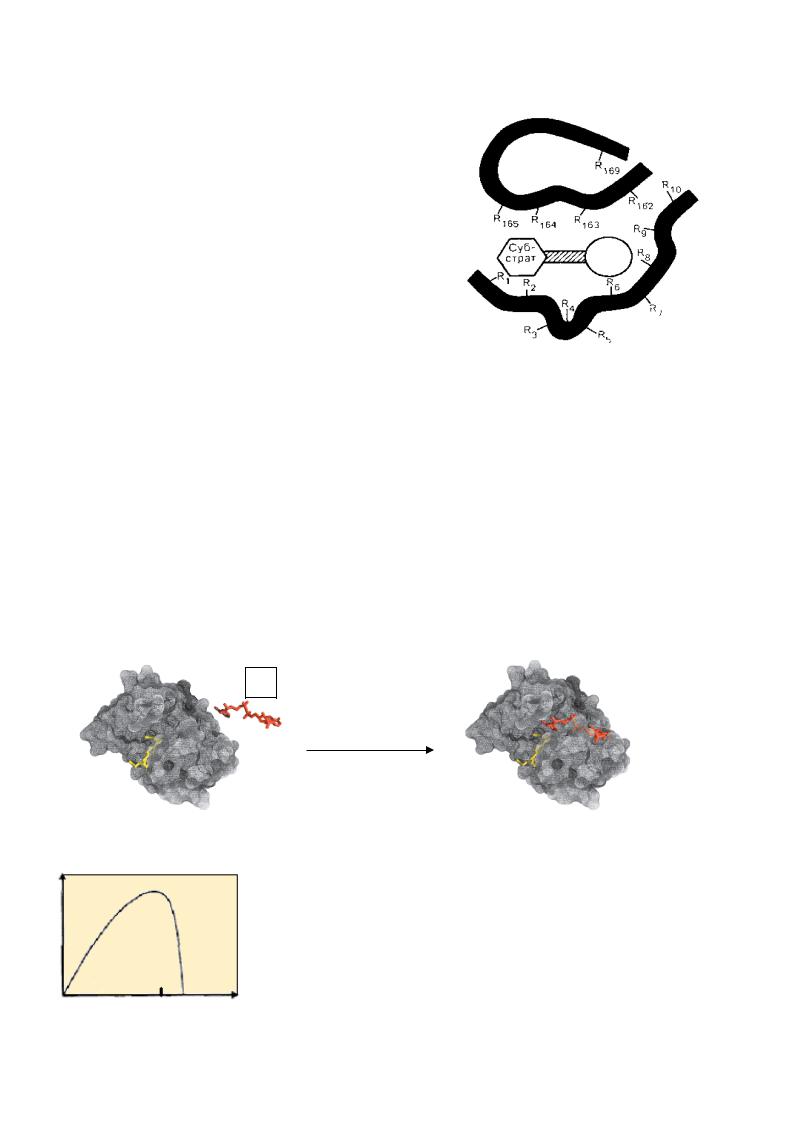
В активный центр входят следующие функциональные группы:
• СООН - дикарбоновых аминокислот и концевые;
• амино-группы лизина и концевые;
• фенольные группы тирозина;
• ОН-группы серина и треонина;
• SH-группы цистеина и дисульфидные
• мостики цистина;
• индольные — триптофана;
• гуанидиновые – аргинина;
• имидазольные – гистидина;
• тиоэфирные – метионина;
• гидрофобные - алифатических аминокислот и Если белок сложный, то его небелковый компонент входит в состав активного центра. В активном центре выделяют:
•контактный (якорный) участок - для узнавания и связывания субстрата, т.е. формирования фермент-субстратного комплекса;
• каталитический участок |
- непосредственно вступающий в химическое |
|
взаимодействие с субстратом. |
|
Э.Фишером, трактовала |
Первоначальная модель активного центра, предложенная |
||
взаимодействие фермента и субстрата, как “ ключ - замок”, т.е. образование ферментсубстратного комплекса (Е S) как жесткой структуры. Однако, в молекуле белка-
фермента |
жесткие участки чередуются с гибкими, поэтому предпочтительной |
является |
теория индуцированного соответветствия , предложенная позднее |
Д.Кошландом, подразумевающая гибкость каталитического центра. Субстрат индуцирует конформационные изменения активного центра фермента, подстраивая его
под себя. Фермент, в свою очередь, также может заставлять субстрат подстраиваться к себе.
S
|
|
|
|
|
|
ES |
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V. Свойства ферментов |
|
||
|
|
|
|
|
|
|||
1. Зависимость активности фермента от температуры |
(термолабильность) |
|||||||
v |
|
|
В некотором ограниченном интервале скорость реакции |
|||||
|
|
|
|
|
||||
|
|
|
|
|
повышается с ростом температуры., |
т.к. увеличивается |
||
|
|
|
|
|
кинетическая энергия молекул. При оптимальной |
|||
|
|
|
|
|
температуре (40◦С) скорость ферментативной реакции |
|||
|
|
|
|
|
максимальна. При дальнейшем повышении температуры |
|||
|
40 |
t° наступает денатурация фермента и реакция останавливается. |
||||||
|
|
|
|
|
|
|
|
7 |
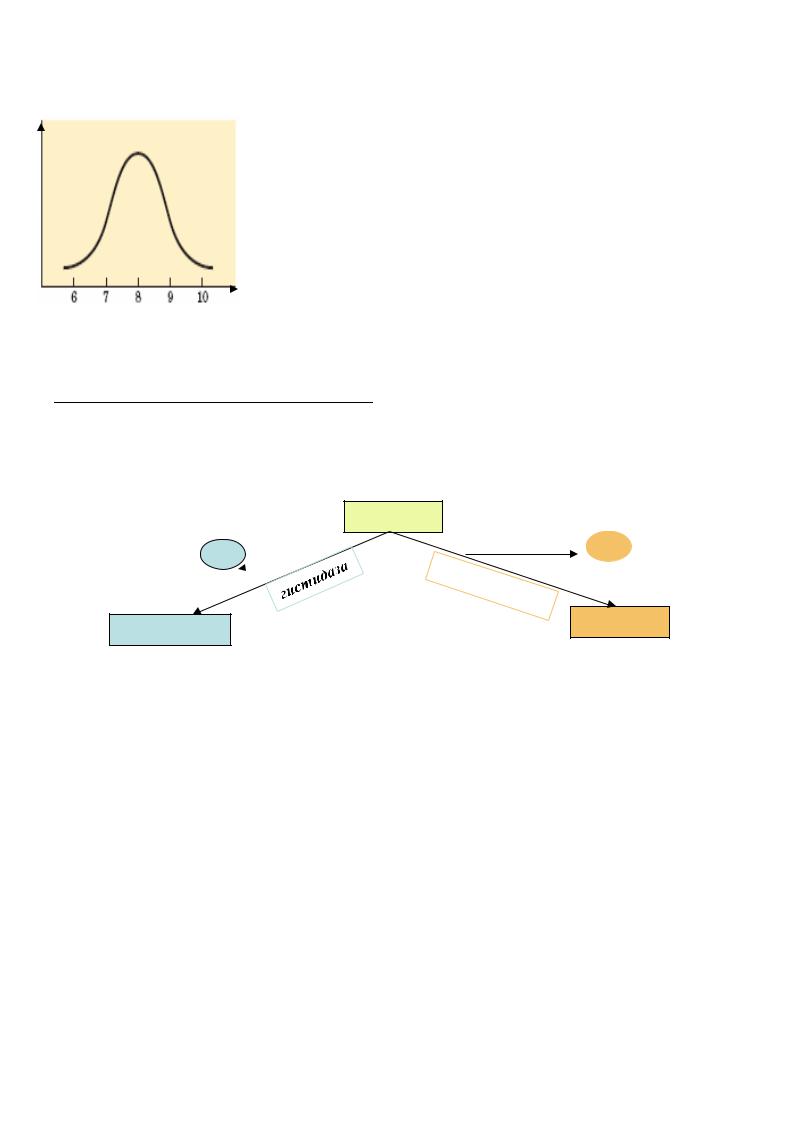
2. Влияние рH на скорость ферментативной реакции
|
v |
|
|
Эта зависимость определяется следующими факторами: |
|
|
|
|
|||
|
|
|
|
денатурацией фермента при очень высоких или очень |
|
|
|
|
|
||
|
|
|
|
низких рH; |
|
|
|
|
|
изменением величины заряда субстрата или фермента. |
|
|
|
|
|
Т.к. в активном центре фермента есть группы, способные к |
|
|
|
|
|
ионизации, то изменение рH влечет |
изменение степени |
|
|
|
|
ионизации функциональных групп, |
что может вызвать |
|
|
|
|
конформационные изменения в ферменте, и, следовательно, |
|
|
|
|
|
||
|
|
рН изменение его активности. |
|
||
3. Специфичность действия ферментов
А . Специфичность пути превращения . Функциональные группы активного центра способны химически превращать субстрат в определенный продукт, а не в
произвольный, например, один и тот же субстрат (аминокислота гистидин) может превращаться в разные продукты (кетокислота или амин), в зависимости от того,
какой действует фермент (гистидаза или декарбоксилаза):
NН3
кетокислота
гистидин
СО2
декарбоксилаза
гистамин
В.Субстратная специфичность |
- способность фермента связываться с |
|
|
|
|
определенным субстратом благодаря уникальной структуре активного центра. комплиментарной именно данному субстрату.
Различают следующие виды субстратной специфичности:
1.Абсолютная специфичность - способность фермента катализировать превращение только одного субстрата. например, аргиназа расщепляет только аргинин.
2.Относительная специфичность |
- способность фермента катализировать |
||
однотипные превращения группы субстратов, сходных по строению. Например, |
|||
липаза катализирует липолиз (гидролиз липидов), |
пепсин - протеолиз |
(гидролиз |
|
протеинов). |
|
|
|
3.Стереоспецифичность - способность фермента действовать |
только на |
||
определенный стереоизомер, напимер, оксидаза D-аминокислот не может действовать на их стереоизомеры (L-аминокислоты).
8
VI. Изоферменты
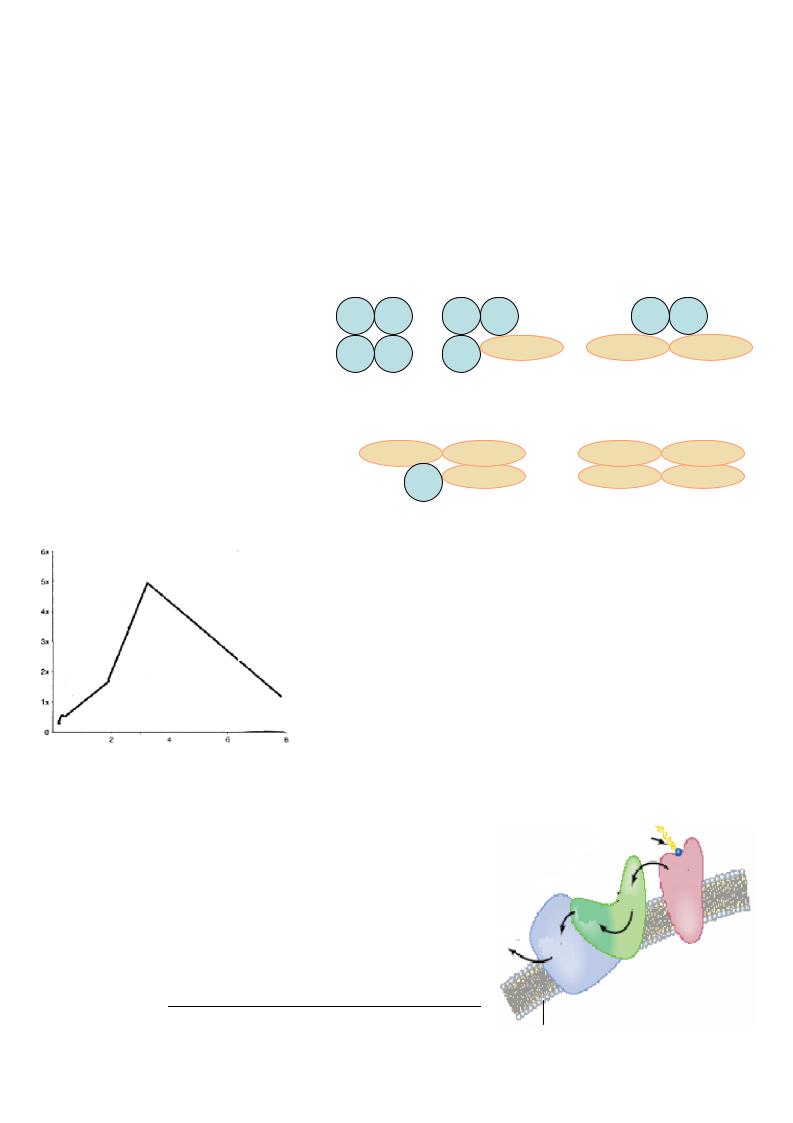
Множественные формы ферментов - это группа ферментных белков, отличающихся друг от друга по физико-химическим свойствам, сродству к субстрату, но катализирующих одну и ту же реакцию.
Среди множественных форм ферментов выделяют изоферменты, у которых физикохимические различия имеют генетическое происхождение. Содержание отдельных изоферментов в разных клетках и даже органах неодинаково, что позволяет их использовать для дифференциальной диагностики поражений указанных органов.
Например, |
|
Н |
Н |
Н |
Н |
Н |
Н |
|
лактатдегидрогеназа (ЛДГ) – |
Н |
Н |
Н |
М |
М |
М |
||
сложный фермент с |
||||||||
|
ЛДГ3 |
|||||||
четвертичной структурой, |
ЛДГ1 |
|
ЛДГ2 |
|||||
которая представлена четырьмя |
|
|
|
|
|
|
||
субъединицами двух типов: |
|
|
|
|
|
|
||
Н и М. |
Комбинация этих |
|
М |
|
М |
М |
М |
|
субъединиц |
(полипептидных |
|
Н |
|
М |
М |
М |
|
цепей) дает пять изоферментных |
|
ЛДГ4 |
ЛДГ5 |
|||||
|
|
|||||||
форм фермента. |
|
|
||||||
|
|
|
|
|
|
|||
|
|
Эти изоферменты имеют разную скорость движения |
||||||
|
|
в электрическом поле, поэтому их можно разделить с |
||||||
|
|
помощью электрофореза. |
|
|
||||
|
|
Они органоспецифичны, т.е. локализованы в разных |
||||||
|
ЛДГ1 |
органах: ЛДГ 1 – преимущественно в сердечной |
||||||
|
|
мышце, ЛДГ 5 |
– больше в скелетной мускулатуре; в |
|||||
|
|
крови их содержание в норме минимально. При |
||||||
|
|
деструкции органа |
( инфакте миокарда) |
|
||||
|
|
концентрация ЛДГ1 в крови резко возрастает. |
||||||
Сутки после инфаркта |
Такие ферменты или их изоферментные формы |
|||||||
называют индикаторными.
VII. Полиферментные системы
•Это надмолекулярные комплексы, в состав которых входят различные ферменты, последовательно
катализирующие разные стадии одного процесса. Эти системы работают по типу конвейера (продукт
первой реакции является субстратом для второго фермента и т.д.), в результате происходит выигрыш в расстоянии и во времени). Часто такие ферментные
ансамбли структурно связаны с какой-либо органеллой клетки или мембраной.
•Например , пируватдегидрогеназный комплекс, синтаза высших жирных кислот и др.
S
матрикс Е1
Е2
Е3
P Е4
мембрана |
9 |
