
Круглов Руководство по технической термодинамике 2012
.pdf
Приложение
РЕШЕНИЯ И ОТВЕТЫ
П.1. Основные понятия и законы термодинамики
П. 1.1. a. αp =1/ T ; βT =1 / p ; γV = 1/ T .
б. αp = T1 (1 + b / (V − b) − 2a(V − b) / (V 2RT))−1 ;
βT = (VRT / (V − b)2 − 2a / V 2)−1 ; γV = R / ( p(V − b)) .
Указание: при выводе выражения для αр воспользоваться уравнением состояния ТС в частных производных:
∂∂Vp T ∂∂VT p ∂∂Tp V = −1 .
П. 1.2. а) Ограничиваясь линейным приближением для вариации удельной теплоты δq и учитывая, что вариации независимых переменных можно приравнять их дифференциалам, получим:
|
∂q |
|
∂q |
|
∂q |
|
∂q |
dp . |
||
δq ≈ |
|
|
dT + |
|
dv ≈ |
|
|
dT + |
|
|
|
|
|||||||||
|
∂T v |
|
∂v T |
|
∂T p |
|
∂p T |
|
||
Из сопоставления полученного выражения с выражением, приведенным в условии задачи, следует, что
A = (∂q / ∂T)v ≡ cv – удельная теплоемкость при постоянном объеме;
B = (∂q / ∂v)T ≡ λv – скрытая теплота изотермического изменения объема;
C = (∂q / ∂T) p ≡ cp – удельная теплоемкость при постоянном давлении;
D = (∂q / ∂p)T ≡ λp – скрытая теплота изотермического изменения давления.
121

б) Используя правую часть полученного в п. (а) выражения и выражая производные через термодинамические коэффициенты
cv, cp, λv, λp , получим
c dT |
= c |
p |
dT + λpdp |
v |
при v = const; |
v v |
|
v |
|
cpdTp = cvdTp + λvdvp при p = const.
Отсюда непосредственно следуют необходимые соотношения.
П.1.3. Полученные в задаче 1.3 выражения для элементарного приращения теплоты в случае адиабатических условий имеют вид
c dT + λvdv |
S |
= 0 |
и |
c |
p |
dT + λpdp |
S |
= 0 |
, |
v S |
|
|
|
S |
|
|
где индекс S обозначает адиабатичность условий. Отсюда следует, что
|
∂v |
|
c |
λp |
|
|||
|
|
|
= |
v |
|
|
v . |
(П.1.1) |
|
|
λ |
||||||
|
∂p S |
|
cp |
|
|
|||
Из соотношения, полученного в п. (б) задачи 1.2, следует, что
|
∂v |
|
λp |
|
||
|
|
|
= |
λ |
v . |
(П.1.2) |
|
||||||
|
∂p T |
|
|
|
||
Выразив левые части выражений (П.1.1) и (П.1.2) через термодинамические коэффициенты βS и βT и поделив их друг на друга, получим необходимое соотношение.
П.1.4. а) Используя выражение, приведенное в условиях задачи 1.3 (п. (б)), и уравнение состояния дли одного моля идеального газа pV = RТ, нетрудно получить λV = p; λp = −V.
б) Взяв за исходное то же выражение, что и при решении п. (а) и определив из уравнении состояния Ван-дер-Ваальса (p = RT/(V – b) – a/V2) производные ( ∂p/ ∂T)V и ( ∂V/ ∂T)p, нетрудно получить
λp ≈ −(V − b)(1 + 2a / (RTV)) ;
λV ≈ 2a(VV 3− b) − VRT− b 1 + RTV2a .
122
П.1.5. С учетом определения термодинамического коэффициента сжимаемости, приведенного в задаче 1.1, и выражения, связывающего изотермический и адиабатический коэффициенты сжимаемости (см. условия задачи 1.4), модуль всестороннего сжатия можно представить в виде
KS = 1/βS = kβT, где
Тогда для скорости звука имеем:
k = Cp/CV.
wзв = vk / βT . Подставляя в
последнюю формулу значения изотермических коэффициентов сжимаемости для идеального газа и газа Ван-дер-Ваальса, полученные в задаче 1.2, будем окончательно иметь:
а) идеальный газ wзв = (RTk/M) ;
б) газ Ван-дер-Ваальса wзв = kV (VRT /(V − b)2 − 2a / V −2)/ M . M и V – молекулярная масса и молекулярный объем газа.
П.1.6. При отсутствии сил молекулярного притяжения уравнение Ван-дер-Ваальса принимает вид p = RT/(V – b) и тогда z = V/(V – b).
Сравнивая полученное значение z со значением, заданным в условиях задачи, получим
b = |
|
4 − 2η− η2 /2 |
|
πd 3 |
. |
|
+ η+ η2 −3η3/2 |
6 |
|||
1 |
|
|
|||
При η → 0 коэффициент b = 4πd3/6. С увеличением концентрации частиц величина коэффициента b уменьшается.
П.1.7.Система уравнений, описывающая движение двух связанных осцилляторов, имеет вид:
mx |
+ mω2x |
|
= γ x |
; |
|
|
1 |
0 1 |
2 |
|
|
|
|
+ mω2x |
|
= γ x , |
|
mx |
2 |
||||
|
2 |
0 |
1 |
||
где m – масса молекулы; |
ω0 – собственная частота колебания; х1, |
||||
х2 – отклонения молекул из положения равновесия; γ – силовая константа взаимодействия молекул, которая в случае характерного для газа Ван-дер-Ваальса диполь-дипольного взаимодействия рав-
на γ = е2/(4πε0r3). Принимая, что решение имеет вид хк = аkеiωt, и
123
подставляя его в написанную выше систему уравнений, получим характеристическое уравнение
(ω02 − ω2 )2 = γ2 /m2.
Отсюда частоты обобщенных колебаний равны
ω1,2 = ω02 ± γ / m.
Представляя энергию взаимодействия в виде разности энергий взаимодействующих и невзаимодействующих осцилляторов, получим
|
=ω |
=ω |
|
|
=ω |
= |
|
( ω02 + γ / m + ω02 − γ / m − 2ω0 )≈ |
||||||||
u = |
2 1 + |
2 |
2 |
− 2 |
|
2 |
0 = |
|
|
|||||||
|
2 |
|||||||||||||||
|
|
|
|
≈ − |
1 |
|
=γ2 |
|
= − |
C |
; C = |
= γ2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
. |
||||
|
|
|
|
8 m2ω30 |
|
v6 |
|
|||||||||
|
|
|
|
|
|
|
|
|
2 ω30 |
|||||||
Здесь С – постоянная молекулярного взаимодействия.
dΣ
p, V
Рис. П.1.1
П.1.8. Работа сил давления, приложенных dl к элементарной площадке dΣ по перемеще-
нию ее на расстояние dl, равна (рис. П.1.1):
δL = pdΣdl .
Интегрируя последнее выражение по всей поверхности Σ, ограничивающей объем ТС V, получим
δL = ∫ p dΣdl = pΣdl = pdV.
Σ
П.1.9. Указание: использовать для δQ выражения, полученные в задаче 1.3:
δQ = CvdT + λvdV =CpdT + λpdp .
П.1.10. В политропном процессе
δQ = CdT = CvdT + λvdV =CpdT + λpdp ,
где С = const. Отсюда следует, что
124

λp |
dp |
= |
C −Cp |
|
= n |
= const . |
|
λv |
dV |
C −C |
|||||
|
|
|
|||||
|
|
|
v |
|
|
||
Кроме того, для идеального газа λv = p, |
λp = −V. Тогда |
||||||
|
|
dp |
+ n dV |
= 0 , |
|||
|
|
dp |
V |
|
|
||
и отсюда следует pV n = const (уравнение политропного процесса для идеального газа). Теплоемкость в политропном процессе
C = |
Cp −nCv |
= Cv |
k |
−n |
, |
||
1 |
−n |
1 |
− n |
||||
|
|
|
|||||
где k = Cp/Cv.
Из последнего выражения видно, что если показатель политропы изменяется в пределах от 1 до k, то теплоемкость отрицательна. Для изобарического процесса С = Cv и n → ∞; для изотермического процесса n = 1 и С → ∞; для адиабатического процесса n = k и
С = 0.
П.1.11. В случае идеального газа pV = RT, U = U0(T), и тогда имеем
∫ δQ = ∫ dU + pdV = ∫ dU 0(T) + ∫ dV = v T v T v T Rv V 0 ,
так как каждое из слагаемых по отдельности равно нулю (вследствие равенства нулю интеграла от функции одной переменной по замкнутому контуру).
В случае газа Ван-дер-Ваальса
и тогда
П.1.12.
p = |
RT |
− |
a |
, |
U =U 0(T) − |
a |
, |
|
V −b |
V 2 |
V |
||||||
|
|
|
|
|
∫ δQ = ∫ dU 0(T) + ∫ dV =
v T v T RvV −b 0 .
В общем случае соотношение v∫δQ / T = 0 выполняется
при условии СV = СV(T), λV= A(V)T или Сp = Сp(T), λp= B(p)T. Доказательство аналогично доказательству, приведенному в задаче 1.11.
125

П.1.13. а) Для нахождения разности Сp – СV можно воспользоваться соотношениями, приведенными в условии задачи 1.3, и первым началом термодинамики:
C |
p |
−C = λV (∂V / ∂T) |
p |
= ((∂U / ∂V) |
T |
+ p)(∂V / ∂T) |
p |
. (П.1.3) |
|
V |
|
|
|
Для моля идеального газа pV = RT, U = U0(T). Отсюда получим, используя выражение (П.1.3):
Cp −CV = pR/ p = R .
Для моля газа Ван-дер-Ваальса
p = |
RT |
− |
a |
, |
U =U 0(T) − |
a |
. |
V −b |
V 2 |
|
|||||
|
|
|
|
V |
|||
Отсюда находим, используя выражение (П.1.3):
Cp −CV = R (1−2a(V −b)2 / RTV 3)−1 .
б) Воспользовавшись основным уравнением термодинамики и выражением для элементарного количества теплоты, приведенным в задаче 1.3:
TdS =δQ ; δQ = CV dT +λV dV,
нетрудно получить
S = S(T, V) − S(T 0 , V0) = T∫ CVTdT + V∫ λVTdV .
T0 V0
Для идеального газа СV = const, λV = p. Откуда находим
S = CV ln(T /T0) + R ln(V / V0) = R ln ((T /T0)CV /R(V /V0)).
Для газа Ван-дер-Ваальса
λV = RT / (V −b), CV ≠ f (T)
и, следовательно,
S = R ln ((T / T0)CV /R(V −b) / (V0 −b)).
в) Для адиабатического процесса S = 0, и тогда из п. (б) следует, что для идеального газа уравнение адиабаты имеет вид:
T (CV /R)V = const или T (1/k−1)V = const ,
где k = Cp/CV. Переходя с помощью уравнения состояния к координатам p, V, получим: pVk = const.
126
Аналогичным образом можно получить для газа Ван-дер- Ваальса
T |
(C /R) |
(V −b) = const |
|
a |
|
k |
|
|
V |
или p + |
|
|
(V −b) |
|
= const . |
||
|
|
|||||||
|
|
|
|
V 2 |
|
|
|
|
П.1.14. Воспользовавшись приближенной формулой Стирлинга ln(N!) ≈ NlnN – N, представим энтропию в виде
S = − kБN( p1 ln p1 + p2 ln p2) .
Учитывая, что p1 + p2 = 1, выразим S через u и ε1, ε2:
S = − |
kБN |
|
(ε |
|
−u) ln |
|
ε2 |
−u |
+ (u − ε ) ln |
u |
− ε1 |
|
, |
||
|
|
2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
1 |
− ε1 |
|
|||||||
|
ε2 − ε1 |
|
|
|
ε2 |
− ε1 |
|
ε2 |
|
|
|||||
где u = U/N – средняя внутренняя энергия, приходящаяся на одну частицу.
При V = const сохраняются неизменными энергетические уровни ε1 и ε2. Температура определяется соотношением:
T |
= |
∂U |
= N |
|
∂u |
|
= |
ε2 −ε1 (ln( p / p |
2 |
))−1 . |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
∂S V |
|
|
∂S ε , ε |
2 |
kБ |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
Отсюда |
следует, |
что |
|
энтропия |
достигает максимума при |
|||||
p1 = p2 = 1/2, |
при этом T → ±∞. |
В |
|
|
|
|||||
крайних состояниях (при p1 = 0
или p2 = 0) T = 0.
Теплоемкость при постоянном объеме в расчете на одну частицу:
|
∂u |
|
(ε2 |
−u)(u −ε1) |
|
|
cv = |
|
|
= kБ |
|
|
. |
|
|
ε2 −ε1 |
||||
|
∂T V |
|
|
|
||
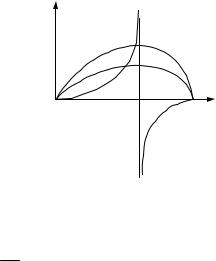
Качественное изменение S, T и cv в зависимости от энергии системы представлено на рис. П.1.2.
S, T, CV T
S
CV U
0
ε1 |
ε2 |
Рис. П.1.2 T
П.1.15. Воспользовавшись для Cp – CV соотношением, приведенным в условиях задачи 1.3, и учитывая, что λV = T(∂p/∂T)V, получим:
C p −Cv = λV ∂∂VT p = T ∂∂Tp V ∂∂VT p = pVTγV αp .
127

Выразив γV через αp и βT c помощью уравнения состояния газоподобной системы в термодинамических коэффициентах αp = pβTγV, приходим к выражению
Cp −Cv =VTα2p / βT .
П.1.16. Выражая с помощью основного уравнения равновесной термодинамики термодинамические коэффициенты αp, βT, γV, λV, λp, CV и Cp, через частные производные энтропии получим:
|
|
|
1 |
|
∂S |
|
|
|
|
∂S |
|
|
∂S |
|
|
|
|
|
1 |
|
∂S |
|
||||||
|
αp = − |
|
|
|
; |
βT = |
|
|
|
|
|
V |
|
|
; |
γV |
= |
|
|
|
|
|
; |
|||||
|
V |
∂V |
T |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
∂p T |
|
|
|
|
|
∂p |
T |
|
|
|
|
p |
∂V T |
|
||||||||||
|
∂S |
|
|
|
= T |
|
∂S |
|
|
|
|
|
|
∂S |
|
|
|
|
∂S |
|
||||||||
λV |
= T |
|
|
|
; λp |
|
|
|
|
; |
|
CV |
= |
T |
|
|
|
; |
C p = T |
|
. |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
∂V |
T |
|
|
|
∂p T |
|
|
|
|
|
|
∂T V |
|
|
|
|
∂T |
p |
|||||||||
Применяя к полученным соотношениям третье начало термодинамики, нетрудно убедится, что все они, кроме βT, стремятся к нулю при Т → ∞.
П.1.17. Для парамагнетика основное уравнение термодинамики имеет вид
TdS = dU − HdM , |
(П.1.4) |
где М – величина вектора намагниченности, а H − напряженность магнитного поля.
В соответствии с законом Кюри M = χH = cH/T (c = const). Из
соотношения (П.1.4) следует, что |
(∂S /∂H )T = (∂M /∂T )H . Или с |
|||||
учетом закона Кюри: |
∂S |
|
cH |
|
|
|
|
= − |
→ − ∞ при T |
→ 0, |
|||
|
|
|
T 2 |
|||
|
||||||
|
∂H T |
|
|
|
||
что противоречит третьему началу. |
|
|
||||
П.1.18. Из уравнения |
первого начала |
термодинамики |
||||
(dQ = dU + pdV) следует, что при V = const |
|
|||||
2 |
|
|
2 |
|
|
|
∫(dQ)V = ∫dU =U2 −U1 . |
|
|||||
1 |
|
|
1 |
|
|
|
Аналогичным образом при p = const имеем
128
2 2
∫(dQ)p = ∫d(U + pV) = H2 − H1 ,
1 1
где H = U + pV – энтальпия, являющаяся так же, как и внутренняя энергия, функцией состояния.
П.1.19. Из основного уравнения термодинамики следует, что
|
1 |
|
∂U |
|
1 |
∂U |
|
||
dS = |
|
|
|
dT + |
|
|
|
+ p dV . |
|
T |
T |
||||||||
|
|
∂T V |
|
|
∂V T |
|
|||
Поскольку энтропия является функцией состояния и обладает свойством потенциальности, то выполняются следующие условия:
|
∂S |
1 |
∂U |
|
|
|
∂S |
|
1 |
|
∂U |
|
|
|
|
∂2S |
|
∂2S |
|
|||||||||||||
|
|
= |
|
|
|
|
|
|
|
; |
|
|
|
|
= |
|
|
|
|
|
+ p ; |
|
|
= |
|
; |
||||||
|
|
|
|
|
|
T |
|
∂T∂V |
∂V∂T |
|||||||||||||||||||||||
|
∂T V |
T |
∂T V |
|
|
∂V T |
|
|
∂V T |
|
|
|
|
|
||||||||||||||||||
и, следовательно, имеет место соотношение |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
∂ 1 |
|
∂U |
|
= |
∂ 1 |
∂U |
|
+ |
|
p |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
∂T |
|
|
|
T |
|
|
|
||||||||||||||||
|
|
|
|
∂V T |
|
∂T V |
T |
T |
∂V |
T |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
∂U |
|
|
|
|
|
|
∂p |
|
|
|
|
|
|
|
|
|
||||
|
Отсюда имеем |
|
|
|
+ p = T |
|
|
|
, |
а для идеального газа |
||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
∂V T |
|
|
|
|
|
|
∂T V |
|
|
|
|
|
|
|
|
|
||||
lV = p. С учетом условия pV = f (T) получим уравнение для нахождения функции f(T):
T d f (T ) − f (T ) = 0 . dT
Интегрируя это уравнение, имеем f (T) = RT. Постоянная интегрирования R не зависит от температуры и объема и для одного моля идеального газа равна универсальной газовой постоянной:
R = 8,314 Дж/(моль К).
|
П.1.20. При решении задачи 1.19 показано, что dS = |
CVdT |
+ |
||
|
T |
||||
|
∂p |
|
|
||
|
dV . В соответствии с определением полного дифферен- |
||||
+ |
|
|
|||
|
|||||
|
∂T V |
|
|
|
|
циала имеем
129
|
∂S |
|
|
C |
|
|
|
∂S |
|
|
|
∂p |
|
|
∂2S |
|
|
∂2S |
|
|
|
|
|
|
|||||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
= |
|
; |
|
|
|
|
|
= |
|
|
|
; |
|
|
|
= |
|
|
|
|
. |
|
|
|||
|
T |
|
|
|
|
|
∂T∂V |
∂V∂T |
|
|
|||||||||||||||||||
∂T |
V |
|
|
|
∂V T |
∂T |
V |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
∂ |
|
C |
|
|
|
|
∂ |
|
∂p |
|
|
|
∂C |
|
|
|
∂2 p |
||||||||
|
|
|
|
|
V |
= |
|
|
|
|
V |
|
= T |
|
|
|
. |
||||||||||||
Отсюда следует |
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|||||||||||
∂V |
|
|
|
|
|
|
|
|
|
|
2 |
||||||||||||||||||
|
|
|
|
|
T T |
|
|
∂T ∂T |
V |
|
∂V |
T |
|
∂T |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
Если p является линейной функцией Т (как, например, для идеаль-
ного газа или газа Ван-дер-Ваальса), то ∂∂CVV T = 0 .
2. Методы термодинамического анализа
П.2.1.а) dH = TdS + Vdp + ∑μidNi ;
i
dF = − SdT − pdV + ∑μidNi ;
i
dФ = − SdT + Vdp + ∑μidNi .
i
б) Выражения для элементарных приращений этих функций d(pV) и d(TS):
d( pV )
d(TS)
=∂( pV )
∂V
=∂(TS)
∂S
|
|
∂( pV ) |
dp ; |
|
|
dV + |
∂p |
|
|
p |
|
V |
||
|
∂(TS) |
dT . |
||
|
dS + |
∂T |
|
|
T |
|
S |
|
|
Они действительно являются полными дифференциалами (а сами функции потенциалами), так как их смешанные вторые производные равны между собой:
∂2( pV ) |
=1 |
= |
∂2(pV ) |
; |
∂2 |
(TS) |
=1 = |
∂2 |
(TS) |
. |
|
∂V ∂p |
∂p∂V |
∂S∂T |
∂T∂S |
||||||||
|
|
|
|
|
|||||||
в) Соотношения Максвелла можно получить, приравнивая друг к другу смешанные производные для каждой потенциальной функции.
г) Рассматривая химический потенциал как функцию интенсивных переменных p и T:
130
