
- •Важнейшие классы и номенклатура неорганических веществ.
- •Развитие учения о строении атома.
- •Строение электронных оболочек атомов.
- •Периодический закон и периодическая система элементов.
- •Периодичность свойств химических элементов.
- •Природа химической связи. Основные типы химической связи.
- •Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •Свойства ковалентной связи. Степень окисления атома.
- •Геометрия структур с ковалентным типом связей.
- •Основы метода молекулярных орбиталей.
- •Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •Кристаллическое, жидкое и аморфное состояние веществ.
- •Скорость химических реакций. Константа скорости и ее физический смысл.
- •Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •Катализ. Влияние катализатора на скорость химической реакции.
- •Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •Растворение как физико - химический процесс.
- •Растворимость веществ. Состав растворов.
- •Основные положения теории электролитической диссоциации.
- •Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •Гидролиз солей. Количественные характеристики гидролиза.
Катализ. Влияние катализатора на скорость химической реакции.
Ката́лиз (греч. κατάλυσις от καταλύειν «разрушение») — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Так как катализаторы не входят в число исходных веществ и продуктов реакции, то они не влияют на тепловой эффект реакции, на вероятность само-произвольного протекания реакции, на константу химического равновесия. Катализатор в одинаковой степени увеличивает скорость как пря-мой, так и обратной реакции, поэтому лишь уменьшает время достижения состояния химического равновесия, но не изменяет величину константы равно-весия, не способствует смещению равновесия в какую-либо сторону.
Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
При́нцип Ле Шателье́ — Бра́уна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные в сторону противодействия изменениям.
Химическое равновесие — состояние химического, обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях. Необратимой называется реакция, которая идет практически до конца в одном направлении. Условия необратимости реакции – образование осадка, газа или слабого электролита.
Растворение как физико - химический процесс.
Вы уже знакомы со смесями веществ — растворами и механическими смесями, их классификацией (рис. 50). Напомним, что механические смеси образуются в результате простого перемешивания веществ без образования ими химической связи или других химических изменений. Каждый компонент такой механической (гетерогенной) смеси сохраняет свой состав и свойства.
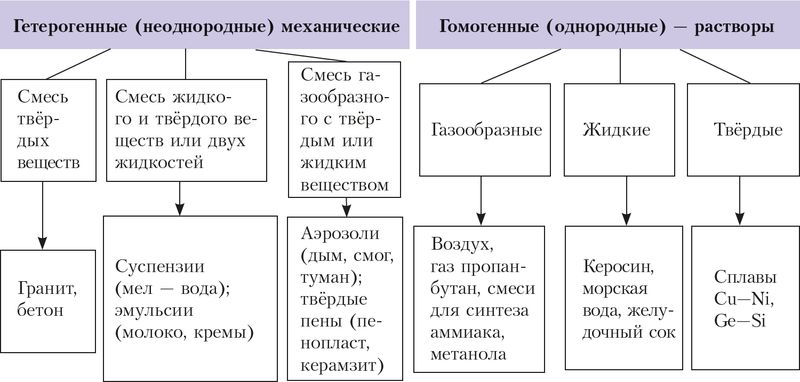 Рис.
50. Классификация смесей
Рис.
50. Классификация смесей
Также вам уже известны растворы — гомогенные устойчивые системы переменного состава, состоящие из нескольких компонентов. Различают жидкие (водные и неводные), газообразные и твёрдые растворы. Некоторые их примеры приведены на рисунке 50. Мы будем рассматривать преимущественно водные растворы.
В отличие от механических смесей растворы однородны, то есть отсутствуют границы раздела фаз. Кроме того, растворы устойчивы, так как при неизменных условиях (концентрация растворённого вещества, температура, давление) они бесконечно долго остаются гомогенными системами.
Физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя с образованием гомогенной устойчивой системы переменного состава, называют растворением.
Химическая сторона процесса растворения заключается в разрушении связей между частицами растворяемого вещества и их взаимодействии с молекулами растворителя. При растворении протекают физические процессы взаимной диффузии частиц растворяемого вещества и молекул воды.
