- •Важнейшие классы и номенклатура неорганических веществ.
- •Развитие учения о строении атома.
- •Строение электронных оболочек атомов.
- •Периодический закон и периодическая система элементов.
- •Периодичность свойств химических элементов.
- •Природа химической связи. Основные типы химической связи.
- •Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •Свойства ковалентной связи. Степень окисления атома.
- •Геометрия структур с ковалентным типом связей.
- •Основы метода молекулярных орбиталей.
- •Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •Кристаллическое, жидкое и аморфное состояние веществ.
- •Скорость химических реакций. Константа скорости и ее физический смысл.
- •Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •Катализ. Влияние катализатора на скорость химической реакции.
- •Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •Растворение как физико - химический процесс.
- •Растворимость веществ. Состав растворов.
- •Основные положения теории электролитической диссоциации.
- •Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •Гидролиз солей. Количественные характеристики гидролиза.
Гидролиз солей. Количественные характеристики гидролиза.
Гидролиз солей — взаимодействие ионов соли с водой, в результате которого образуются малодиссоциируемые соединения (ионы или молекулы) и изменяется реакция среды.
Понятие о реакциях гидролиза
В водном растворе частицы растворённого вещества взаимодействуют с молекулами воды. Такое взаимодействие нередко приводит к реакции гидролиза (от др.-греч. hydro — вода + lysis — разложение).
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений.
Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров (в том числе жиров) и др. существенно различается. С гидролизом галогеналканов, белков (полипептидов), ди- и полисахаридов (на примере сахарозы, крахмала и целлюлозы), а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей.
Гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Среда в водных растворах гидролизующихся солей может быть кислой (pH < 7,0) или щелочной (pH > 7,0) потому, что в растворе соли в результате гидролиза появляется избыток ионов Н+ или ОН–.
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации.
Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (КГ) и степени гидролиза (h).
Константа гидролиза (KГ) - это отношение ионного произведения воды (Kw) к константе диссоциации слабого основания или слабой кислоты, образующих данную соль.
Частное от деления одной постоянной величины на другую есть также величина постоянная. Поэтому KГ - величина постоянная, которая характеризует способность соли подвергаться гидролизу. Значение KГ зависит от природы соли, температуры и не зависит от концентрации раствора.
1. Для солей типаNH4Cl:
|
(1) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2. Для солей типаCH3COONa:
|
(2) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу соли, образованные этой кислотой.
3. Для солей типаNH4CN:
|
(3) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
4. Для солей типаNa2CO3(две ступени гидролиза):
|
(4) |
|
(4´) |
Так
как ![]() ,
следовательно,
,
следовательно, ![]() .
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
.
Таким образом, по первой ступени гидролиз
солей всегда протекает в большей степени.
Степень гидролиза (h) - отношение количества гидролизованной соли к общему количеству растворенной соли, обычно выражаемое в процентах.
Если,
например, в воде было растворено 2 моль
соли, а гидролизу подверглось 0,01 моль,
то ![]() .
.
Степень гидролиза зависит от многих факторов:
1. В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах CH3COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(CH3COONa) = 0,01%, a h(NaCN) = 1,5%.
Это объясняется различной силой кислот, составляющих соли:
![]()
![]()
![]() .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем выше степень гидролиза.
2. Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, поэтому:
Чем выше температура, тем больше степень гидролиза.
3. Степень гидролиза зависит от концентрации раствора:
Чем меньше концентрация раствора соли, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1. Для солей типаNH4Cl:
|
(5) |
2. Для солей типаCH3COONa:
|
(6) |
3. Для солей типаNH4CN:
|
(7) |
Таким образом, степень гидролиза солей, образованных слабой кислотой и слабым основанием, практически не зависит от концентрации раствора соли.

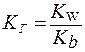 .
. .
.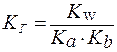 .
.
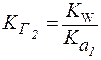
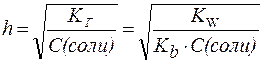 .
.