
- •Биохимия теория
- •1. Аминокислоты. Классификация (по структуре, по характеру r-групп, заменимые и незаменимые).
- •2. Физико-химические свойства ак.
- •3. Первичная структура белка. Характеристика пептидной связи.
- •4. Вторичная структура белка. Альфа- спираль и бета – складчатый слой.
- •5. Третичная структура белка и силы ее стабилизирующие.
- •6. Четвертичная структура белка. Понятия о денатурации и деструкции.
- •7. Кооперативный эффект связывания кислорода гемоглобином..
- •8. Отличия ферментов от неорганических катализаторов.
- •9. Классификация ферментов с примерами реакций на каждый класс.
- •10. Влияние температуры, pH и концентрации фермента на скорость ферментативной реакции.
- •11. Влияние концентрации субстрата на скорость ферментативной реакции. Вывод уравнения Михаэлиса-Ментен.
- •12. Ингибирование ферментов. Конкурентное ингибирование.
- •13. Ингибирование ферментов. Неконкурентное ингибирование.
- •14. Аллостерические ферменты.
- •15. Активный центр фермента и его свойства.
- •16. Кофакторы и коферменты. Классификация.
- •17. Молекулярные механизмы ферментативного катализа.
- •18. Способы определения активности фермента. Единицы измерения. Понятие об удельной и молярной активности.
- •20. Изоферменты.
- •21. Моносахариды. Представители и свойства. Функции углеводов.
- •22. Производные моносахаридов.
- •23. Дисахариды. Восстанавливающие и невосстанавливающие сахара.
- •24. Гомо- и гетерополисахариды.
- •25. Переваривание углеводов в жкт.
- •26. Липиды. Классификация липидов и их функции.
- •27. Жирные кислоты. Их роль в организме.
- •28. Эйказаноиды и простагландины.
- •29. Фосфолипиды (Фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол).
- •30. Сфинголипиды. Церамиды. Ганглиозиды
- •31. Неомыляемые липиды. Холестерин и его свойства.
- •32. Распад липидов в жкт. Специфичность фосфолипаз.
- •33. Химический состав нуклеиновых кислот. Правила Чаргаффа.
- •34. Структурная организация олиго- и полинуклеотидов. Характеристика первичной структуры днк.
- •35. Вторичная структура днк. Формы двойной спирали.
- •36. Третичная структкура днк.
- •37. Структура и свойства рибосомальных, матричных и транспортных рнк
- •38. Биосинтез белка. Стадии активации и инициации.
- •39. Биосинтез белка. Стадии элонгации и терминации.
- •40. Ингибиторы биосинтеза белка. Механизм действия дифтерийного токсина.
- •41. Витамины, классификация. Антивитамины. Несовместимость витаминов. Особенности водорастворимых витаминов.
- •42. Жирорастворимые витамины (a, d, e, k).
- •43. Водорастворимые витамины группы b (b1, b2, b3, b6, b12).
- •44. Фолиевая кислота и витамин с.
- •45. Пути превращения углеводов. Реакции гликолиза и его регуляция.
- •49. Работа цикла трикарбоновых кислот(цтк). Анаплеротические реакции цтк.
- •50. Методы выделения белковых молекул.
- •51. Окисление жирных кислот с четным числом углеродных атомов.
- •52. Окисление жирных кислот с нечетным числом углеродных атомов.
- •53. Биосинтез жирных кислот.
- •57. Пути превращения аминокислот в организме человека. Глюкогенные и кетогенные аминокислоты.
- •58. Синтез кетоновых тел, их роль для организма человека.
- •59. Цикл мочевины.
- •60.Обмен пуринов (распад и синтез) у человека.
- •61. Обмен пиримидинов (распад и синтез) у человека
- •62. Гормоны гипоталамуса и гипофиза.
- •63. Гормоны надпочечников (коркового и мозгового слоя)
- •64. Гормоны щитовидной железы.
- •65. Гормоны поджелудочной железы.
- •66. Половые гормоны.
- •67.Глюкозо-аланиновый и глюкозо-лактатный путь, роль в организме человека.
- •68.Дыхательная цепь митохондрий. Характеристика переносчиков.
- •69.Хемиоосмотическая модель п.Митчелла (основные постулаты и доказательства).
- •70. Ингибиторы и разобщители дыхательной цепи митохондрий.
9. Классификация ферментов с примерами реакций на каждый класс.
Ответ.
По типу катализируемых реакций ферменты
подразделяются на 6 классов согласно
иерархической классификации ферментов.
Каждый класс содержит подклассы, так
что фермент описывается совокупностью
четырёх чисел, разделённых точками.
Например, пепсин имеет название ЕС
3.4.23.1. Первое число грубо описывает
механизм реакции, катализируемой
ферментом: КФ
1:
Оксидоредуктазы,
катализирующие перенос электронов, то
есть окисление или восстановление.
Пример: каталаза, алкогольдегидрогеназа.
Реакции, катализируемые оксидоредуктазами,
в общем виде выглядят так: A− + B → A + B−.
Где A — восстановитель (донор электронов),
а B — окислитель (акцептор электронов)
В биохимических превращениях
окислительно-восстановительные реакции
иногда выглядят сложнее.
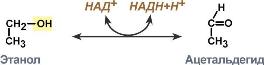 .
Здесь в качестве окислителя выступает
НАД+, а глицеральдегид-3-фосфат является
восстановителем. КФ
2:
Трансферазы,
катализирующие перенос химических
групп с одной молекулы субстрата на
другую. Среди трансфераз особо выделяют
киназы, переносящие фосфатную группу,
как правило, с молекулы АТФ. Реакции,
катализируемые трансферазами, в общем
случае выглядят так: A—X + B ↔ A + B—X.
Молекула A здесь выступает в качестве
донора группы атомов (X), а молекула B
является акцептором группы. Часто в
качестве донора в подобных реакциях
переноса выступает один из коферментов.
Многие из катализируемых трансферазами
реакций являются обратимыми.
.
Здесь в качестве окислителя выступает
НАД+, а глицеральдегид-3-фосфат является
восстановителем. КФ
2:
Трансферазы,
катализирующие перенос химических
групп с одной молекулы субстрата на
другую. Среди трансфераз особо выделяют
киназы, переносящие фосфатную группу,
как правило, с молекулы АТФ. Реакции,
катализируемые трансферазами, в общем
случае выглядят так: A—X + B ↔ A + B—X.
Молекула A здесь выступает в качестве
донора группы атомов (X), а молекула B
является акцептором группы. Часто в
качестве донора в подобных реакциях
переноса выступает один из коферментов.
Многие из катализируемых трансферазами
реакций являются обратимыми.
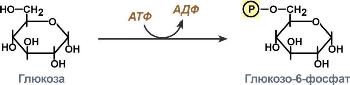 КФ
3:
Гидролазы,
катализирующие гидролиз химических
связей. Пример: эстеразы, пепсин, трипсин,
амилаза, липопротеинлипаза. Общий вид
реакции, катализируемой гидролазой,
выглядит следующим образом: A-B + H2O →
A-OH + B-H. Проявляют активность при наличии
неизменённых сульфгидрильных SH— групп,
если таковые занимают определённое
положение в полипептидной цепи.
Каталитическое действие заключается
в соединении гидролаз с расщепляемым
веществом и последующим отщеплением
продуктов реакции с высвобождением
самих гидролаз. Механизм имеет много
общего с действием трансфераз. Гидролазы
переносят отщепляемые группы на воду,
но некоторые способны переносить их и
на другие молекулы. Часть гидролаз
выделена в кристаллической форме
(уреаза, пепсин, трипсин, химотрипсин и
др.).
КФ
3:
Гидролазы,
катализирующие гидролиз химических
связей. Пример: эстеразы, пепсин, трипсин,
амилаза, липопротеинлипаза. Общий вид
реакции, катализируемой гидролазой,
выглядит следующим образом: A-B + H2O →
A-OH + B-H. Проявляют активность при наличии
неизменённых сульфгидрильных SH— групп,
если таковые занимают определённое
положение в полипептидной цепи.
Каталитическое действие заключается
в соединении гидролаз с расщепляемым
веществом и последующим отщеплением
продуктов реакции с высвобождением
самих гидролаз. Механизм имеет много
общего с действием трансфераз. Гидролазы
переносят отщепляемые группы на воду,
но некоторые способны переносить их и
на другие молекулы. Часть гидролаз
выделена в кристаллической форме
(уреаза, пепсин, трипсин, химотрипсин и
др.).
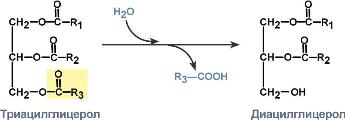 КФ
4:
Лиазы,
катализирующих реакции негидролитического
и неокислительного разрыва различных
химических связей (C—C, C—O, C—N, C—S и
других) субстрата, обратимые реакции
образования и разрыва двойных связей,
сопровождающиеся отщеплением или
присоединением групп атомов по её месту,
а также образованием циклических
структур.
КФ
4:
Лиазы,
катализирующих реакции негидролитического
и неокислительного разрыва различных
химических связей (C—C, C—O, C—N, C—S и
других) субстрата, обратимые реакции
образования и разрыва двойных связей,
сопровождающиеся отщеплением или
присоединением групп атомов по её месту,
а также образованием циклических
структур.
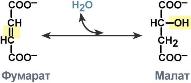 КФ
5:
Изомеразы,
катализирующие структурные или
геометрические изменения в молекуле
субстрата с образованием изомерных
форм.
КФ
5:
Изомеразы,
катализирующие структурные или
геометрические изменения в молекуле
субстрата с образованием изомерных
форм.
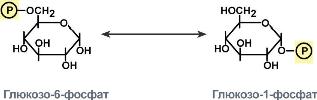 КФ
6:
Лигазы,
катализирующие образование химических
связей C—C, C—S, C—O и C—N между субстратами
за счёт реакций конденсации, сопряжённых
с гидролизом АТФ. Пример: лигаза
КФ
6:
Лигазы,
катализирующие образование химических
связей C—C, C—S, C—O и C—N между субстратами
за счёт реакций конденсации, сопряжённых
с гидролизом АТФ. Пример: лигаза
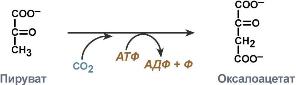 КФ
7:
Транслоказы,
катализирующие перенос ионов или молекул
через мембраны или их разделение в
мембранах. Например, при переносе
протонов из матрикса митохондрии в
межмембранное пространство через
комплекс I электрон-транспортной цепи
(7.1.1.2) происходит восстановление убихинона
до убихинола, и реакция описывается
следующей схемой: NADH
+ CoQ
+ 6 H+[side
1] = NAD+
+ CoQH2
+ 7 H+[side
2]. Второй пример — АТФ-синтаза,
катализирующая реакцию переноса протонов
из межмембранного пространства
митохондрии в матрикс с образованием
при этом молекулы АТФ из АДФ и
неорганического фосфата, реакция
описывается схемой[3]: АДФ + Фн + 4 H+[side
1] → АТФ + H2O
+ 4 H+[side
2]. Второе число в наименовании фермента
отражает подкласс, третье — подподкласс,
а четвёртая — порядковый номер фермента
в его подподклассе. Будучи катализаторами,
все ферменты ускоряют как прямую, так
и обратную реакции, поэтому, например,
лиазы способны катализировать и обратную
реакцию — присоединение по двойным
связям.
КФ
7:
Транслоказы,
катализирующие перенос ионов или молекул
через мембраны или их разделение в
мембранах. Например, при переносе
протонов из матрикса митохондрии в
межмембранное пространство через
комплекс I электрон-транспортной цепи
(7.1.1.2) происходит восстановление убихинона
до убихинола, и реакция описывается
следующей схемой: NADH
+ CoQ
+ 6 H+[side
1] = NAD+
+ CoQH2
+ 7 H+[side
2]. Второй пример — АТФ-синтаза,
катализирующая реакцию переноса протонов
из межмембранного пространства
митохондрии в матрикс с образованием
при этом молекулы АТФ из АДФ и
неорганического фосфата, реакция
описывается схемой[3]: АДФ + Фн + 4 H+[side
1] → АТФ + H2O
+ 4 H+[side
2]. Второе число в наименовании фермента
отражает подкласс, третье — подподкласс,
а четвёртая — порядковый номер фермента
в его подподклассе. Будучи катализаторами,
все ферменты ускоряют как прямую, так
и обратную реакции, поэтому, например,
лиазы способны катализировать и обратную
реакцию — присоединение по двойным
связям.
