
- •Биохимия теория
- •1. Аминокислоты. Классификация (по структуре, по характеру r-групп, заменимые и незаменимые).
- •2. Физико-химические свойства ак.
- •3. Первичная структура белка. Характеристика пептидной связи.
- •4. Вторичная структура белка. Альфа- спираль и бета – складчатый слой.
- •5. Третичная структура белка и силы ее стабилизирующие.
- •6. Четвертичная структура белка. Понятия о денатурации и деструкции.
- •7. Кооперативный эффект связывания кислорода гемоглобином..
- •8. Отличия ферментов от неорганических катализаторов.
- •9. Классификация ферментов с примерами реакций на каждый класс.
- •10. Влияние температуры, pH и концентрации фермента на скорость ферментативной реакции.
- •11. Влияние концентрации субстрата на скорость ферментативной реакции. Вывод уравнения Михаэлиса-Ментен.
- •12. Ингибирование ферментов. Конкурентное ингибирование.
- •13. Ингибирование ферментов. Неконкурентное ингибирование.
- •14. Аллостерические ферменты.
- •15. Активный центр фермента и его свойства.
- •16. Кофакторы и коферменты. Классификация.
- •17. Молекулярные механизмы ферментативного катализа.
- •18. Способы определения активности фермента. Единицы измерения. Понятие об удельной и молярной активности.
- •20. Изоферменты.
- •21. Моносахариды. Представители и свойства. Функции углеводов.
- •22. Производные моносахаридов.
- •23. Дисахариды. Восстанавливающие и невосстанавливающие сахара.
- •24. Гомо- и гетерополисахариды.
- •25. Переваривание углеводов в жкт.
- •26. Липиды. Классификация липидов и их функции.
- •27. Жирные кислоты. Их роль в организме.
- •28. Эйказаноиды и простагландины.
- •29. Фосфолипиды (Фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол).
- •30. Сфинголипиды. Церамиды. Ганглиозиды
- •31. Неомыляемые липиды. Холестерин и его свойства.
- •32. Распад липидов в жкт. Специфичность фосфолипаз.
- •33. Химический состав нуклеиновых кислот. Правила Чаргаффа.
- •34. Структурная организация олиго- и полинуклеотидов. Характеристика первичной структуры днк.
- •35. Вторичная структура днк. Формы двойной спирали.
- •36. Третичная структкура днк.
- •37. Структура и свойства рибосомальных, матричных и транспортных рнк
- •38. Биосинтез белка. Стадии активации и инициации.
- •39. Биосинтез белка. Стадии элонгации и терминации.
- •40. Ингибиторы биосинтеза белка. Механизм действия дифтерийного токсина.
- •41. Витамины, классификация. Антивитамины. Несовместимость витаминов. Особенности водорастворимых витаминов.
- •42. Жирорастворимые витамины (a, d, e, k).
- •43. Водорастворимые витамины группы b (b1, b2, b3, b6, b12).
- •44. Фолиевая кислота и витамин с.
- •45. Пути превращения углеводов. Реакции гликолиза и его регуляция.
- •49. Работа цикла трикарбоновых кислот(цтк). Анаплеротические реакции цтк.
- •50. Методы выделения белковых молекул.
- •51. Окисление жирных кислот с четным числом углеродных атомов.
- •52. Окисление жирных кислот с нечетным числом углеродных атомов.
- •53. Биосинтез жирных кислот.
- •57. Пути превращения аминокислот в организме человека. Глюкогенные и кетогенные аминокислоты.
- •58. Синтез кетоновых тел, их роль для организма человека.
- •59. Цикл мочевины.
- •60.Обмен пуринов (распад и синтез) у человека.
- •61. Обмен пиримидинов (распад и синтез) у человека
- •62. Гормоны гипоталамуса и гипофиза.
- •63. Гормоны надпочечников (коркового и мозгового слоя)
- •64. Гормоны щитовидной железы.
- •65. Гормоны поджелудочной железы.
- •66. Половые гормоны.
- •67.Глюкозо-аланиновый и глюкозо-лактатный путь, роль в организме человека.
- •68.Дыхательная цепь митохондрий. Характеристика переносчиков.
- •69.Хемиоосмотическая модель п.Митчелла (основные постулаты и доказательства).
- •70. Ингибиторы и разобщители дыхательной цепи митохондрий.
20. Изоферменты.
Ответ.
Изоферменты
– это множественные формы одного
фермента, катализирующие одну и ту же
реакцию, но отличающие по физическим и
химическим свойствам (сродству к
субстрату, максимальной скорости
катализируемой реакции, электрофоретической
подвижности, разной чувствительности
к ингибиторам и активаторам, оптимуму
рН и термостабильности). Изоферменты
имеют четвертичную структуру, которая
образована четным количеством субъединиц
(2, 4, 6 и т.д.). Изоформы фермента образуются
в результате различных комбинаций
субъединиц. В качестве примера можно
рассмотреть лактатдегидрогеназу (ЛДГ),
фермент, который катализирует обратимую
реакцию: пируват ←ЛДГ→ лактат. ЛДГ
существует в виде 5 изоформ, каждая из
которых состоит из 4-х протомеров
(субъединиц) 2 типов М (muscle) и Н (heart). Синтез
протомеров М и Н типа кодируется двумя
разными генетическими локусами.
Изоферменты ЛДГ различаются на уровне
четвертичной структуры: ЛДГ1(НННН),
ЛДГ2(НННМ), ЛДГ3(ННММ), ЛДГ4(НМММ), ЛДГ5(ММММ).
Полипептидные цепи Н и М типа имеют
одинаковую молекулярную массу, но в
составе первых преобладают карбоновые
аминокислоты, последних – диаминокислоты,
поэтому они несут разный заряд и могут
быть разделены методом электрофореза.
Кислородный обмен в тканях влияет на
изоферментный состав ЛДГ. Где доминирует
аэробный обмен, там преобладают ЛДГ1,
ЛДГ2 (миокард, надпочечники), где анаэробный
обмен - ЛДГ4, ЛДГ5(скелетная мускулатура,
печень). В процессе индивидуального
развития организма в тканях происходит
изменение содержания кислорода и изоформ
ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5.
После рождения в некоторых тканях
происходит увеличение содержания ЛДГ1,
ЛДГ2. Существование изоформ повышает
адаптационную возможность тканей,
органов, организма в целом к меняющимся
условиям. По изменению изоферментного
состава оценивают метаболическое
состояние органов и тканей. Изоформы
креатинкиназы. Креатинкиназа (КК)
катализирует реакцию образования
креатинфосфата:
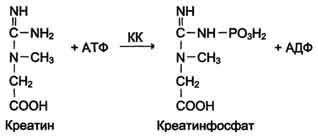 Молекула
КК - димер, состоящий из субъединиц двух
типов: М (от англ, muscle - мышца) и В (от англ,
brain - мозг). Из этих субъединиц образуются
3 изофермента - ВВ, MB, MM. Изофермент ВВ
находится преимущественно в головном
мозге, ММ - в скелетных мышцах и MB - в
сердечной мышце. Изоформы КК имеют
разную электрофоретическую подвижность.
Активность КК в норме не должна превышать
90 МЕ/л. Определение активности КК в
плазме крови имеет диагностическое
значение при инфаркте миокарда (происходит
повышение уровня МВ-изоформы). Количество
изоформы ММ может повышаться при травмах
и повреждениях скелетных мышц. Изоформа
ВВ не может проникнуть через
гематоэнцефалический барьер, поэтому
в крови практически не определяется
даже при инсультах и диагностического
значения не имеет.
Молекула
КК - димер, состоящий из субъединиц двух
типов: М (от англ, muscle - мышца) и В (от англ,
brain - мозг). Из этих субъединиц образуются
3 изофермента - ВВ, MB, MM. Изофермент ВВ
находится преимущественно в головном
мозге, ММ - в скелетных мышцах и MB - в
сердечной мышце. Изоформы КК имеют
разную электрофоретическую подвижность.
Активность КК в норме не должна превышать
90 МЕ/л. Определение активности КК в
плазме крови имеет диагностическое
значение при инфаркте миокарда (происходит
повышение уровня МВ-изоформы). Количество
изоформы ММ может повышаться при травмах
и повреждениях скелетных мышц. Изоформа
ВВ не может проникнуть через
гематоэнцефалический барьер, поэтому
в крови практически не определяется
даже при инсультах и диагностического
значения не имеет.
21. Моносахариды. Представители и свойства. Функции углеводов.
Ответ.
Моносахариды (монозы) являются
бифункциональными соединениями. В их
молекулах одновременно содержатся
карбонильная (альдегидная или кетонная)
и несколько гидроксильных групп, т. е.
моносахариды представляют собой
полигидроксикарбонильные соединения
— полигидроксиальдегиды и полигидроксикетоны.
В зависимости от этого моносахариды
подразделяются на альдозы (в моносахариде
содержится альдегидная группа) и кетозы
(содержится кетогруппа). Например,
глюкоза — это альдоза, а фруктоза — это
кетоза. В зависимости от числа атомов
углерода в молекуле моносахарид
называется тетрозой, пентозой, гексозой
и т. д. Если объединить последние два
типа классификации, то глюкоза — это
альдогексоза, а фруктоза — кетогексоза.
Большинство встречающихся в природе
моносахаридов — это пентозы и гексозы.
Моносахариды являются углеводами,
которые не гидролизуются с образованием
более простых углеводов. Глюкоза,
или виноградный сахар, входит в состав
сока многих фруктов и ягод, в том числе
винограда, и является самым распространённым
углеводом. Глюкоза относится к шестиатомным
моносахаридам, то есть относится к ряду
гексоз. В свободном виде глюкоза
содержится в плодах, цветах и других
органах растений, в мёде, а также в
животных тканях (в крови, мозге, мышцах).
В природе глюкоза существует преимущественно
в виде Д–изомера и является важнейшим
источником энергии в организмах животных,
человека и микроорганизмов. Глюкоза —
бесцветное кристаллическое вещество
сладкого вкуса, хорошо растворимое в
воде. Растворы глюкозы используются в
медицине для внутривенных инъекций,
так как обеспечивают дополнительное
питание организма быстро усваиваемыми
углеводами. Повышение концентрации
глюкозы в крови приводит к усилению
выработки гормона поджелудочной железы
— инсулина, отвечающего за быстрый
метаболизм углеводов в организме. В
организме глюкоза подвергается сложным
биохимическим превращениям, в результате
которых образуется углекислый газ и
вода и выделяется энергия в соответствии
с итоговым уравнением:
![]() Этот процесс протекает ступенчато, с
медленным выделением энергии. Большое
значение имеют биохимические процессы
брожения глюкозы. Так, при квашении
капусты, огурцов, молока, при силосовании
кормов происходит молочнокислое брожение
глюкозы (образуется молочная кислота).
При производстве пива и вина используется
спиртовое брожение глюкозы, в результате
которого образуется этиловый спирт.
При взаимодействии глюкозы со спиртами
образуются простые эфиры:
Этот процесс протекает ступенчато, с
медленным выделением энергии. Большое
значение имеют биохимические процессы
брожения глюкозы. Так, при квашении
капусты, огурцов, молока, при силосовании
кормов происходит молочнокислое брожение
глюкозы (образуется молочная кислота).
При производстве пива и вина используется
спиртовое брожение глюкозы, в результате
которого образуется этиловый спирт.
При взаимодействии глюкозы со спиртами
образуются простые эфиры:
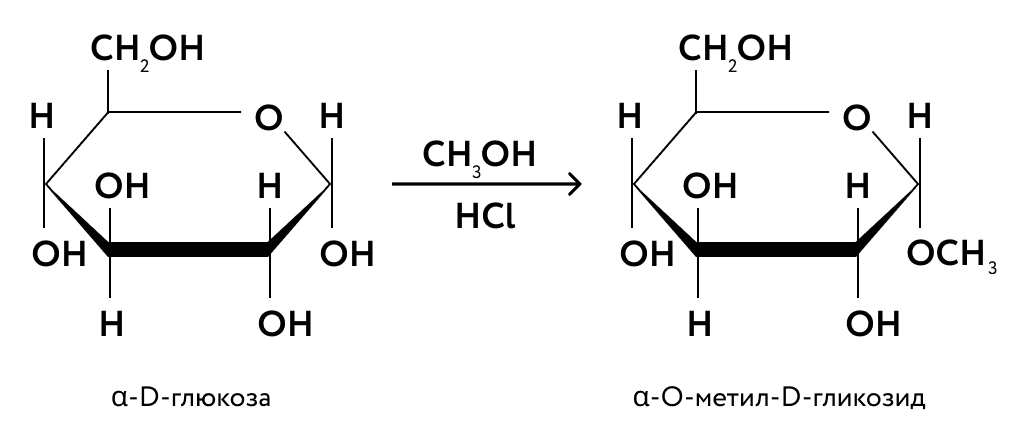 Глюкоза
реагирует с карбоновыми кислотами с
образованием сложных эфиров, то есть
пять гидроксильных групп глюкозы
вступают в реакцию с кислотами аналогично
спиртам. Как многоатомный спирт реагирует
без нагревания с гидроксидом меди (2) c
образованием алкоголята меди (2)
ярко-синего цвета (качественная реакция
на многоатомные спирты). Глюкоза легко
окисляется до глюконовой кислоты под
действием гидроксида меди (2) при
нагревании, в результате чего образуется
также оксид меди) красного цвета. Глюкоза
легко вступает в реакцию «серебряного
зеркала», окисляясь под действием
аммиачного раствора оксида серебра
(1). Глюкоза способна окисляться под
действием азотной кислоты и с бромной
воды.
Глюкоза
реагирует с карбоновыми кислотами с
образованием сложных эфиров, то есть
пять гидроксильных групп глюкозы
вступают в реакцию с кислотами аналогично
спиртам. Как многоатомный спирт реагирует
без нагревания с гидроксидом меди (2) c
образованием алкоголята меди (2)
ярко-синего цвета (качественная реакция
на многоатомные спирты). Глюкоза легко
окисляется до глюконовой кислоты под
действием гидроксида меди (2) при
нагревании, в результате чего образуется
также оксид меди) красного цвета. Глюкоза
легко вступает в реакцию «серебряного
зеркала», окисляясь под действием
аммиачного раствора оксида серебра
(1). Глюкоза способна окисляться под
действием азотной кислоты и с бромной
воды.  Азотная
кислота окисляет глюкозу до дикарбоновой
кислоты – глюкаровой (или сахарной)
кислоты.
Азотная
кислота окисляет глюкозу до дикарбоновой
кислоты – глюкаровой (или сахарной)
кислоты.
Глюкоза
обладает некоторыми специфическими
свойствами.
Глюкоза может быть получена гидролизом природных веществ, в состав которых она входит. Её получают гидролизом картофельного и кукурузного крахмала кислотами. Фруктоза содержится во фруктах, в пчелином мёде, входит в состав сахара (сахарозы). Фруктоза является изомером глюкозы и имеет ту же молекулярную формулу. Она представляет собой кетогексозу, в которой кето-группа находится у второго углеродного атома в цепи. Фруктоза, как и глюкоза, существует в двух таутомерных формах — в открытой и замкнутой (циклической). От глюкозы фруктоза отличается меньшим размером цикла, который содержит не шесть, а пять атомов (включая кислород). Фруктоза хорошо растворима в воде и имеет более сладкий вкус, чем глюкоза. Поскольку фруктоза, как и глюкоза, является многоатомным спиртом, то вступает в те же реакции с участием гидроксильных групп. Особенностью фруктозы является невозможность окисления кетогруппы до кислоты. В живых организмах углеводы выполняют следующие функции. Структурная и опорная функции. Углеводы участвуют в построении различных опорных структур. Так, целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих. Защитная роль у растений. У некоторых растений есть защитные образования (шипы, колючки и др.), состоящие из клеточных стенок мёртвых клеток. Пластическая функция. Углеводы входят в состав сложных молекул (например, пентозы (рибоза и дезоксирибоза) участвуют в построении АТФ, ДНК и РНК). Энергетическая функция. Углеводы служат источником энергии: при окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды. Запасающая функция. Углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал и инулин — у растений. Осмотическая функция. Углеводы участвуют в регуляции осмотического давления в организме. Так, в крови содержится 100—110 мг/л глюкозы, от концентрации глюкозы зависит осмотическое давление крови. Рецепторная функция. Олигосахариды входят в состав воспринимающей части многих клеточных рецепторов или молекул-лигандов.
