
Электрический ток в жидкостях
.pdfЛЕКЦИЯ
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
Происхождение электрического тока (движение электрических зарядов) через раствор существенно отличается от движения электрических зарядов по металлическому проводнику. Различие, прежде всего в том, что зарядоносителями в растворах являются не электроны, а ионы, т.е. сами атомы или молекулы,
потерявшие или захватившие один или несколько электронов. Естественно, это движение, так или иначе, сопровождается изменением свойств самого вещества.
Жидкости по степени электропроводности делятся на:
диэлектрики (например, дистиллированная вода);
проводники (электролиты);
полупроводники (расплавы некоторых солей).
Носители тока в жидкостях – положительные и отрицательные ионы.
Электролиты – вещества, водные растворы которых проводят электрический ток. К ним относятся водные растворы солей, кислот, щелочей. Они являются проводниками второго рода.
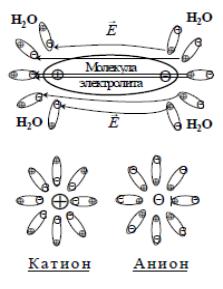
Молекулы воды и электролитов представляют собой электрические диполи. В
результате кулоновского взаимодействия молекулы электролитов распадаются на ионы (катионы и анионы), такой процесс распада молекул называют
электролитической диссоциацией.
Причины электролитической диссоциации:
тепловое движение полярных молекул растворенного вещества,
взаимодействие этих молекул с полярными молекулами растворителя
(поле молекул H2O, окружающих полярную молекулу, ослабляет связь между ионами этой молекулы).
1
Обратный процесс, процесс образования нейтральной молекулы при столкновении положительного и отрицательного ионов называется рекомбинацией
(молизацией).
После разрыва молекулы на ионы диполи растворителя обволакивают их,
образуя сольватную оболочку, сильно затрудняющую движение ионов.
При создании в растворе электрического поля внешним источником тока,
катионы начинают направленно двигаться вдоль Е, а анионы – против Е. Таким образом в растворе возникает электрический ток, обусловленный встречным направленным движением разноимённых ионов.
Закон Ома для электролитов:
= + + + + − − −
где +, −, +, − ‒ концентрации и направленные скорости катионов и анионов,
соответственно.
Когда через раствор проходит электрический ток, между электродами,
соединенными с источником тока, создается разность потенциалов, иначе говоря,
один из них оказывается заряженным положительно, а другой отрицательно. Под действием этой разности потенциалов положительные ионы перемещаются по направлению к отрицательному электроду — катоду, а отрицательные ионы — к
аноду.
2
Таким образом, хаотическое движение ионов стало упорядоченным встречным движением отрицательных ионов в одну сторону и положительных в другую. Этот процесс переноса зарядов и составляет течение электрического тока через электролит и происходит до тех пор, пока имеется разность потенциалов на электродах. С исчезновением разности потенциалов прекращается ток через электролит, нарушается упорядоченное движение ионов, и вновь наступает хаотическое движение.
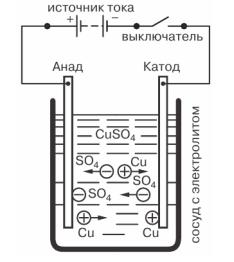
В качестве примера рассмотрим явление электролиза при пропускании электрического тока через раствор медного купороса CuSO4 с опущенными в него медными электродами.
Явление электролиза при прохождении тока через раствор медного купороса: С - сосуд с
электролитом, Б — источник тока, В — выключатель
Так как этот химический процесс протекает длительное время, то на катоде отлагается медь, выделяющаяся из электролита. При этом электролит вместо ушедших на катод молекул меди получает новые молекулы меди за счет растворения второго электрода — анода.
Таким образом, разница между электрическим током в металлах и жидких проводниках заключается в том, что в металлах переносчиками зарядов являются только свободные электроны, т. е. отрицательные заряды, тогда как в электролитах электричество переносится разноименно заряженными частицами вещества ‒
3

ионами, двигающимися в противоположных направлениях. Поэтому говорят, что электролиты обладают ионном проводимостью.
Электрический ток в электролитах сопровождается явлением электролиза.
Электролиз – выделение на электродах составных частей растворенных веществ или других веществ, являющихся результатом вторичных реакций на электродах.
Первый закон Фарадея: Масса вещества, которая выделяется на электроде,
прямо пропорциональна заряду, протекшему через электролит:
= = ∆
где k ‒ электрохимический эквивалент вещества, равный количеству вещества,
выделяющемуся на электродах при прохождении через раствор заряда q =1Кл.
Второй закон Фарадея: электрохимический эквивалент вещества k
пропорционален отношению молярной массы A ионов этого вещества к их валентности z
= 1
где F = 96486,7 Кл / моль – число Фарадея.
Электролиз широко применяется в различных электрохимических производствах. Важнейшие из них: электролитическое получение металлов из водных растворов их солей и из их расплавленных солей; электролиз хлористых солей; электролитическое окисление и восстановление; получение водорода электролизом; гальваностегия; гальванопластика; электрополировка. Методом рафинирования получают чистый металл, очищенный от примесей. Гальваностегия
– покрытие металлических предметов другим слоем металла. Гальванопластика –
получение металлических копий с рельефных изображений каких-либо поверхностей. Электрополировка – выравнивание металлических поверхностей.
Электрофорез ‒ движение под действием электрического поля грубодисперсных
(взвешенных мелких твёрдых частиц, пузырьков и т.д.) или коллоидно-дисперсных
(крупные органические молекулы) заряженных частиц. Электрический заряд такие
4
частицы приобретают или в результате ионизации, или в результате формирования на их поверхности двойного слоя элементарных зарядов.
Ионофорез ‒ введение в организм лекарств при пропускании через него электрического тока, образованного (внутри организма) ионами лекарственного вещества, которым пропитывают тампон, подкладываемый под один из электродов.
5
