
- •Контрольные вопросы
- •Какие проблемы гидросферы Вы отнесли бы к глобальным? Почему?
- •С какими аномальными свойствами воды связано влияние гидросферы на климат?
- •Почему вблизи океанов и морей климат более мягкий?
- •В каком виде может находиться вода в гидросфере?
- •Какие способы классификации природных вод Вы знаете?
- •На что, зачем и почему в мире ежегодно расходуется основное количество пресных вод?
- •Почему использование воды в сельском хозяйстве, в промышленности и в быту приводят к деградации воды? в чем сходство и различие этих причин?
- •Какие единицы используются для выражения концентрации воды при записи ее состава в виде формулы Курлова? Как их можно рассчитать, зная концентрацию, выраженную в весовых процентах?
- •Сформулируйте закон Дитмара. Для решения каких практических задач он используется?
- •Какие анионы и катионы, содержащиеся в природных водах, называют главными? Почему?
- •Как на основании термодинамических данных оценить растворимость минералов в воде? Какие критерии устойчивости минералов Вы знаете?
- •Что такое «агрессивность» природных вод?
- •Что такое «неустойчивость» минералов?
- •Для каких целей удобно использовать понятия: а) «агрессивности» природных вод; б) «неустойчивости минералов?
- •В чем отличие понятий «произведение растворимости» и «константа равновесия процесса растворения»?
- •Как связаны между собой значения произведения растворимости и константы равновесия процесса растворения?
- •Что такое жесткость воды и в каких единицах она измеряется?
- •Как классифицируют природные воды по величине жесткости? Какую жесткость имеют природные воды, наиболее широко представленные в Вашей местности?
- •Какие компоненты входят в состав карбонатной системы природных водоемов?
- •Равновесия между какими компонентами природных систем, определяются законом Генри?
- •Какие параметры природных систем определяют величину константы Генри?
- •Какое значение рН должны иметь атмосферные осадки, если «активные» примеси в атмосферном воздухе представлены только диоксидом углерода?
- •Как может измениться рН атмосферных осадков, если в атмосферном воздухе, помимо диоксида углерода, появится: а) аммиак; б) диоксид серы?
- •Что такое кислые дожди? с присутствием каких соединений в атмосферном воздухе связано их образование?
- •Какое значение рН будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •Что такое щелочность природных вод?
- •Как экспериментально определяют щелочность природных вод?
- •Как рассчитать щелочность природных вод, зная содержание компонентов карбонатной системы и рН раствора?
- •При каких условиях и почему в процессе фотосинтеза, протекающего в природном водоеме, может увеличиться значение рН?
- •Какое значение щелочности будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •Что может произойти в водоеме, если его щелочность уменьшится в десять раз?
- •Какие этапы закисления природных водоемов Вы знаете?
- •Что происходит с экологической системой водоема на различных этапах его закисления?
- •С чем связана особая опасность контакта закисленных природных вод, содержащих соединения алюминия и тяжелых металлов?
- •Назовите основные особенности протекания окислительно-восстановительных процессов в природных водах.
- •В каких единицах принято измерять величину окислительно-восстановительного потенциала природных вод?
- •Что такое редокс - буферность природных вод? с протеканием каких процессов она связана?
- •Что такое стратификация природных водоемов? с какими причинами может быть связана стратификация водоемов?
- •Чем отличаются олиготрофные и эвтрофные водоемы в период стратификации?
- •С протеканием каких процессов связана возможность появления сероводорода в зоне гиполимниона эвтрофного водоема в период стратификации?
- •Почему периоды водообмена в эвтрофном водоеме наиболее опасны для жизни рыб?
- •Почему, даже после прекращения поступления избытка питательных веществ, водоем медленно выходит из эвтрофного состояния?
- •Примеры задач
- •Выразите содержание главных катионов и главных анионов морской воды в промилле и миллимоль на литр,
- •Представьте средний состав морской воды, концентрация растворенного диоксида углерода в которой составляет 1000 мг/л, в виде формулы.
- •Оцените сколько грамм поваренной соли (NaCl) содержится в 1 кг морской воды, отобранной в одном из заливов Баренцева моря, если ее хлорность равна 15,00 0/00?
- •К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу речной воды?
- •Какая из двух природных вод более агрессивна по отношению к гипсу (CaSo4*2h2o), если активность катионов кальция и анионов so42- для первой и второй воды составляют:
- •298 К, давление равным 101,3 кПа, парциальное давление паров воды – 3,126 * 10-3 атм.
- •1. Что такое гидросфера? Оцените ее границы.
- •33. Как связано содержание ионов водорода в природных водах, находящихся в равновесии с карбонатными породами и диоксидом углерода, с парциальным давлением со2 в воздухе?
- •35. Какую минимальную жесткость будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •39. Что такое распределительная диаграмма? Для характеристики каких параметров природных систем удобно использовать распределительные диаграммы?
- •45. Окислительно-восстановительное состояние природных вод. Растворимость кислорода.
- •46. Превращение органических соединений в анаэробных условиях.
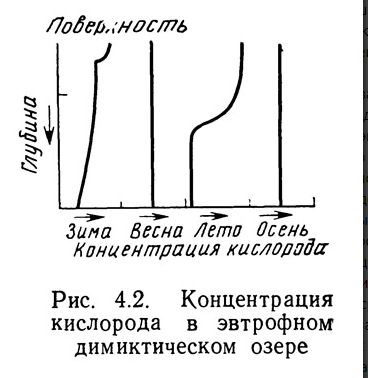
- •Эвтрофикация озер. Вид зависимости количества растворенного кислорода в воде от глубины погружения в различные периоды года.
Эвтрофикация озер. Вид зависимости количества растворенного кислорода в воде от глубины погружения в различные периоды года.
Для водоемов, глубина которых превышает толщину слоя фотосинтеза, характерны некоторые особенности распределения кислорода. В верхнем слое воды продуцирование кислорода в результате фотосинтетической активности, осредненное за сутки, превышает его потребление. В нижележащих слоях кислорода производится меньше, чем потребляется. На некоторой глубине количество продуцируемого кислорода равно количеству потребляемого. Эта глубина называется глубиной компенсации. Ниже этой точки потребности кислорода на дыхание превышают его продуцирование, так как фотосинтез ограничен количеством проникающей сюда световой энергии. Кроме того, сюда же опускается отмерший планктон из вышележащих слоев. По мере погружения частицы планктона облепляются бактериями, которые извлекают из них органические компоненты. Кислород требуется для дыхания бактерий и других обитателей этих глубин.
Какие наборы значений рН соответствуют атмосферным и поверхностным водам, находящимся в равновесии с СО2 атмосферы и кальцитом, при условии отсутствия других примесей, оказывающих влияние на кислотно-основное равновесие в природных водах?
а) 6,0 и 5,6; б) 6,0 и 7,0; в) 4,5 и 8,3; г) 5,6 и 8,3; д) оба равны 7.
. Какой из минералов, не содержащих примесей, – гипс (CaSO4 . 2H2O) или ангидрит (CaSO4) – более устойчив в водном растворе:
Процесс растворения протекает при нормальном давлении и температуре 90°С. Для определения констант равновесия процессов растворения гипса и ангидрита воспользуемся уравнением (5), связывающим константы равновесия, определенные при различных температурах процесса:
 .
.
Значения энтальпии реакции можно определить по уравнению:
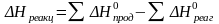 .
.
Для процесса растворения гипса имеем:
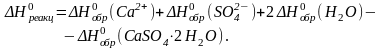
Подставив значения энтальпии образования ионов и соединений в стандартных условиях (таблица 6 Приложения) в данное уравнение, получим:
 =
(–542,7) + (–909,3) + 2(–285,8) – (–2027,7) =
=
(–542,7) + (–909,3) + 2(–285,8) – (–2027,7) =
= 4,1 (кДж/моль) = 4,1 . 103 (Дж/моль).
Логарифм отношения констант равновесия процессов растворения гипса при температуре 363 К (90°С) и температуре при стандартных условиях (298 К) составит:

Отношение констант равновесия процессов растворения гипса при температурах 363 К и 298 К будет:
K1/K0 = 1,35.
Константа равновесия процесса растворения гипса при температуре 363,3 К составит:
К1 = 1,35K0 = 1,35 . 3,6 . 10–4 = 4,86 . 10–4.
Проведем аналогичные расчеты для процесса растворения ангидрита:
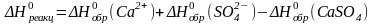 .
.
Подставив значения энтальпии образования ионов и соединений в стандартных условиях (таблица 6 Приложения) в данное уравнение, получим:
= (–542,7) + (-909,3) – (–1436,3) = –15,7(кДж/моль) =
=–15,7– 103 (Дж/моль);
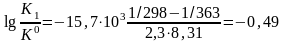 .
.
K1/K0 = 0,32;
К1 = 0,32K0 = 0,32 . 1,68 . 10–5 = 5,37 . 10–6.
Таким образом, при 90°С константа равновесия процесса растворения ангидрита меньше, чем константа равновесия гипса при этой температуре:
5,37 . 10-6 < 4,86 . 10–4,
поэтому в этих условиях ангидрит более устойчив, чем гипс.
Ответ: при стандартных условиях гипс более устойчив, чем ангидрит, а при температуре 90°С и нормальном атмосферном давлении ангидрит становится более устойчивым.
