
- •Классификация
- •Пути обезвреживания аммиака:
- •Глюкозо-аланиновый цикл
- •Стадии перекисного окисления липидов:
- •Эритроциты:
- •Раковые клетки отличаются от здоровых следующими аномалиями:
- •Регуляция:
- •Механизмы развития нейродегенеративных заболеваний
- •Кислородзависимые механизмы
- •Кислороднезависимые механизмы
- •33 Билет
- •1. Разобщители цпэ.
- •2. Пути обезвреживания аммиака.
- •3. Теломеразная активность.
- •Стадии атеросклероза
- •1 Стадия – повреждение эндотелия
- •2 Стадия – стадия начальных изменений
- •3 Стадия – стадия поздних изменений
- •4 Стадия – стадия осложнений
Регуляция:
В печени регуляция осуществляется при участии гормонов инсулина, глюкагона и адреналина, а в мышцах — инсулина и адреналина. Их действие на синтез и распад гликогена опосредовано изменением в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы (гликогеногенез) и гликогенфосфорилазы (гликогенолиз) при помощи их фосфорилирования/дефосфорилирования.
-во время мышечной работы адреналин вызывает фосфорилирование внутримышечных ферментов обмена гликогена. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
-при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Противосвертывающая система: состоит из антикоагулянтов. Первичные а: синтезируются в организме и выбрасываются в кровь, где взаимодействуют с активными факторами коагуляции, нейтрализуя их – антитромбин III (инактивирует факторы IIa, IXa, XIIa, Xa, XIIIa, из-за чего фибриноген не может превращаться в фибрин и образовывать сгустки), гепарин (блокирует активность тромбина и образование тромбокиназы). Вторичные а: образуются при свёртывании, фибрин, продукты деградации фибрина и тромбина.
Фибринолитическая система: главный компонент – фибринолизин (плазмин), содержащийся в плазме в виде плазминогена; осуществляет лизис фибрина, препятствует чрезмерному росту тромба, удаляет образовавшиеся тромбы, восстанавливая проходимость сосуда. Активаторы фибринолиза – превращают плазминоген в плазмин; плазменные и тканевые. Игибиторы – препятствующие превращению плазминогена в плазмин, действию активного плазмина.

Нейтрофилы, макрофаги, эозинофилы, тучные кл-ки, лимфоциты.
Специфической мишенью действия α1-антитрипсина является нейтрофильная эластаза, содержащаяся в некоторых лейкоцитах, способна разрушать коллаген и эластин. Функция: защита легких от эластазы – она производится нейтрофилами в ответ на повреждения и воспаления. Эластаза расщепляет белки, которые затем перерабатываются организмом и удаляются. Если ее активность не контролируется альфа-1-антитрипсином, она начинает разрушать ткани легких.
Задача. При генетическом дефекте пируваткиназы в эритроцитах у больных наблюдается гемолиз. Какое значение для эритроцитов имеет метаболический путь, в котором участвует пируваткиназа? Как связаны между собой дефект этого фермента и гемолиз?
Ответ: Пируваткиназа – один из ключевых ферментов гликолиза –единственного метаболического пути, обеспечивающего эритроцит энергией. Энергодефицит приводит к нарушению активного транспорта электролитов, увеличивается проницаемость мембраны, и наступает осмотический гемолиз.
Билет 12
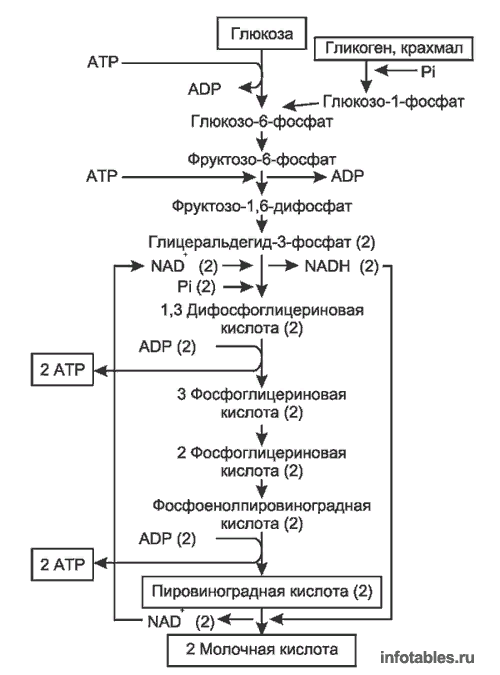
Гликолиз: общая характеристика, стадии, реакции процесса, регулируемые ферменты, энергетический эффект. Судьба продуктов гликолиза в аэробных условиях: схема процесса, связь с синтезом АТФ.
Гемоглобин, структура и функции. Типы гемоглобина человека, смена типов в онтогенезе. Кооперативные свойства гемоглобина. Гемоглобинопатии. Железодефицитные анемии.
Биохимические основы синдрома дыхательных расстройств. Строение сурфактатнта.
Гликолиз – специфический путь окисления глюкозы. Виды: аэробный – протекает при наличии кислорода и анаэробный - в его отсутствии. Аэробный гликолиз (10 реакций, конечный продукт пируват), протекает в цитозоле клеток всех тканей и только в скелетных мышцах и эритроцитах протекает анаэробный гликолиз (11 реакций - конечный продукт лактат). Регуляторные ферменты гликолиза: Е1-глюкокиназа/гексокиназа, Е3- фосфофруктокиназа, Е10-пируваткиназа.
Первый этап гликолиза – подготовительный (1-5 реакции), здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов.
Первая реакция гликолиза катализируется гексокиназой (фермент обладает высокой специфичностью к субстрату) или глюкокиназой (низкая специфичность действия) сводится к превращению глюкозы в активную форму глюкозо-6-фосфат. Ферменты Е1: гексокиназа и глюкокиназа – регуляторные ферменты гликолиза.
Во второй реакции происходит изомеризация (внутримолекулярные перестройки) глюкозо-6-фосфата во фруктозо-6-фосфат (фермент: глюкозо-6-фосфатизомераза)
В третьей реакции происходит фосфорилирование (присоединение остатка ортофосфорной кислоты) фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. При этом затрачивается еще одна молекула АТФ (уже вторая) - это вторая пусковая реакция гликолиза. Она идет в присутствии Mg2+ и является необратимой, так как сопровождается масштабным уменьшением свободной энергии (фермент: фосфофруктокиназа).
В четвертой реакции гликолиза происходит расщепление фруктозо-1,6-дифосфата на две молекулы глицеральдегид-3-фосфата (фермент: альдолаза).
Пятая реакция – переход глицеральдегидфосфата(ГАФ/ ФГА) и диоксиацетонфосфата (ДАФ/ФДА) друг в друга при участии триозофосфатизомеразы. Эта реакция определяет дальнейшую судьбу глюкозы:
• при нехватке энергии в клетке и активации окисления глюкозы диоксиацетонфосфат превращается в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза;
• при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний отправляется на синтез жиров.
Второй этап гликолиза, основной – это образование энергии в форме АТФ.
Шестая реакция гликолиза (фермент глицеральдегидфосфатдегидрогеназа) образование макроэргического соединения 1,3- дифосфоглицериновой кислоты и НАДН +Н +, связана с ЦПЭ. Образование энергии путем окислительного фосфорилирования.
Седьмая реакция (фермент фосфоглицераткиназа) - образование АТФ путем субстратного фосфорилирования.
Десятая реакция гликолиза – реакция субстратного фосфорилирования.
Одиннадцатая – образование молочной кислоты из пирувата под действием лактатдегидрогеназы. Эта реакция осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, образующийся в 6-й реакции, в отсутствие кислорода не может окисляться в митохондриях.
Если после гликолиза следует аэробное расщепление, пируват мигрирует в матрикс митохондрий, где, взаимодействуя с коэнзимом-А, участвует в образовании ацетил-СоА. В анаэробных условиях пируват при участии NADH восстанавливается до лактата (молочной кислоты), который при этом является конечным продуктом гликолиза. Затем в аэробных условиях лактат может обратно превратиться в пируват и окислиться в митохондриях.
Аэробный процесс гликолиза (10 реакций), уравнение (с образованием пирувата):
C6H12O6 + 2АДФ + 2Н3РO4 + 2НАД+ ——> 2CH3COCOOH + 2АТФ + 2Н2O + 2НАДН•Н+
Анаэробный процесс гликолиза (11 реакций), уравнение (с образованием лактата):
C6H12O6 + 2АДФ + 2Н3РO4 ——> 2СН3СНОНСООН + 2АТФ + 2Н2О
Энергетический эфф-т гликолиза: на начальных этапах энергия затрачивается: при превращениях 1 мол. Глюкозы – 2 мол. АТФ; при превращениях 1 глюкозного фрагмента гликогена – 1 мол. АТФ.
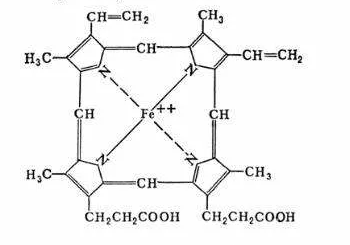
В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц 2 α и 2 β. Каждая α-цепь содержит по 141 аминокислотному остатку, а β- по 146. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Гем – плоская молекула, содержащая 4 пиррольных цикла и соединенных с ними атом железа: Гем соединяется с белковой частью (глобином) гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот.
Функция: состоит в связывании и переносе кислорода от легких к тканям. Гемоглобин, связанный кислородом, называется оксигемоглобином.
Физиологические типы гемоглобина.
1. Примитивный – HbP(относятся гемоглобины, называемые Говер 1 и Говер
2. Фетальный гемоглобин HbF(гемоглобин плода).
3. Гемоглобин взрослых: HbА1, HbА2,HbА3.
HbР появляется на ранних стадиях развития эмбриона. Примитивные гемоглобины заменяются на HbF. На поздних стадиях развития плода появляются гемоглобины взрослых –HbА1, HbА2.
В легких кооперативное взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Гемоглобинопатии — наследственные заболевания, обусловленные наличием в эритроцитах аномальных гемоглобинов либо угнетением синтеза полипептидных цепей нормальных гемоглобинов. Аномальные гемоглобины отличаются от HbA по первичной структуре, форме, величине заряда. При этом изменяются такие свойства как сродство к кислороду, растворимость, устойчивость к денатурации. Пример: серповидноклеточная анемия (замена глутаминовой кислоты в 6-м положении (с N-конца) на валин в β-цепях молекулы гемоглобина S).
Железодефици́тная анеми́я (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией. Основными причинами ЖДА являются кровопотери и недостаток пищи богатой гемоглобином.
Синдром дыхательных расстройств - патологическое состояние новорожденных, возникающее в первые часы и сутки после рождения вследствие морфофункциональной незрелости легочной ткани и дефицита сурфактанта. Синдром дыхательных расстройств характеризуется дыхательной недостаточностью различной степени выраженности (тахипноэ, цианозом, втяжением уступчивых мест грудной клетки, участием вспомогательной мускулатуры в акте дыхания), признаками угнетения ЦНС и нарушения кровообращения.
На поверхности альвеол расположен комплекс поверхностно-активного вещества-сурфактант, уменьшающий поверхностное натяжение и в значительной мере определяющих альвеолярную функциональную активность.
Основным функциональным компонентом сурфактанта являются фосфолипиды. Среди фракций фосфолипидов основными являются фосфатидитхолин, фосфатидил-глицерин. 55% фосфотидилхолина содержит насыщенные жирные кислоты - 70% составляют дипальмитоилфосфатидилхолин.
Установлено, что не только фосфолипиды, но и белки с массой 3500 и 11000 дальтон играют важную роль в обеспечении поверхностной активности. Протеины А и В в комплексе с липидами образуют поверхностно-активные липопротеиды, а в комплексе с углеводами участвуют в выстилке альвеол.
Задача.
Холестерин легко встраивается в мембрану. Предложите механизмы удаления избытка холестерола из мембраны, исходя из строения молекулы данного вещества.
Ответ: Холестерин – амфифильное вещество с преобладанием гидрофобных свойств. При его этерификации под действием фермента ацилхолестеролацилтрансфераза (АХАТ) образуется эфир, менее растворимый в липидном бислое. Кроме того, избыточный холестерин из мембран клеток эндотелия акцептируется ЛПВП.
Билет 13
Биосинтез глюкозы (глюконеогенез). Субстраты, энергетические затраты, регулируемые ферменты. Цикл Кори.
Кортизол: химическая природа, механизм действия, органы- мишени, биологические эффекты.
Молекулярные механизмы патогенеза острого панкреатита
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот. Все аминокислоты, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани.

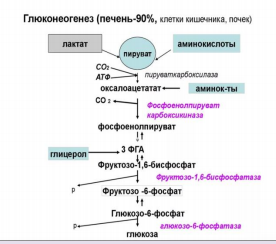
На карбоксилирование 2 молекул пирувата затрачивается 2 молекулы АТФ. Далее 2 молекулы ГТФ требуются для образования фосфоенолпирувата из оксалоацетата. И ещё 2 молекулы АТФ необходимы для фосфорилирования 2 молекул 3-фосфо- глицерата до 1,3-бисфосфоглицерата. Энергия восстановительных эквивалентов (NADH) нужна для образования глицеральдегид-3-фосфата. Итак, в ходе глюконеогенеза затрачивается 12 молекул АТФ.
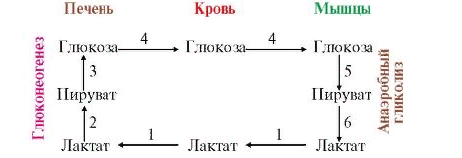
Использование лактата в качестве субстрата в глюконеогенезе связано с транспортом его в печень и превращением в пируват. В период мышечного сокращения в мышце пируват превращается в лактат, так как направление лактатдегидрогеназной реакции в работающих мышцах и печени обусловлено преобладанием восстановленной формы - NADH над окисленной формой NAD+ из-за недостатка кислорода. Лактат из мышцы транспортируется в печень, где он превращается в пируват (благодаря хорошему снабжению кислородом О2 и высокому содержанию NAD+, а затем в глюкозу (в процессе глюконеогенеза), которая поступит с током крови в мышечную ткань и эритроциты. Эту последовательность событий называют глюкозолактатным циклом или циклом Кори.
Кортизол гормон стероидной природы, синтезируется из холестерина в корковом веществе надпочечников.
Механизм действия – цитозольный. Кортизол, действуя на кл-ки печени, усиливает глюконеогенез; это происходит в результате индукции синтеза регуляторных ферментов глюконеогенеза, а также повышенного поступления в кровь субстратов для биосинтеза глюкозы (аминк-т, глицерина).
Клетки мишени: гепатоциты, миоциты, клетки жировой ткани, ЦНС, соединительной, лимфоидной, костной, слюнные железы, гонады, РЭС.
Биологический эффект:
анаболически – в печени: активация ферментов глюконеогенеза, (активирует ферменты превращения аминокислот: пируваткарбоксилазу, ФЕП-карбоксикиназу, триптофанпиролазу, сериндегидротазу, треониндегидротазу, тирозинаминотрансферазу, аланинаминотрансферазу); синтеза гликогена, липогенеза, синтеза нуклеиновых кислот и белков; в мышцах, жировой, соединительной, лимфоидной и костной тканях – усиление катаболизма.
При высокой концентрации кортизол и его аналоги подавляют иммунные реакции, вызывая гибель лимфоцитов; подавляют воспалительную реакцию, снижая число лейкоцитов; индуцируют синтез липокортинов, которые ингибируют фофолипазу А2, снижая таким образом синтез медиаторов вопаления – простагландинов и лейкотриенов; торможение роста и деления фибробластов, коллагена и фибронектина.
Главным механизмом развития острого панкреатита служит преждевременная активация панкреатических ферментов. Это происходит из-за гиперстимуляции экзокринной функции железы, повышения давления в протоке, закупорки ампулы большого дуоденального сосочка.
Задача.
Лечебные препараты лидаза и ронадаза содержат фермент гиалуронидазу. C какой целью можно использовать эти препараты?
Ответ: Показаниями для их применения являются рубцы после ожогов и операций, тугоподвижность суставов после воспалительных процессов и травм, спаечная болезнь. Во всех этих случаях гиалуронидаза обеспечивает расщепление гиалуроновой кислоты в составе спаек, рубцов, способствуя их рассасыванию.
Билет 14
Липопротеины высокой плотности: формирование, функции и метаболизм
Функции сосудистого эндотелия, субэндотелия и тромбоцитов. Сосудисто-тромбоцитарный гемостаз (первичный). Участие тромбоксана и простациклина в регуляции первичного гемостаза.
Лабораторная диагностика панкреатитов.
Липопротеины высокой плотности — класс липопротеинов плазмы крови. ЛПВП обладают антиатерогенными свойствами. Так как высокая концентрация ЛПВП существенно снижает риск атеросклероза и сердечно-сосудистых заболеваний, холестерин ЛПВП иногда называют «хорошим холестерином» (альфа-холестерином) в отличие от «плохого холестерина» ЛПНП, который, наоборот, увеличивает риск развития атеросклероза. ЛПВП обладают максимальной среди липопротеинов плотностью из-за высокого уровня белка относительно липидов.
Частицы ЛПВП синтезируются в печени из аполипопротеинов А1 и А2, связанных с фосфолипидами. В крови такие частицы взаимодействуют с другими липопротеинами и с клетками, быстро захватывая холестерин и приобретая зрелую сферическую форму. Холестерин локализуется на липопротеине на его поверхности вместе с фосфолипидами. Однако фермент лецитинхолестеринацилтрансфераза (ЛХАТ) этерифицирует холестерин до эфира холестерина, который из-за высокой гидрофобности проникает в ядро частицы, освобождая место на поверхности.
Липопротеины высокой плотности (ЛПВП) синтезируются в эритроцитах и печени и вначале не содержат холестерина. Метаболизм ЛПВП достаточно сложен, но основной их функцией является извлечение холестерина из периферических тканей и других липопротеинов и его транспорт туда, где он более всего необходим: в другие клетки, другие липопротеины [с помощью белка-транспортера эфиров холестерина (СЕТР)] и печень (для клиренса).
Основные функции сосудистого эндотелия: регуляция величины сосудистого тонуса и сосудистого сопротивления, текучести крови, ангиогенеза; реализация процесса воспаления (Сосудистый эндотелий также вырабатывает факторы, влияющие
на развитие и течение воспаления).
Роль субэндотелия: большая часть компонентов субэндотелия синтезируется и секретируется эндотелиальными клетками. Клетки, находящиеся под эндотелием (макрофаги, фибробласты), имеют на поверхности тканевой фактор (тканевой тромбопластин). При связывании тканевого фактора с фактором VIIa и при наличии ионов Ca2+ формируется комплекс, активирующий фактор Х. Эта реакция является пусковой для процесса свертывания крови.
Тромбоциты выполняют следующие функции: 1. Ангиотрофическую, т.е. способствуют поддерживать нормальную структуру и функцию стенок микрососудов; 2. Адгезивно-агрегационную - способность образовывать в поврежденных сосудах первичную тромбоцитарную пробку 3. Выделяют местные вазоконстрикторы для уменьшения кровотока в пораженном участке (спазм кровеносных сосудов); 4. Катализируют реакции гуморальной системы свертывания с образованием в конечном счете фибринового сгустка; 5. Инициируют репарацию тканей, регулируют местную воспалительную реакцию и иммунитет.
Сосудисто-тромбоцитарный гемостаз.
Роль:1) обеспечивает остановку кровотечения из сосудов микроциркулярного русла и в сосудах с низким АД; 2) является предфазой коагулляционного гемостаза.
Фазы:
1. Рефлекторный спазм поврежденных сосудов. Обеспечивается БАВ, которые выделяются из разрушенных тромбоцитов (серотонин, НА, Адр.) – временно прекращают кровотечение. Эта реакция увеличивается при охлаждении поврежденного участка.
2.Спазм сосудов дополняется: адгезией тромбоцитов.
3 стадия. Обратимая агрегация (скучивание) тромбоцитов. Начинается почти одновременно с адгезией. Катализатор этого процесса АДФ, выделяемая из поврежденных тканей сосуда – внешняя АДФ, из тромбоцитов и эритроцитов – «внутренняя». Образуется рыхлая тромбоцитарная пробка, пропускающая плазму – белый тромб.
4 стадия. Необратимая агрегация – тромбоцитарная пробка становится непроницаемой для плазмы. Происходит это под влиянием тромбина, который меняет структуру мембраны тромбоцитов, и они сливаются в гомогенную массу.
5 Ретракция белого тромба. Это сокращение и уплотнение белого тромба, за счет сокращения нитей фибрина. Этим путем (сосудисто-тромбоцитарным) останавливается кровотечение из сосудов МЦР за 3–4 минуты при бытовых травмах.

Задача.
В крови пациента обнаружена повышенная концентрация неконъюгированного билирубина. Как иначе называется это вещество, каковы его свойства? На основании, каких симптомов, выявленных у пациента, врач назначил этот анализ? Назовите возможные причины повышения концентрации неконъюгированного билирубина в крови.
Ответ: Непрямой (лабораторный сленг – для количественного определения данного метаболита реакцией с диазореактивом Эрлиха требуется предварительное осаждение метанолом), свободный билирубин. Жирорастворим, токсичен, транспортируется с альбуминами. На основании желтушной окраски слизистых оболочек и кожи пациента. Повышение концентрации неконъюгированного билирубина имеет место при надпечёночной желтухе, при врождённых дефектах систем его захвата и конъюгации в гепатоцитах.
Билет 15
Переваривание белков в желудочно-кишечном тракте. Биологическое значение переваривания. Схема процесса. Характеристика пищеварительных ферментов.
Строение и состав мембран. Общие свойства мембран и их функции.
Патогенетические особенности нейродегенеративных заболеваний нервной системы.
Переваривание белков начинается в полости желудка и продолжается в тонкой кишке. Реакции расщепления катализируют ферменты (пептидазы) пептидных связей пептидгидролазы. Они синтезируются в клетках желудка, поджелудочной железы и тонкой кишки. Пептидазы обладают относительной субстратной специфичностью, но преимущественно гидролизуют пептидные связи, образованные определенными аминокислотами.
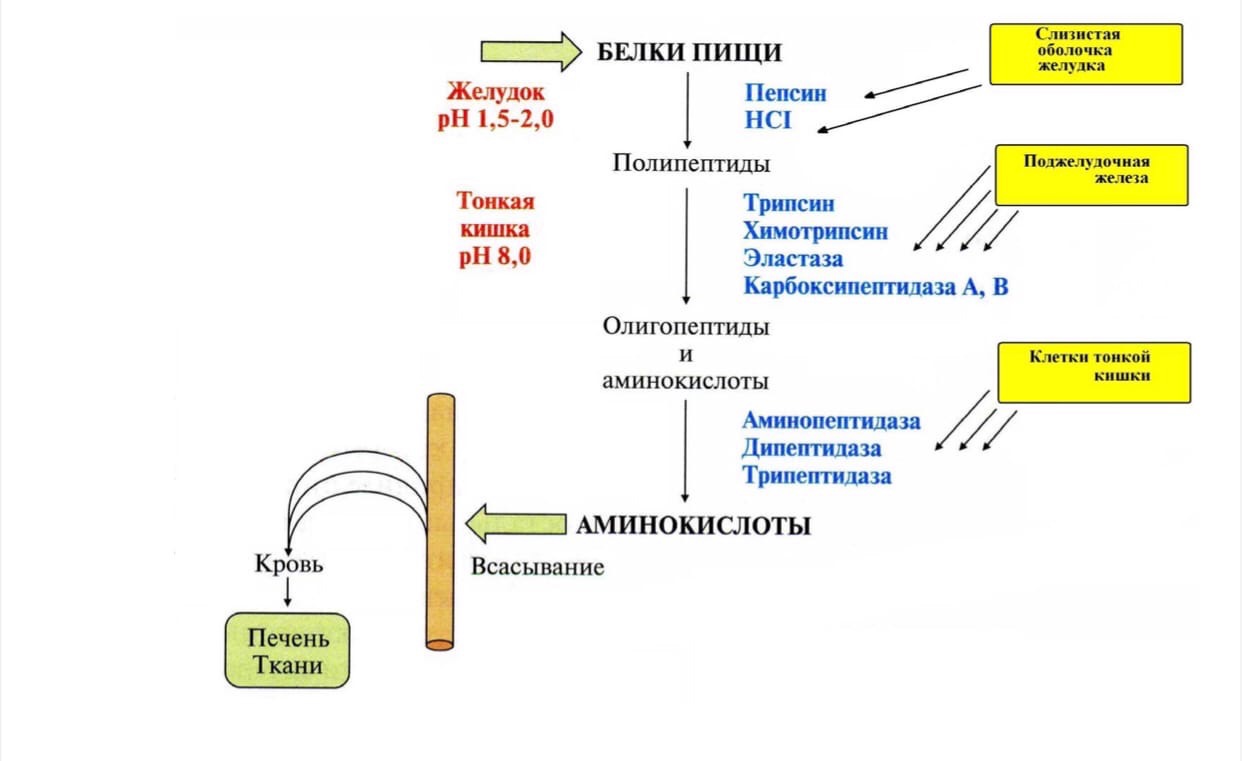
Переваривание белков в желудке: Происходит при участии фермента пепсина: Профермент пепсиноген синтезируется желудочными железами и при поступлении пищи секретируется в полость желудка. В желудочном соке пепсиноген превращается в активный фермент пепсин путем частичного протеолиза. В пищевых белках пепсин гидролизует связи, образованные аминогруппой ароматических аминокислот Фенилаланина и Тирозина, а также Глутаминовой кислоты и Аспарагин с любой другой аминокислотой.
В результате образуются полипептиды, которые поступают в тонкую кишку.

Завершающий этап переваривания – гидролиз небольших пептидов до свободных аминокислот происходит в пристеночном слое либо уже в клетках кишечника после их всасывания. Ферменты завершающего этапа: аминопептидаза, дипептидаза, трипептидаза синтезируются в клетках тонкой кишки сразу в активной форме. Это связано с тем, что эти ферменты действуют только на короткие пептиды, не оказывая никакого влияния на белки и не опасны для белков кишечника. Аминопептидаза отщепляет N-концевые остатки аминокислот от олигопептидов. Ди- и трипептидазы, расщепляют ди- и трипептиды до свободных аминокислот. Образовавшиеся свободные аминокислоты поступают в кровь воротной вены, затем в клетки печени и затем в другие ткани. В тканях аминокислоты используются для синтеза белков и различных биологически активных в-в или вступают в реакции катаболизма.
Функции биологических мембран:
1. Отграничивают содержимое клетки от внешней среды и содержимое органелл от цитоплазмы.
2. Обеспечивают транспорт веществ в клетку и из нее, из цитоплазмы в органеллы и наоборот.
3. Выполняют роль рецепторов (получение и преобразование сигналов из окружающей среды, узнавание веществ клеток и т. д.).
4. Являются катализаторами (обеспечение примембранных химических процессов).
5. Участвуют в преобразовании энергии.

Основу мембраны составляет двойной липидный слой, в формировании которого участвуют фосфолипиды и гликолипиды. Липидный бислой образован двумя рядами липидов, гидрофобные радикалы (хвосты) которых спрятаны внутрь, а гидрофильные группы (головки) обращены наружу и контактируют с водной средой. Белковые молекулы как бы "растворены" в липидном бислое.
Липиды составляют 40-50%, белки 50-60% структуры мембран.
На внешней стороне мембраны имеется слой мукополисахаридов (гликокаликс).
В фосфолипидном слое находятся белки:
Периферические – на поверхности мембраны;
Полуинтегральные – полупогружены в липидный слой мембраны;
Интегральные – проходят через всю толщу мембраны.
На случай доп вопросов: Липидный состав мембран:
Фосфолипиды. Все фосфолипиды можно разделить на 2 группы - глицерофосфолипиды и сфингофосфолипиды. Наиболее распространённые глицерофосфолипиды мембран - фосфатидилхолины и фосфатидилэтаноламины. Сфингомиелины построены на основе церамида - ацилированного аминоспирта сфингозина. Полярная группа состоит из остатка фосфорной кислоты и холина, этаноламина или серина. Сфингомиелины - главные липиды миелиновой оболочки нервных волокон.
Гликолипиды. В гликолипидах гидрофобная часть представлена церамидом. Гидрофильная группа - углеводный остаток, присоединённый гликозидной связью к гидроксильной группе у первого углеродного атома церамида. В зависимости от длины и строения углеводной части различают цереброзиды, содержащие моно- или олигосахаридный остаток, и ганглиозиды, к ОН-группе которых присоединён сложный, разветвлённый олигосахарид, содержащий N-ацетилнейраминовую кислоту.
Холестерол. Холестерол присутствует во всех мембранах животных клеток. Его молекула состоит из жёсткого гидрофобного ядра и гибкой углеводородной цепи, единственная гидроксильная группа является "полярной головкой".
Белки мембран: принято делить на интегральные (трансмембранные) и периферические. Интегральные белки имеют обширные гидрофобные участки на поверхности и нерастворимы вводе. С липидами мембран они связаны гидрофобными взаимодействиями и частично погружены в толщу липидного бислоя, а зачастую и пронизывают бислой, оставляя на поверхности сранительно небольшие гидрофильные участки.
Нейродегенеративыные заболевания – прогрессирующая гибель нервных клеток.
