
Атлас по патофизиологии Войнов
.pdf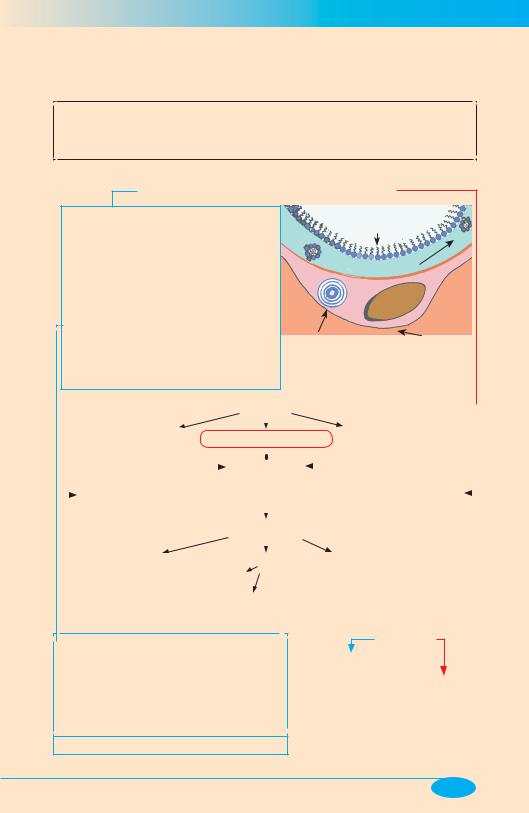
Сурфактант и синдром острого повреждения легких
Синдром острого повреждения легких (СОПЛ) — это полиэтиологическая форма патологии системы внешнего дыхания, проявляющаяся в развитии тяжелой дыхательной недостаточности вследствие поражения альвеоло-капиллярных мембран.Ключевую патогенетическую роль в развитии СОПЛ играет недостаточность сурфактанта легких
«СУРФАКТАНТ»:
сурфактантная система + антисурфактантная система
Сурфактантная система включает в себя:
1.Клетки-продуценты поверхностно-актив- ных веществ легких (ПАВл):
• альвеолоциты II типа,
• бронхиальные клетки Клара,
• альвеолярные макрофаги
2.Выстилающий комплекс на поверхности альвеол:
• монослой ПАВл, состоящий, в основном, из фосфолипидов (85%), а также белков, полисахаридов, холестерина и жирных кислот
• гипофаза — коллоидная система, состоящая из воды и находящихся в ней в виде мицелл ПАВЛ (резерв)
Просвет альвеолы легкого Гипо- Монослой ПАВл фаза
 Мицеллы ПАВл
Мицеллы ПАВл
|
Ядро |
Ламеллярное тельце |
Альвеолоцит |
(плотно упакованный |
(АЦ) II типа |
синтезированный |
|
сурфактант) |
|
|
|
|
|
|
|
|
Антисурфактантная система |
|
|
|
|
|
|
|
|||||||
|
|
|
Фагоцитоз |
|
|
|
|
|
|
|
|
|
|
|
|
|
Мукоцилиарный клиренс |
|
|||
|
|
|
отработанного |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
сурфактанта |
|
|
|
Фосфолипазный механизм |
(перемещение отработанного |
|
||||||||||||
|
|
|
|
|
|
сурфактанта в зону активного |
|
||||||||||||||
|
|
|
альвеолярными |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мукоцилиарного транспорта |
|
||||||
|
макрофагами с помощью |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
– |
|
|
|
|
|
– |
по градиенту поверхностной– |
|
|||||||||||
|
|
scavenger-рецепторов |
|
|
Фосфолипаза А2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
плотности ПАВЛ) |
|
||||||||
|
+ |
|
|
|
|
|
|
|
(источник — |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Липокортин-1 |
|
|
|
|
|
бронхиальные |
|
|
|
|
|
|
Трипсин, хемотрипсин |
|
|
||||
|
|
|
|
|
|
|
|
клетки Клара) |
|
|
|
|
|
|
и др.протеазы, |
|
|||||
|
|
|
(синтезируется |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обнаруживаемые |
|
||||
|
|
|
альвеолоцитами, |
|
|
|
|
Фосфолипиды |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
в бронхиальных |
|
|||||||
|
|
|
эндотелиоцитами) |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
монослоя |
ПАВл |
|
|
|
|
|
|
и альвеолярных смывах |
|
|||||
|
|
|
Лизофосфатиды |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Арахидоновая |
|
Жирные |
|
|
Антипротеазы: |
|
|
|
||||||
|
|
|
(* реутилизируются |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
Лейкотриены |
кислота |
|
кислоты |
|
|
*α1 — антитрипсин, |
|||||||||||
|
|
|
при синтезе ПАВЛ; |
|
|
|
|
||||||||||||||
|
|
|
*активируют митоз |
(ЛТВ4, ЛТС4, ЛТД4,) |
|
|
(* источник |
*α1 — антихемотрипсин, |
|||||||||||||
|
|
|
АЦ II типа) |
|
Простагландины, |
|
|
энергии для |
*α2 — макроглобулин… |
||||||||||||
|
|
|
|
|
|
АЦ II типа ) (источник — секреторные |
|||||||||||||||
|
|
|
Глюкокортикоиды |
|
в т.ч. тромбоксан А2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
клетки бронхиол) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||


 Сурфактант — ассоциированные белки (СБ): CБ - А (прочно связан с фосфолипидами): участвует в формировании ПАВл,
Сурфактант — ассоциированные белки (СБ): CБ - А (прочно связан с фосфолипидами): участвует в формировании ПАВл, реутилизацию Ац II, защищает сурфактант от ингибирующего действия сывороточных белков, обладает опсонизирующим действием.
реутилизацию Ац II, защищает сурфактант от ингибирующего действия сывороточных белков, обладает опсонизирующим действием.
СБ - D (слабо связан с фосфолипидами) — это опсонин. СБ - C, СБ - B — стабилизаторы ПАВл .
СБ - С — маркер пневмоцитов II типа !
СИНТЕЗ ПАВЛ
Стимуляторы:
•Глюкокортикоиды
•Катехоламины
•Т3 ,Т4.
•Эстрогены
•Эндорфины
•Эндотелин
•Вазопрессин
•Pg Е2 ….
Ингибиторы:
•Инсулин
•Ацетилхолин
•СБ - А
151
Синдром острого повреждения легких. Острый респираторный дистресс-синдром
Синдром острого повреждения легких [СОПЛ] (син.: «респираторный дистресс-синдром», |
||
«шоковое легкое»,«синдром гиалиновых мембран» «постперфузионное легкое», «посттравма- |
||
тическое легочное повреждение», является постоянным спутником любой острой хирургичес- |
||
кой и соматической патологии и во многом определяет |
|
|
Частота СОПЛ |
||
течение и исходы экстремальных состояний организма. |
||
( по России , в среднем): |
||
Критерии СОПЛ |
у 15 % больных с острой хирурги- |
|
(Американо-Европейская |
ческой или соматической патоло- |
|
согласительная комиссия по СОПЛ): |
гией ! |
|
1. Острое развитие. |
23 случая в год на 1000 больных в |
|
реанимационных отделениях ! |
||
2. Гипоксемия. Индекс оксигенации < 300 мм рт. ст. |
||
|
||
3.Давление заклинивания в легочной артерии ( ДЗЛА) <18 мм рт. ст.
4.Билатеральная инфильтрация легких на рентгенограмме грудной клетки.
Респираторный дистресс-синдром (РДС)
/ наиболее тяжелый вариант синдрома острого повреждения легких /
Индекс оксигенации < 200 мм рт. ст. !
РДС новорожденных |
РДС взрослых |
||
(первичный) |
(вторичный) |
||
|
|
|
|
|
|
|
|
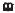 Индекс оксигенации = раО2 / FiO2
Индекс оксигенации = раО2 / FiO2
(в N не ниже 360–400 мм рт. ст.), где
раО2 — парциальное напряжение кислорода в артериальной крови; FiO2 — фракция О2 во вдыхаемом воздухе (в N = 0,2).
Причины РДСВ
•Шоковые состояния.
•ДВС-синдром.
•Диффузные легочные инфекции (бактериальные, вирусные, грибковые…)
• Травмы грудной клетки |
|
Альвеола |
|
(контузии легких). |
1 |
|
|
• Обширные хирургические |
2 |
||
вмешательства. |
|
||
|
|
||
• Постреанимационная болезнь. |
|
5 |
|
• Аспирация воды, желудочного |
|
||
3 |
4 |
||
содержимого. |
|||
• Ингаляционный наркоз |
|
|
|
(например, фторотановый). |
|
|
|
• Неадекватная ИВЛ. |
Альвеола |
|
|
• Кислородотерапия. |
Альвеола |
||
• Массивная гемотрансфузия. |
|
|
|
• Передозировка ряда лекарств |
|
|
|
(напр. метадона, морфина, |
|
|
|
барбитуратов, некоторых |
|
|
|
кардиоваскулярных |
Макро– и микроскопическая |
||
медикаментов)… |
картина легкого при РДС: |
||
|
|||
1 — гетерогенность нарушений: утолщение и распад альвеолокапиллярных мембран, спадение и перерастяжение альвеол;повышение проницаемости мембран
(в просвете альвеол — эритроциты, фибрин); 2 — интерстициальный отек; 3 — гиалиновые мембраны (выстилка из белков и некротизированных пневмоцитов; 4 — альвеолярный отек (по стрелке - некротические массы, 5 — множественные подплевральные кровоизлияния («влажное легкое»).
Стадии развития РДСВ
I стадия
(конец первых – начало вторых суток)
•Начальные признаки гипоксии (эйфория, тахикардия,тахипноэ);
•На рентгенограмме — усиление легочного рисунка, мелкоочаговые
тени.
При правильном лечении летальность близка к нулю!
II стадия
(начинается на 2–3 сутки)
•Выраженная одышка
•Ослабленное дыхание (аускультативно)
•На рентгенограмме: выраженные очаговые тени, иногда сливного характера.
Летальность — до 40%
III стадия
(развивается на 4–5 сутки)
•Спутанное сознание
•На рентгенограмме: снижение прозрачности легочных полей.
•Перевод больных на ИВЛ.
IV стадия — терминальная
Летальность — до 100%
152

Респираторный дистресс-синдром взрослых
Респираторный Дистресс-Синдром Взрослых (РДСВ), франц. — Syndrome de Détresse Respiratoire Aiguë (SDRA) ; англ. — Acute Respiratory Distress Syndrome (ARDS)
Дефицит «сурфактанта» I + II + III + IV:
I + II + III + IV:
I. Альвеолярная гиповентиляция
А. Рестриктивный компонент
[ поверхностного натяжения (ПН) выстилающего слоя альвеол
поверхностного натяжения (ПН) выстилающего слоя альвеол эластического сопротивления дыханию
эластического сопротивления дыханию спадение альвеол (ателектазирование)
спадение альвеол (ателектазирование) перекачка воздуха из коллабированных альвеол в смежные альвеолы, их перерастяжение = нарушение стабильности альвеолярного пространства
перекачка воздуха из коллабированных альвеол в смежные альвеолы, их перерастяжение = нарушение стабильности альвеолярного пространства
 альвеолярной вентиляции + риск развития синдрома «утечки воздуха»,т. е. баро/волюмотравмы легких в условиях проведения ИВЛ ].
альвеолярной вентиляции + риск развития синдрома «утечки воздуха»,т. е. баро/волюмотравмы легких в условиях проведения ИВЛ ].
Б. Обструктивый компонент
[ продольного градиента поверхностно-активных веществ(ПАВ)
продольного градиента поверхностно-активных веществ(ПАВ) нарушение санации дыхательных путей (ДП), т.е.перемещения слизи, отмершего эпителия, микробных клеток в зону мукоцилиарного транспорта
нарушение санации дыхательных путей (ДП), т.е.перемещения слизи, отмершего эпителия, микробных клеток в зону мукоцилиарного транспорта закупорка ДП
закупорка ДП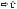 неэластического сопротивления дыханию
неэластического сопротивления дыханию гиповентиляция + риск инфицирования легких].
гиповентиляция + риск инфицирования легких].
[ ПН выстилки нижних ДП (начиная с 17 генерации)
ПН выстилки нижних ДП (начиная с 17 генерации) их спадение
их спадение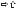 неэластического сопротивления дыханию
неэластического сопротивления дыханию активный выдох
активный выдох повышение транспульмонального давления
повышение транспульмонального давления компрессия нижних ДП
компрессия нижних ДП гиповентиляция легких [ бронхиолоспазм вследствие действия лейкотрие-
гиповентиляция легких [ бронхиолоспазм вследствие действия лейкотрие-
нов (С4, D4 ) — продуктов деградации сурфактантных фосфолипидов].
II .Снижение «диффузии легких»
[ ПН выстилки альвеол, накопление биологичемски-активных веществ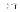 проницаемости мембран
проницаемости мембран «засасывание» жидкой части крови в интерстиций
«засасывание» жидкой части крови в интерстиций интерстициальный отек, формирование гиалиновых мембран ]
интерстициальный отек, формирование гиалиновых мембран ]
III . Нарушения легочной перфузии
[спаз сосудов легочной артерии при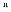 РАО2 (рефлекс Эйлера–Лильестранда);
РАО2 (рефлекс Эйлера–Лильестранда); синтеза проагрегантов из деградированного сурфакта (тромбоксан А2 , PgE2, PgF2)
синтеза проагрегантов из деградированного сурфакта (тромбоксан А2 , PgE2, PgF2) микротромбоз легочных сосудов;
микротромбоз легочных сосудов; шунтирования кровотока ]
шунтирования кровотока ]
IV. Нарушения регионарных вентиляционно – перфузионных отношений
[результат дестабилизации альвеол и расстройств микроциркуляции]
ДЫХАТЕЛЬНАЯ РДСВ НЕДОСТАТОЧНОСТЬ
СЕРДЕЧНАЯ
НЕДОСТАТОЧНОСТЬ
В. Нарушение регуляции дыхания |
|
ДВС-СИНДРОМ |
||
[ изменения легочного гистерезиса |
частое повер- |
|
|
|
хностное (малоэффективное) дыхание]. |
ЭНЦЕФАЛОПАТИЯ |
|||
Принципы респираторной поддержки при РДСВ |
ПЕЧЕНОЧНАЯ |
|
||
I. « Безопасная ИВЛ » |
НЕДОСТАТОЧ- |
|
||
Ограниченный ДО |
|
НОСТЬ |
|
|
|
|
|
||
(макс. объем вдоха — не больше 5 мл/кг !) |
|
|
||
Ограниченное давление |
|
|
|
|
(макс. — не более 35 см Н2О !) |
|
СИНДРОМ КИШЕЧНОЙ |
|
|
Ограниченная частота дыхания и скорость |
ПОЧЕЧНАЯ |
|||
НЕДОСТАТОЧНОСТИ |
||||
пикового инспираторного потока |
|
|
||
|
НЕДОСТАТОЧНОСТЬ |
|||
«Синхронизация» естественного дыхания и ИВЛ |
|
|
||
с помощью седативных средств и миорелаксантов |
ПОЛИОРГАННАЯ НЕДОСТАТОЧНОСТЬ |
|||
(а не гипервентиляцией !) |
|
|||
Применение ( в тяжелых случаях) ИВЛ |
Сурфактант-терапия |
|||
с положительным давлением в конце выдоха |
||||
(лечение «выбора» при РДСВ): |
||||
(ПДКВ) |
|
|||
|
болюсное эндобронхиальное введение |
|||
[до 6–8 см Н2О !] |
|
|||
|
различных сурфактантов: природных |
|||
II. «Безопасная гипоксия» |
||||
(выделенных из амниотической жидкости |
||||
РаО2 — не ниже 55 мм рт. ст.; SаО2 — не ниже 90% |
||||
плода или легких крупного рогатого скота); |
||||
III. «Допустимая гиперкапния» |
модифицированных природных, |
|||
Постепенное увеличение РаО2 до 60–70 мм рт. ст. |
синтетических (без белков). |
|||
|
|
|
153 |
|

Респираторный дистресс — синдром новорожденных(РДСН)
РДСН вследствие высокой частоты его развития и тяжелых последствий занимает особое место среди врожденных и генетически детерминированных форм патологии новорожденных детей. В патогенезе острой дыхательной недостаточности, составляющей основу РДСН,ведущая роль принадлежит первичному дефициту «сурфактанта» — дисбалансу между сурфактантной и антисурфактантной системами легких.
 Синтез сурфактанта начинается с 20–24 нед., а его полное созревание происходит к 35–36 нед. внутриутробного развития плода. В родовом периоде интенсивный выброс сурфактанта обеспечивает первый вдох новорожденного.
Синтез сурфактанта начинается с 20–24 нед., а его полное созревание происходит к 35–36 нед. внутриутробного развития плода. В родовом периоде интенсивный выброс сурфактанта обеспечивает первый вдох новорожденного.
|
Должный |
Масса |
дыхательный |
тела, кг |
объем, мл |
 Причины снижения синтеза
Причины снижения синтеза
|
|
|
сурфактанта:хроническая внут- |
|
|
|
риутробная гипоксия, сахар- |
|
|
|
ный диабет беременной, ост- |
|
|
|
рая асфиксия плода, кровопо- |
|
|
|
теря при родах, гиперинсули- |
|
|
|
немия, инфекции, вызванные, |
|
|
|
прежде всего, грамотрицатель- |
|
|
|
ными микроорганизмами, ми- |
|
|
|
коплазмой, вирусами. Важным |
|
|
|
предрасполагающим фактором |
|
|
|
к развитию РДСН является не- |
|
|
|
зрелость легкого недоношен- |
|
|
|
ного ребенка. |
Число дыханий |
|
Эмбрион 6 мес. |
|
в 1 мин |
(коллекция J.Escalier) |
||
|
Стадии |
|
|
|
I стадия — образование участков |
||
|
|
РДСН |
гиповентиляции легких и рассеянных |
|
|
|
ателектазов вследствие первичного |
|
|
|
дефицита «сурфакта» |
|
|
|
|
|
|
|
|
II стадия — повреждение эндотелия легочных капилляров вследствие прогрессирования дыхательной гипоксии и ацидоза проницаемость альвеоло-капиллярных мембран
проницаемость альвеоло-капиллярных мембран пропотевание жидкой части крови в просвет альвеол («отечно-геморрагический синдром легких»)
пропотевание жидкой части крови в просвет альвеол («отечно-геморрагический синдром легких»)
Номограмма Satter, Dudsiak для определения параметров ИВЛ новорожденных
III стадия — формирование т.наз.гиалиновых мембран |
|
из белков плазмы крови и некротизированного альвео- |
|
лярного эпителия.Ателектазы и гиалиновые мембраны |
|
приводят к образованию альвеолярно-капиллярного |
|
блока(значительному снижению или прекращение диффу- |
|
зионного потока О2 и СО2 через альвеоло-капиллярные |
|
мембраны). |
Нормализация газового состава |
|
|
|
|
|
|
крови может быть достигнута |
|
|
|
|
|
искусственной вентиляции |
Частота развития РДСН |
|
|
|
|
легких (ИВЛ) и оксигенотерапией |
|
|
|
Бронхолегочная дисплазия (БД) |
||
зависит от степени |
|
|
|
||
недонашивания и составляет |
|
|
Это вариант хронической обструктивной болезни детей |
||
в среднем 60% у детей, |
Неблагоприятные исходыРДСН |
раннего и дошкольного возраста, сопровождающейся не- |
|||
выхаживании таких детей |
недостаточного знакомства врачей с данной формой пато- |
||||
родившихся при сроке |
|
|
обратимым нарушением проходимости дыхательных путей. |
||
беременности менее 28 нед, |
|
|
Являясь следствием РДСН, а также вынужденного длитель- |
||
15–20% — при сроке 32–36 нед |
|
|
ного применения ИВЛ, интенсивной оксигено-терапии, БД |
||
и 5% — при сроке 37 нед |
|
|
представляет серьезную проблему современной медицины |
||
и более. При рациональном |
|
|
вследствие своей тяжести, большой распространенности и |
||
летальность |
|
|
логии. |
||
|
|
||||
приближается к 10%. |
|
|
|
|
Смерть новорожденного |
|
|
|
|
||
154
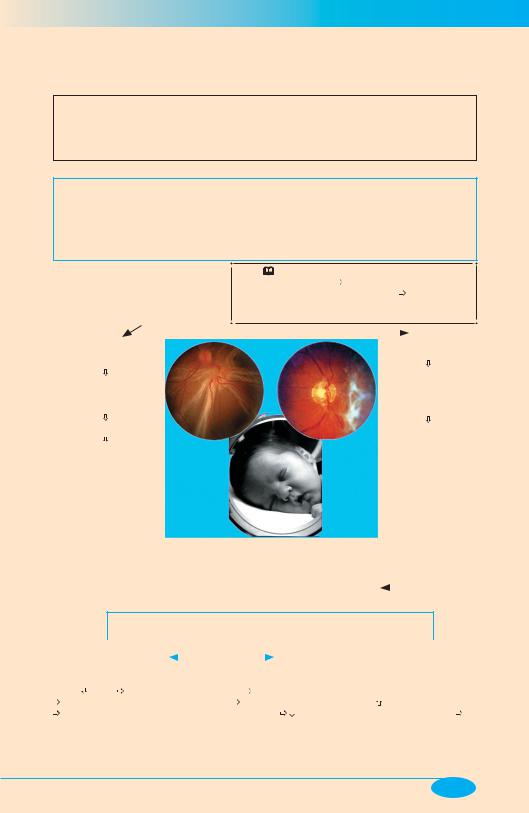
Патогенное действие гипероксигенации при РДСН
Гипероксигенация (использование кислорода в больших концентрациях или при высоком барометрическом давлении), проводимая с профилактической или лечебной целью при РДСН, нередко оказывает патогенное действие на организм, выражающееся, чаще всего, в развитии оксидативного стресса (острая форма расстройств) и ретинопатии
недоношенных (хроническая форма расстройств).
Ретинопатия недоношенных
(син. «ретролентальная фиброплазия», « захрусталиковая фиброплазия) — тяжелое поражение сетчатки, детерминированное вынужденным длительным (несколько дней – недели) использованием оксигенотерапии (не менее 40% О2 в газовой смеси) для обеспечения жизнедеятельности преждевременно родившихся детей
(часто, с проявлениями респираторного дистресс-синдрома).
Факторы риска: |
Норма: «Физиологическая» ГИПОКСИЯ |
|||||||
1. Преждевременные роды (≤ 30 нед.); |
плода/новорожденного Стимуляция синтеза факторов |
|||||||
2. Низкий вес новорожденного (≤ 1,5 кг); |
роста нервными волокнами ретины ВАЗОГЕНЕЗ |
|||||||
|
|
|
|
(рост и развитие функционально полноценных сосудов |
||||
|
Патогенез ретинопатии |
сетчатки) |
|
|
|
|
||
I этап |
|
|
|
|
|
II этап |
||
|
|
|
|
|
Отмена |
|||
Оксигенотерапия недо- |
|
|
|
|
оксигенотерапии |
|||
ношенного ребенка |
|
|
|
|
|
|
|
|
Устранение гипоксичес- |
|
|
|
Ишемия по периферии |
||||
|
|
|
сетчатки (последствие |
|||||
кого стимула продукции |
|
|
|
|
прекращения вазо- |
|||
факторов роста |
|
|
|
|
|
генеза) |
||
Прекращение вазогенеза |
|
|
|
|
«Компенсаторное» |
|||
Недостаточная сосу- |
|
Отслойка |
|
|
|
включение |
||
|
|
|
АНГИОГЕНЕЗА |
|||||
дистая обеспеченность |
|
сетчатки |
Пролифе- |
(неконтролируемой |
||||
|
(отслоенная |
|||||||
сетчатки |
|
|
неоваскуляризации |
|||||
|
сетчатка |
ративная |
|
|||||
(в основном, ее пери- |
|
собрана |
ретино- |
сетчатки с образова- |
||||
ферии). |
|
в складки) |
нием функционально |
|||||
|
патия |
|||||||
[В условиях гипероксии |
|
(У многих детей |
|
неполноценных |
||||
|
|
|
||||||
данный недостаток |
|
развивается |
|
сосудов из ранее сфор- |
||||
не проявляется] |
|
близорукость) |
|
мированных сосудов) |
||||
|
|
|
|
|
с последующей про- |
|||
|
|
|
Врастающие в стекловидное тело сосуды |
|||||
|
|
|
лиферацией соедини- |
|||||
|
|
|
и волокна соединительной ткани «отдирают» |
|||||
|
|
|
|
тельной ткани |
||||
|
|
|
сетчатку (отслойка сетчатки) и вызывают |
|
||||
|
|
|
|
|
|
|
||
|
|
|
помутнение стекловидного тела = ретинопатия |
|
|
|
|
|
|
|
|
недоношенных (развивается в 30–60% случаев) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оксидативный стресс-расстройства, детерминированные острым токсическим действием кислорода
|
|
|
|
|
|
|
|
Нарушения функции ЦНС |
|
|
|
|
Респираторный дистресс-синдром |
||
|
|
|
|
||||
(в условия дыхания «чистым» О2 при Рбар ≥2 атм): |
(дыхание газовой смесью, где О2 ≥ 60% |
||||||
Дисбаланс тормозных и возбуждающих нейромедиа- |
при Рбар – N) вследствие: 1) повреждения |
||||||
торов ( ГАМК ) генерализованные судороги |
сурфактанта; 2) физического эффекта |
||||||
истощение нейромедиаторного аппарата |
вдыхания «чистого» О2: диффузия О2 кровь |
||||||
«постсудорожная» кома с последующим |
Рбар в дыхательных путях и альвеолах |
||||||
постепенным восстановлением функции ЦНС |
«засасывание» в них жидкости и форменных |
||||||
(необратимые повреждения нейронов отсутствуют) |
элементов крови… |
||||||
|
|
|
|
|
|
(с участием Е.Б. Тезикова) |
|
155
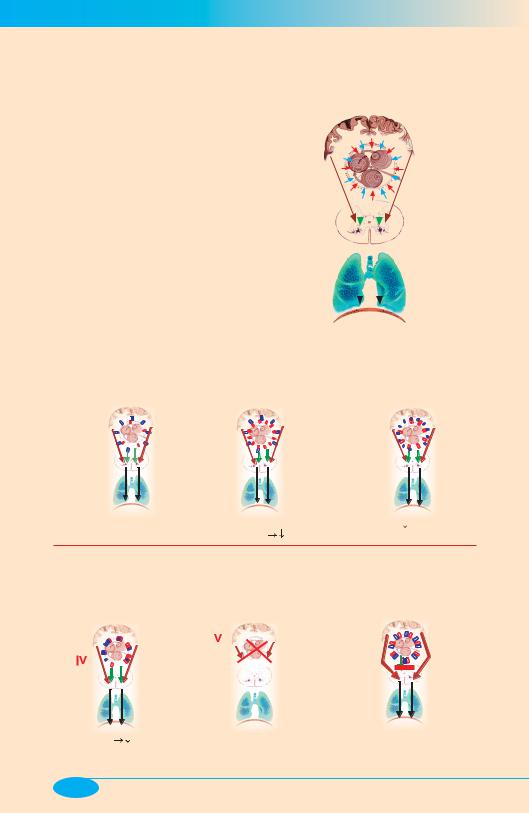
Нарушения регуляции дыхания
 Исходные положения:
Исходные положения:
1.Продолговатый мозг имеет все необходимое для дыхательного ритмогенеза.
2.Дыхательный центр (ДЦ), располагаясь на «перекрестке» нисходящих и восходящих нервных потоков, постоянно подвергается возбуждающим и тормозящим нервным воздействиям.
3.Ритмогенез возможен при условии, что «алгебраическая» сумма нервных потоков, устремленных к ДЦ, имеет положительное значение и превышает некий пороговый уровень.
4.Ритмическая афферентация с рецепторов растяжения легких (вагусный контроль) и грудной клетки не является ритмообразующей: эта афферентация лишь обеспечивает модуляцию дыхательного ритмогенеза.
|
|
|
|
ло |
в |
ног |
о |
|
|
|
|
|
о |
|
|
м |
|||
|
|
а |
г |
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
г |
|
о |
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
а |
|
К |
|
|
|
|
|
|
|
|
|
Кортико- |
|
|
|
|
|
|
|
|
Возбуждающие |
|
|
|
|
|
|
|
|
и тормозящие |
|
спинальный |
|
|
|
|
|
|
|||
|
|
|
|
|
|
воздействия |
|||
путь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на ДЦ |
|
Бульбо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мотонейроны |
||
спинальный |
|
|
|
|
|||||
тракт |
|
|
|
|
|
|
|
|
диафрагмальных |
|
|
|
|
|
|
|
|
||
n. phrenicus |
|
|
|
нервов |
|||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Диафрагма
Дефицит возбуждающей |
Избыток возбуждающей |
Избыток тормозной |
||||||
афферентации |
афферентации |
афферентации |
||||||
(асфиксия новорожденных, |
(стресс, истерия, термический |
(травма, воспаление плевры, |
||||||
наркоз, синдром Пиквика) |
ожог кожи…) |
межреберная невралгия, тригемино- |
||||||
|
|
|
|
|
вагусный рефлекс с верхних |
|||
|
|
|
|
|
дыхательных путей) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гипопноэ = (ØVА), апноэ |
Частое, поверхностное |
Гипопноэ = ( VА), апноэ |
(от греч. pnoē — дыхание) |
дыхание ( VА) |
|
Хаотическая |
Непосредственное |
Поражение |
афферентация |
поражение ДЦ |
бульбоспинального тракта |
(«вегетативные бури»: |
(опухоли, кровоизлияния, отек, |
(синдром проклятия Ундины — |
инфаркт миокарда, обширные |
охлаждение, гипоксическая |
нарушение автоматической |
ожоги, интоксикации) |
альтерация мозга; интоксикации) |
регуляции дыхания: травмы, |
|
|
кровоизлияния, сирингомиелия) |
|
|
VI |
Диспноэ ( VА) |
Апноэ |
Прекращение автоматического |
|
|
(непроизвольного) дыхания; сохранение |
|
|
произвольного (коркового) дыхания |
156
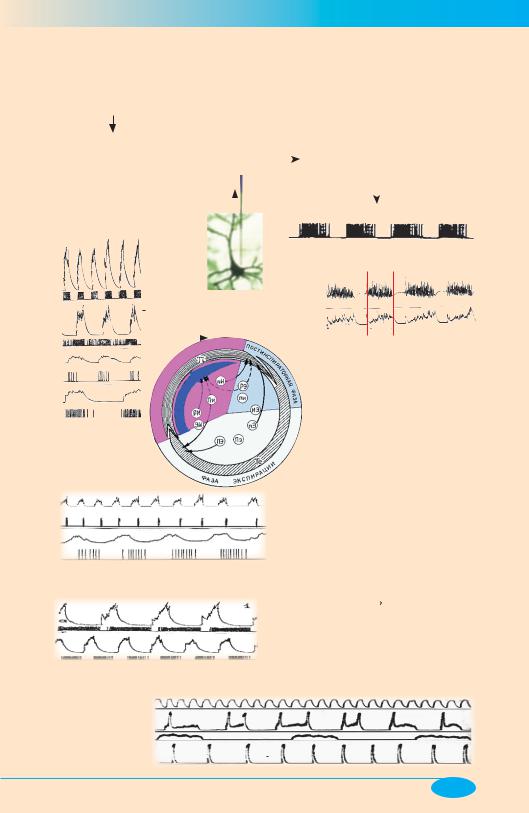
Нейрогенные механизмы патологических форм дыхания
Респираторные нейроны латеральной области продолговатого мозга, т.е. дыхательного центра (ДЦ)
Основные типы:
I. Популяция инспираторных нейронов (истинные ритмообразующие нейроны) = генератор
ритмогенеза ДЦ
ЭНГ
Микроэлектродный |
|
|
Амплитудный дискриминатор |
||
усилитель |
|
|
импульсов |
||
|
Микроэлектрод |
|
|
|
|
|
|
|
|
|
|
|
Запись импульсной активности нейрона |
||||
|
|
||||
|
|
|
|
Запись электронейрограммы (ЭНГ) |
|
|
|
|
|
диафрагмального нерва |
|
|
|
|
|
|
Нативная |
|
|
|
ЭНГ |
|
Фазы дыхательного цикла (по |
Усредненная |
|
|
|||
|
критерию активности респира- |
|
|
|||||
|
ЭНГ |
|
|
|||||
|
|
торных нейронов) |
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
|
вдох |
|
|
ЭНГ |
|
Фаза |
|
|
|
|
|
|
инспи- |
|
|
1. Формирование различных патологических |
|||||
|
рации |
|
|
типов дыхания обеспечивается теми же |
||||
|
|
|
|
|
||||
ЭНГ |
|
|
|
|
респираторными нейронами латераль- |
|||
|
|
|
|
ной области продолговатого мозга, ко- |
||||
|
|
|
|
|
торые функционируют при нормальном |
|||
|
|
|
нейроны |
дыхании. |
|
|
||
II. Популяция пост- |
|
|
2. Основным механизмом развития ды- |
|||||
|
|
ДЦ |
хания апнейстического |
типа является |
||||
инспираторных нейро- |
||||||||
|
|
нарушение процессов синхронизации и |
||||||
нов = ограничитель |
|
|
|
|
||||
«выключатель» генера |
|
|
самоограничения импульсной активности |
|||||
тора ритмогенеза ДЦ |
|
|
популяции инспираторных нейронов. |
|||||
|
|
|
|
|
Снижение активности экспираторных нейро- |
|||
|
|
|
|
|
нов усугубляет этот тип расстройств, т.к. при |
|||
ЭНГ |
|
|
|
|
этом инспираторные нейроны лишаются ла- |
|||
|
|
|
|
|
теральных возбуждающих связей (пассивный |
|||
ЭНГ |
|
|
|
|
механизм апнейзиса). Возрастание активности |
|||
|
|
|
|
|
постинспираторных |
нейронов |
ограничивает |
|
|
|
|
|
|
процесс нарастания амплитуды вдохов (актив- |
|||
III. Популяция так назыв. экспираторных нейронов |
ный механизм выключения вдоха). |
|||||||
(разновидность ретикулярных нейронов) = |
3. Основу дыхания типа гаспинг составляет |
|||||||
= активатор генератора ритмогенеза ДЦ |
выравнивание порогов возбудимости инспи- |
|||||||
|
|
|
|
ЭНГ |
раторных нейронов |
гиперсинхронизация |
||
|
|
|
|
активности нейронов, что обеспечивает не |
||||
|
|
|
|
|
||||
|
|
|
|
|
постепенное, как в норме, а практически одно- |
|||
|
|
|
|
ЭНГ |
временное «резонансное» вовлечение в про- |
|||
|
|
|
|
|
цесс возбуждения популяции инспираторных |
|||
нейронов.
4. При формировании различных переходных форм дыхания (эупноэ–гасп, апнейзис–гасп и др.) попеременно функционируют оба основных (см. п. 2,3) механизма генерации дыхательного ритма.
Эупноэ
Апнейзис + гасп
Апнейзис
Гаспинг
157
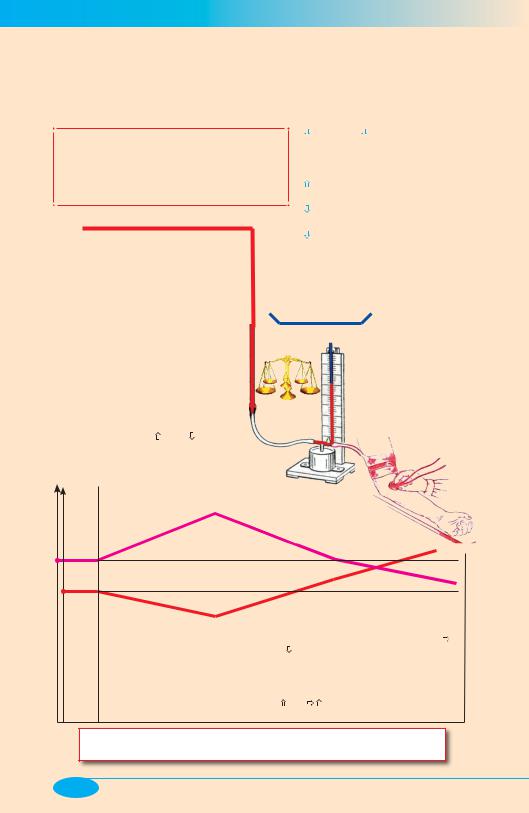
Гипертоническая болезнь (общие сведения)
Системное артериальное давление (АД) = f (МОС × ПС), где МОС (минутный объем сердца) = f (Ударный объем сердца × Частота/ритм/сила сокращений сердца × Объем циркулирующей крови); ПС (периферическое сопротивление кровотоку) = f (Диаметр [тонус] резистивных сосудов × × Реологические свойства крови)
Диагноз «гипертоническая болезнь» (ГБ) может быть поставлен лишь после исключения основных форм симптоматических артериальных гипертензий — метод «негативной диагностики».
Основные « факторы риска» ГБ :
•Наследственная предрасположенность (семейный анамнез — ранние формы сердечно-сосуд. болезней)
•Острые/хронические эмоциональные напряжения (стрессы), ведущие к срыву ВНД (неврозы)
•Мужской пол; менопауза у женщин
•Гиперхолестеринемия (уровень холестерина — выше 6,5 ммоль/л)
•Табакокурение
Дополнительные факторы риска:
•Гиподинамия (сидячий образ жизни)
•Избыточная масса тела (ожирение)
•Географический район проживания
•Сахарный диабет
• Дислипопротеинемии ( ЛПНП, ЛПВП)
• Дефицит эстрогенов
1.Массу тела ( общее потребление жиров, активный образ жизни).
2.Заменить в питании животные жиры растительными.
3.Потребление клетчатки и сложных углеводов (овощей, фруктов...).
4.Потребление продуктов, богатых холестерином.
5.Потребление NaCl.
6.Отказаться от табакокурения.
7.Отказаться от алкоголя.
|
|
(7 золотых правил!) |
||
|
|
|
Европейская |
|
Факторы |
ассоциация экспертов |
|||
«антириска» ГБ: |
|
|
||
|
|
|
|
|
|
|
АД (категории, |
АД мм рт. ст |
|
|
|
уровни) |
сист. |
диаст. |
|
|
Оптимальное |
<120 |
<80 |
|
|
Нормальное |
<130 |
<85 |
|
|
Высокаянорма |
130–139 |
85–89 |
|
|
IстепеньГБ |
140–159 |
90–99 |
|
|
IIстепеньГБ |
160–179 |
100–109 |
|
|
IIIстепеньГБ |
>180 |
>110 |
NМОС
ПС
N
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
(виды гипертензий, стадии ГБ):
• Гиперкинетическая |
• Эукинетическая |
|
|
(гипертензия «выброса», |
(гипертензия «со- |
• Гипокине- |
|
объемзависимая) |
противления», вазо- |
тическая |
|
|
констрикторного |
(«обезглавленная» |
|
|
|
типа |
гипертензия |
|
ренинзависимая) |
|
сопротивления) |
I стадия ГБ |
II стадия ГБ |
III стадия ГБ |
|
(транзиторная) |
(стабильная) |
(склеротическая) |
|
|
|
|
|
Нейрогуморальная |
Появление и нарастание |
Постепенное снижение МОС |
|
регуляция (вазомо- |
расстройств нейрогумо- |
(перегрузочная форма сер- |
|
торный компонент) |
ральной регуляции сосу- |
дечной недостаточности) |
|
сосудистого тонуса не |
дистого тонуса ( |
удельный |
декомпенсация сердечной де- |
нарушена: сосуды ре- |
вес вазомоторного компо- |
ятельности на фоне развиваю- |
|
агируют адекватно |
нента; смещение регуляции |
щегося атеросклеротического |
|
(расширяются) на |
к базальному компоненту): |
поражения периферических |
|
первичное повыше- |
неадекватная реакция сосу- |
сосудов |
|
ние МОС |
дов [спазм] на |
МОС |
|
|
нагрузка на сердце) |
|
|
|
|
|
|
Осложнения ГБ: атеросклероз, ИБС (в т. ч. инфаркт миокарда), инсульт, ретинопатия, хроническая почечная недостаточность…
158

«Почечный фактор» в патогенезе артериальной гипертензии
Стеноз почечной артерии 
 Объемная скорость кровотока в почке
Объемная скорость кровотока в почке
почка |
почка |
Ишемия |
|
Гипернатриемия |
почки |
|
|||
|
|
|
||
|
|
|
|
|
|
|
|
Дистальный |
Хеморецепторы |
|
|
|
каналец |
macula densa |
|
|
|
macula densa |
Предсердный |
Пульсовое давление в v. afferens |
|
натрийуретический |
||
|
|
|
|
фактор-ПНФ (аурикулин) |
Активация |
Механорецепторы ЮГА |
|
|
|
симпато- |
|
|
||
|
2- адрено- |
|
капсула Боумена: |
|
адреналовой |
|
|
||
|
|
париетальный листок |
||
системы |
|
рецепторы ЮГА |
РЕНИН |
|
|
|
|
|
|
Ангиотензиноген |
мезангий |
висцеральный листок |
||
|
||||
(синтезируется в печени, относится |
|
|
||
к |
2- глобулинам) |
Ангиотензин — I |
|
|
Ангиотензин-превращающий фермент (АПФ) : |
|
|
СПРАВКА |
|
||||
1. мембраносвязанная форма АПФ |
|
|
|
Ренин — это протеаза; кроме ЮГА |
||||
(кининаза-2) |
|
|
может образовываться в стенках пери- |
|||||
2.гуморальнаяформаАПФ(кининаза-1) |
ферических артериол. |
|
||||||
|
|
ПНФ — это полипептид, синтезиру- |
||||||
|
|
|
|
|
||||
|
|
|
ется в предсердиях при их растяжении. |
|||||
СПРАВКА |
|
Ангиотензин — II |
|
|
|
|
||
* * * Ген АПФ картирован в хро- |
|
|
|
|
||||
|
|
|
СПРАВКА |
|
||||
мосоме 17q23 |
|
|
|
|
|
|||
АПФ сердечной мышцы как |
Ангиотензиназа |
|
* * * Известно 4 типа рецепторов |
|||||
|
ки. |
|
|
|||||
АПФ эндотелия кровеносных |
|
|
ангиотензина II (АТ II). |
|
||||
сосудов легких, мозга и других |
|
|
|
Рецепторы I типа эндотелия со- |
||||
органов и тканей |
локальное |
|
|
судов могут опосредовать проли- |
||||
образование АТ II |
тонус ре- |
|
|
|||||
|
|
феративное влияние АТ II на струк- |
||||||
зистивных сосудов. |
|
|
|
турные элементы сосудистой стен- |
||||
фактор локальной ренин-ангио- |
|
|
|
Изменения экспрессии или |
||||
тензиновой системы влияет на |
• Активация ангиотензиновых ре- |
|
структуры этих рецепторов |
|||||
сократительную функцию и рост |
цепторов сосудистой стенки |
|
|
образование факторов рос- |
||||
кардиомиоцитов. |
|
• Активация симпато-адреналовой |
та: тромбоцитарного, фиброб- |
|||||
|
ластов, инсулино-подобного. |
|||||||
АПФ плазмы крови, актив- |
системы ( синтез и выделение |
|
||||||
|
|
|
|
|||||
ность которого относительно |
норадреналина, |
его обратный |
|
|
АЛЬДОСТЕРОН |
|||
невелика, выделяется из раз- |
захват в синапсах) |
|
|
|
||||
личных тканей и органов (в ос- |
• Задержка выделения Na+ |
|
|
Поступление |
|
|||
новном, из легких). |
|
из организма |
|
|
|
|
||
АПФ обнаружена в макрофа- |
( реабсобция Na+ в почках) |
|
Na+ в эндотелий |
|
||||
гах ,Т-лимфоцитах, фиброблас- |
Поступление Na+ в мышечные |
|
Набухание эндотелия |
|||||
тах, а также в эпителиальных |
|
|||||||
клетках (почки, кишечник, пла- |
клетки сосудов |
|
|
|
Просвет сосудов |
|||
цента), участвующих в адсорб- |
|
|
|
|
||||
ционных и транспортных про- |
Чувствительность сосудов к ва- |
|
( |
сосудистое |
|
|||
цессах. |
|
зоконстрикторным влияниям |
|
сопротивление) |
|
|||
Самая высокая активность |
Инактивация |
|
|
|
|
|
||
АПФ обнаружен в репродуктив- |
|
|
|
|
|
|||
ных органах и семенной жид- |
кининов |
|
|
Интерстициальные клетки |
||||
кости. |
|
|
|
|
||||
|
|
|
|
Простагландины |
мозгового |
|||
* * * В микросудах АПФ распо- |
|
|
|
|||||
|
|
|
(PgE2, PgA) |
слоя почек |
||||
ложен на мембранах клеток. |
|
|
|
|||||
Уровень |
|
|
|
|
|
|||
Циркулирующие молекулы АПФ |
Натрийурез; |
|
|
|||||
попадают в кровь, отделяясь от |
АД |
|
|
|||||
Гидроурез |
Фосфолипидный |
|||||||
тканевых гликопротеидов. |
|
|||||||
|
|
|
|
|||||
|
|
|
|
|
|
ингибитор ренина |
||
159
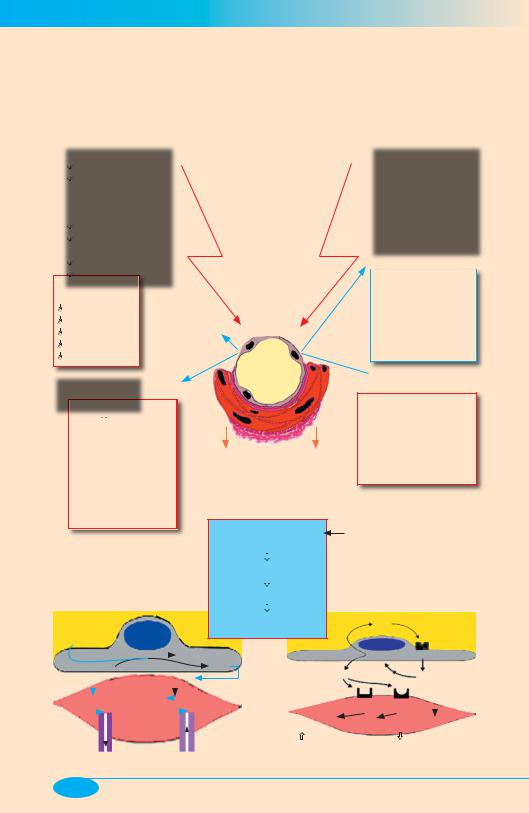
Эндотелиальная дисфункция
«Эндотелиальная дисфункция» [патогенетически значимое изменение функциональной активности эндотелиальных клеток] — относительно новое понятие в медицине, появившееся в связи с выявлением чрезвычайно важной роли «эндотелиально-
го фактора» в инициации и развитии самых разных форм патологии включая, прежде всего, заболевания сердечно-сосудистой системы.
Релаксаторы |
Причины эндотелиальной дисфункции |
Проагреганты / |
||
Оксид азота (NO) |
А. Генетический фактор — |
Прокоагулянты |
||
Эндотелиальный |
мутации генов синтеза: |
Тромбоксан А2 |
||
фактор гиперполя- |
Рецепторов апопротеинов; |
PgH2 |
||
ризации |
NO – синтазы (7q 35-36) ; |
Тромбин |
||
(релаксации) |
Антитромбина (1q23-q25) |
ф.Виллебранда |
||
Простациклин |
Эндотелина 1 (6р24-23); |
Тканевой активатор |
||
Натрийуретический |
|
АПФ (17q 23) |
плазминогена (ТАП) |
|
пептид С-типа |
|
……. |
|
|
|
Гемостаз |
|||
Адреномедулин |
Б. Факторы риска развития |
|||
Брадикинин |
- Артериальной гипертензии |
Антиагреганты / |
||
Констрикторы |
|
- Сахарного диабета |
Антикоагулянты |
|
Тонус |
- Атеросклероза |
■ Ингибитор ТАП |
||
Эндотелин (ЭТ) |
||||
|
- Ожирения |
■ Антитромбин III |
||
гладкомышечных |
||||
Тромбоксан А2 |
клеток (ГМК) |
- ИБС… |
■ Простациклин |
|
Эндопероксиды |
||||
сосудов |
|
■ Оксид азота |
||
Ангиотензин II |
|
|||
|
|
■ Гепариноиды |
||
PgН2 |
|
ЭНДОТЕЛИЙ — |
||
|
|
источник |
|
Антимитогены |
Пролиферация |
разнообразных |
|
NO, ЕТ В1 |
БАВ |
||
|
|||
|
|
|
Митогены
Тромбоцитарный фактор роста
Фактор роста тромбоцитов
Инсулиноподобный фактор роста 1
ФНОα
ЕТ А, ЕТ В2
NO, ET3, PgI2
Эндотелиальная
клетка Ядро O2
«Эндотелий-зависимые» болезни:
атеросклероз, гипертоническая
болезнь, инфаркт миокарда, возрастные эндокринопатии, сахарный диабет, гиперлипидемии и др.
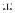 Транскрипция генов
Транскрипция генов  эндотелина
эндотелина
пре-проэндотелин
«Вig» – проэндотелин
Эндотелины (ЕТ1, ЕТ2, ЕТ3)
 Воспаление. Эмиграция лейкоцитов
Воспаление. Эмиграция лейкоцитов
Адгезивные молекулы
Селектины – Р, Е)
Jg-подобные молекулы
Интегрины
ИЛ-1,ИЛ-8
Белок хемотаксиса моноцитов
Ангиотензин.Катехоламины. Инсулин. Гипоксия. Сдвиг напряжения (деформация эндотелия при внешн. воздействиях).Тромбин…
ET-1 |
Эндотелио- |
|
цит |
L-аргинин |
|
|
|
|
L-цитруллин |
Big – ET-1 |
ET B1 |
||||||||||
|
|
||||||||||||||||
НАДФ Н |
NO-cинтазы |
|
|
|
NO |
ET-1 |
|
|
|
||||||||
|
|
|
Гуалинилатциклаза |
|
|
|
|
|
NO, Pg I2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ГМК |
ГМК |
|
|
|
Протеинкиназа С цГМФ |
|
|
|
ГТФ |
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Релаксация |
ETA |
ETB2 |
|
|
|
|
|
|
|
Гиперполя- |
|
|
|
|
|
|||||||
Калиевый |
|
|
|
|
|
|
Вазоконстрикция |
Вазодилатация |
|||||||||
|
|
ризация |
|
|
|
Кальциевый |
Пролиферация |
|
Пролиферация |
||||||||
канал |
|
|
|
|
|
|
|
|
|
канал |
|
|
|
|
|||
|
|
K+ |
|
|
|
|
Ca++ |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
160
