
- •Введение
- •Номенклатура фосфорорганических соединений.
- •Классификация фосфорорганических соединений
- •Связи, образуемые атомом фосфора
- •Элементный фосфор и его неорганические соединения
- •Получение органических производных фосфорной кислоты и их тиоаналогов
- •Синтез и свойства производных кислот фосфора с рн‑связями
- •Производные кислот фосфора с трикоординированным атомом фосфора
- •Фосфины
- •Органические синтезы с участием производных кислот фосфора и фосфинов
- •Биологически активные производные кислот фосфора
- •Фосфорорганические инсектициды
- •Фитоактивные производные кислот фосфора
- •Производные кислот фосфора с фунгицидной активностью
- •Фосфорорганические соединения в фармакологии
- •Заключение
Элементный фосфор и его неорганические соединения
Фосфор стал первым элементом, полученным в лаборатории со времён античности. В поисках «философского камня» европейские и арабские алхимики в течение многих лет проводили эксперименты с мочой, однако только в 1669 году Х.Бранд (Hennig Brand) при прокаливании без доступа воздуха сухого остатка, полученного при упаривании мочи, получил желтоватые крупицы нового вещества, которое светилось на воздухе и самовоспламенялось. Он дал этому веществу название «Phosphorus» (от греч. φῶς – свет и φέρω – несу, «светоносный»). Его образование в этих уловиях объясняется восстановлением содержащихся в моче фосфатов обугленными остатками органических соединений. Интересно, что и в наше время этот способ получения элементного фосфора используется в промышленном масштабе. Для этого в печах с электродуговым нагреванием при температуре около 1100°С природные фосфаты кальция восстанавливаются коксом в присутствии диоксида кремния, образующего плавкие силикаты с оксидом кальция:
![]()
Атомы фосфора в парах собираются в молекулы Р4 и при охлаждении конденсируются в белый фосфор с температурой плавления около 35°С. Его в жидком виде собирают под слоем воды для защиты от окисления. Молекулы белого фосфора (в чистом виде температура его плавления составляет 44,3°С) имеют строение тетраэдра. Белый фосфор растворим в органических растворителях и в сероуглероде. Углы связей, соединяющих четыре атома фосфора в молекуле Р4, составляют 60°, что значительно меньше 90° направленных по осям координат электронных облаков трёх 3р электронов. Это объясняет высокую реакционную способность белого фосфора. При нагревании без доступа кислорода часть этих напряженных связей раскрывается и образуется гораздо более стабильный полимерный красный фосфор, в структуре которого ещё сохраняются трёхчленные и четырёхчленные циклы из молекул белого фосфора:
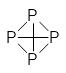
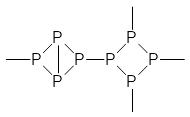
Белый фосфор Фрагмент молекулы красного фосфора
При нагревании под давлением может быть получен похожий на графит чёрный фосфор, строение которого, очевидно, характеризуется отсутствием циклических структурных элементов, а сверхвысокие давления могут перевести фосфор в металлическое состояние. Белый, красный и черный фосфор представляют собой основные существующие в нормальных условиях аллотропические модификации этого элемента. Все другие разновидности полимерного фосфора – это переходные формы от красного фосфора к чёрному.
Белый фосфор очень токсичен. Его попадание в организм приводит к повреждению костной ткани и гибели клеток костного мозга. Летальная доза для человека среднего веса составляет от 0,05 до 0,15 г.
При горении белого фосфора генерируется температура более 800°С, что делает его идеальной основой для зажигательных боеприпасов. Их подрыв происходит в воздухе над целью и на поверхность падает дождь из горящих капель фосфора. При попадании на тело эти горящие капли вызывают тяжелейшие ожоги, которые не поддаются лечению обычными способами, а продукты разложения тканей организма при высокой температуре вызывают токсикоз с возможным летальным исходом.
Все соединения фосфора с промежуточной степенью окисления между –3 и +5 могут вступать в реакции диспропорционирования с образованием фосфина, элементного фосфора и производных с более высокой степенью окисления. Это относится и к белому фосфору с валентностью 0. При нагревании в воде он диспропорционирует на фосфин и фосфорную кислоту:
![]()
При нагревании в водной щелочи диспропорционирование идет с образованием фосфина и соли фосфорноватистой кислоты:
![]()
В природе существует около 190 минералов, в составе которых присутствуют остатки фосфорной кислоты. Основными из них являются апатиты (фторапатит Са5(РО4)3F, гидроксиапатит Са5(РО4)3ОН) и фосфориты Са3(РО4)2). Биодоступность фосфатной составляющей в этих минералах крайне низка, и для получения более растворимых фосфатов, используемых в качестве удобрений, их переводят в кислые соли действием серной кислоты. Образующуюся при этом смесь кислых фосфатов кальция и сульфата кальция называют суперфосфатом, а для получения комплексных удобрений, содержащих также аммиак и калий, используют фосфорную кислоту.
Фосфорная кислота Н3РО4 в отличие от азотной кислоты НNО3 в соответствии с приведенной выше классификацией образуется атомом фосфора в электронном состоянии 4λ5, из-за чего её часто называют ортофосфорной кислотой. При термической дегидратации фосфорной кислоты атом фосфора сохраняет это электронное состояние, т.е. дегидратация ортофосфорной кислоты идёт за счёт образования не Р=О-связей, а РОР‑связей. Первичным продуктом при этом становится пирофосфорная кислота Н4Р2О7, затем образуются и полифосфорные кислоты. Полимерная метафосфорная кислота (НРО3)n может быть получена растворением фосфорного ангидрида в фосфорной кислоте.
Фосфорная кислота представляет собой гигроскопичное кристаллическое соединение, поэтому в промышленности и в лабораторной практике чаще всего используют жидкую фосфорную кислоту, содержащую 15% воды, тем более, что при полном обезвоживании идёт образование некоторого количества пирофосфорной кислоты.
Фосфорная кислота представляет собой кислоту средней силы, её соли со щелочными металлами растворимы в воде, при этом растворы средних солей имеют щелочную реакцию, а дигидрофосфорильные соли – кислую.
Фосфорному ангидриду, образующемуся при горении фосфора в сухом воздухе, в парах соответствует формула Р4О10. В твердом состоянии он может быть аморфным или кристаллическим. Это соединение очень активно поглощает влагу, превращаясь в полифосфорные кислоты. В соответствии с этим фосфорный ангидрид часто используют в качестве осушителя и дегидратирующего реагента. Так, например, он переводит амиды карбоновых кислот в нитрилы, а карбоновые кислоты в соответствующие ангидриды:
![]()
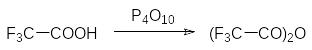
Взаимодействие смесей красного фосфора с серой в разных стехиометрических соотношениях при поджигании приводит к образованию различных сульфидов фосфора, главным из которых является декасульфид Р4S10. Это соединение широко используется в органической химии для замены атомов кислорода на атомы серы и для получения эфиров тиокислот фосфора. В частности, при взаимодействии декасульфида фосфора с бутиловым спиртом образуется дибутиловый эфир дитифосфорной кислоты:
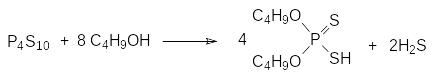
Это соединение используют в качестве флотореагента при отделении сульфидных минералов от пустой породы в водной суспензии (в пульпе) измельченных руд. Сорбируясь на поверхности частиц минерала, дибутиловый эфир дитиофосфорной кислоты облегчает прилипание к ним пузырьков воздуха, которые выносят эти частицы на поверхность пульпы.
Основными исходными продуктами для получения производных кислот фосфора являются их хлорангидриды. Трихлорид фосфора PCl3, соответствующий хлорангидриду фосфористой кислоты, получают в промышленном масштабе пропусканием сухого хлора в раствор белого фосфора в трихлориде фосфора. Реакция протекает с выделением большого количества тепла, которое используется для испарения и отгонки образующегося трихлорида фосфора. Его окислением кислородом сухого воздуха в промышленности получают фосфорилхлорид РОCl3, который ранее называли хлорокисью фосфора. Реакционную способность трихлорида фосфора по отношению к кислороду можно продемонстрировать, пропуская кислород в жидкий трихлорид – пузырьки кислорода полностью поглощаются слоем трихлорида фосфора толщиной около 20 см.
Гидролиз трихлорида фосфора приводит к достаточно стабильной фосфористой кислоте. Она может быть получена в виде гигроскопичных кристаллов с температурой плавления около 70°С. При нагревании выше 100°С фосфористая кислота начинает разлагаться с выделением воды, а выше 250°С разложение идёт по схеме диспропорционирования с образованием фосфина, аморфного фосфора и фосфорной кислоты:
![]()
Тиоаналог оксихлорида фосфора тиофосфорилхлорид PSCl3 получают при длительном кипячении трихлорида фосфора с серой в присутствии безводного хлорида алюминия. Его используют для получения производных тиокислот фосфора.
Пентахлорид фосфора в парах имеет формулу РCl5, где атомы хлора расположены в углах тригональной бипирамиды с атомом фосфора в центре. Его кристаллы с температурой плавления и возгонки около 160°С построены из катионов РCl4+ и анионов РCl6-, тем не менее все его превращения описываются формулой РCl5. Пентахлорид фосфора достаточно хорошо растворим в инертных органических растворителях. Его используют для перевода кислот в соответствующие хлорангидриды и, например, для замены атома кислорода в карбонильных группах на два атома хлора:
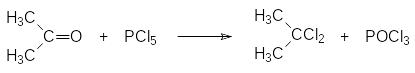
При крупномасштабном производстве с участием пентахлорида фосфора его предпочитают получать по ходу реакции, пропуская хлор в реакционную массу с трихлоридом фосфора.
При нагревании пентахлорида фосфора с хлоридом аммония в тетрахлорэтане образуется смесь так называемых фосфонитрилхлоридов (РNCl2)n, состоящая из циклических тримера и тетрамера, а также линейных олигомеров. Образование кристаллического тримера представлено уравнением:

Образующаяся циклическая структура, в которой все РN-связи равноценны, достаточно устойчива. Атомы хлора в фосфонитрилхлоридах отличаются очень высокой реакционной способностью, в соответствии с этим получено множество продуктов замещения их на самые разные нуклеофильные группы.
