
- •Введение
- •Номенклатура фосфорорганических соединений.
- •Классификация фосфорорганических соединений
- •Связи, образуемые атомом фосфора
- •Элементный фосфор и его неорганические соединения
- •Получение органических производных фосфорной кислоты и их тиоаналогов
- •Синтез и свойства производных кислот фосфора с рн‑связями
- •Производные кислот фосфора с трикоординированным атомом фосфора
- •Фосфины
- •Органические синтезы с участием производных кислот фосфора и фосфинов
- •Биологически активные производные кислот фосфора
- •Фосфорорганические инсектициды
- •Фитоактивные производные кислот фосфора
- •Производные кислот фосфора с фунгицидной активностью
- •Фосфорорганические соединения в фармакологии
- •Заключение
Органические синтезы с участием производных кислот фосфора и фосфинов
Декасульфид фосфора является универсальным реагентом, используемым в органической химии для замены атомов кислорода на атомы серы. Однако более удобным реагентом для осуществления таких реакций является реагент Лоусона, образующийся при действии декасульфида фосфора на анизол (см стр. 34).
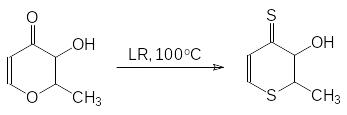
Это соединение было получено в 1954 году при изучении реакций ароматических соединений с декасульфидом фосфора, однако именно Лоусон (S.-O. Lawesson) внедрил его в практику органического синтеза для замены атомов кислорода в карбонильных соединениях, в эфирах и в спиртах на атомы серы. В качестве примера приводится реакция, протекающая при нагревании в диоксане душистого вещества мальтола с реагентом Лоусона (LR):
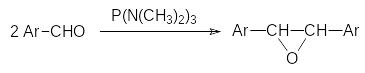
Соединения трикоординированного фосфора используются не только в роли лигандов для металлокомплексного катализа. Одна из первых реакций, в которых для превращения органических соединений без включения в их состав фосфорсодержащего структурного элемента использовалась координационная ненасыщенность соединений с атомом фосфора в электронном состоянии 3λ3, представлена взаимодействием ароматических альдегидов с гексаметилтриамидом фосфористой кислоты, которое протекает с образованием оксидов стильбенов:
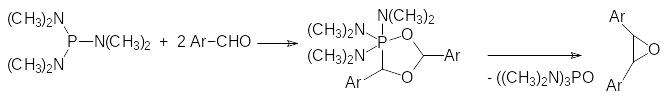
Механизм этого превращения основан на образовании 1,3,4-диокса-фосфоланового цикла с включением в него двух молекул альдегида и с элиминированием гексаметилфосфортриамида по схеме:
Мягкий способ замены спиртовых гидроксильных групп на атомы хлора или брома в составе соединений, которые нестабильны в присутствии кислот, представлен реакцией Аппеля (R.Appel, 1975). Её проводят, прибавляя трифенилфосфин к раствору соответствующего гидроксильного производного в четырёххлористом углероде или к раствору исходного вещества и тетрабромметана в инертном растворителе. Реакция протекает по схеме:
![]()
Трифенилфосфин с N-бромсукцинимидом (NBS) избирательно переводит в соответствующие бромпроизводные первичные гидроксильные группы. Так, например, метил-α-D-глюкопиранозид может быть с высоким выходом превращен в метил-6‑бром-6-деокси-α-D-глюкопиранозид действием этих реагентов в диметилформамиде при полном исключении влаги:
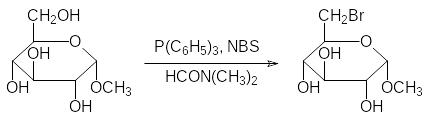
 NBS
NBS
Третичные фосфины участвуют во многих реакциях с азотсодержащими соединениями, так, например, при взаимодействии трифенилфосфина с азидами образуется триазосоединение, элиминирующее молекулу азота с превращением в фосфинимин, например:
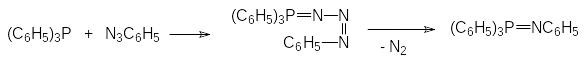
Образующееся при этом соединение может быть использовано, например, для получения основания Шиффа:
![]()
Трифенилфосфин участвует также в реакции Мицунобу (О.Мtsunobu, 1967). В классическом виде реакция Мицунобу представляет собой этерификацию спиртов карбоновыми кислотами в присутствии диэтилазодикарбоксилата (DEAD) и трифенилфосфина. Реакция протекает по схеме:
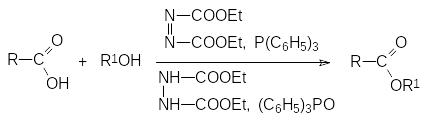
Со спиртами, гидроксильная группа которых находится у асимметрического атома углерода, реакция Мицунобу идёт с обращением конфигурации. В реакцию вступают первичные и вторичные спирты. Вместо карбоновых кислот могут быть использованы и другие нуклеофилы. Так, например, её можно использовать для получения простых эфиров фенолов, тиоэфиров и других соединений. Нуклеофильная компонента должна быть представлена достаточно сильной кислотой для того, чтобы протонировать несущий положительный заряд атом азота в азодикарбоксилате, образующем комплекс с трифенилфосфином. В результате реакции азодикарбоксилат превращается в бис(этоксикарбонил)гидразин, а трифенилфосфин в трифенилфосфиноксид. Эти побочные соединения обычно легко отделяются от целевого продукта.
Одной из наиболее известных реакций, протекающих с участием фосфор-органических соединений, является реакция Виттига (G.Wittig, 1954 г., Нобелевская премия в области химии 1979 года). Реакция Виттига представляет собой взаимодействие алкилидентрифенилфосфоранов, образующихся при действии сильных оснований на соответствующие соли алкилтрифенилфосфония, с карбонильными соединениями (альдегидами и кетонами). Реакция между алкилидентрифенилфосфораном и карбонильным соединением протекает с образованием нестабильного оксафосфетана, разлагающегося на трифенилфосфиноксид и непредельное соединение в виде Z-изомера по схеме:
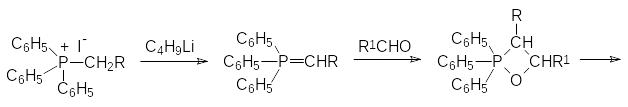
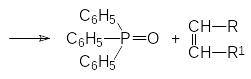
Соответствующие алкилиденфосфораны получают действием сильных оснований на соли фосфония. Если при этом образуется фосфорановое соединение, стабилизированное электроноакцепторным заместителем в остатке R, то скорость реакции снижается и возрастает содержание Е‑изомера в образующемся непредельном продукте реакции.
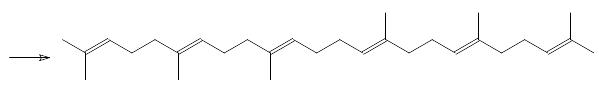
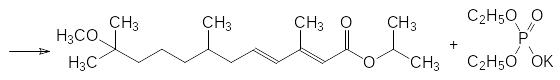
Реакция Виттига широко используется для получения полиненасыщенных природных соединений. В качестве примера можно привести синтез сквалена из геранилацетона и дифосфоранового соединения, образующегося из бисфосфониевой соли на основе 1,4-дибромэтана и трифенилфосфина:

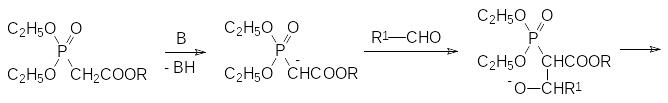
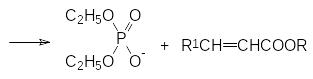
Электроноакцепторные свойства фосфорильной группы позволяют прово-дить депротонирование соответствующих соединений с отщеплением протона в α-положении к фосфорильной группе при действии сильных оснований. Обра-зующиеся при этом анионы могут быть использованы в самых разных превра-щениях. В частности, исходными продуктами в реакции Хорнера-Вадсворта-Эммонса являются триэфиры фосфонуксусной кислоты, у которых электроноакцепторный эффект карбоксилатной группы дополняется электроно-акцепторным эффектом фосфорильной группы. При действии таких сильных оснований, как трет-бутилат калия, гидрид натрия, амид натрия или DBU (1,8‑диазабицикло[5.4.0]ундец-7-ен) с хлоридом лития, в тетрагидрофуране, 1,2-диметоксиэтане, бензоле или ацетонитриле, полные эфиры фосфонуксусной кислоты депротонируются с образованием аниона, который реагирует с карбонильными соединениями по аналогии с реакцией Виттига. Конечными продуктами при этом становятся эфиры замещенных акриловых кислот:
Представленный реакцией Хорнера-Вадсворта-Эммонса способ получения производных акриловых кислот был впервые реализован группой исследова-телей под руководством Л.Хорнера (L.Horner, 1958). В качестве примера использования этой реакции на практике можно привести синтез регулятора роста насекомых метопрена:
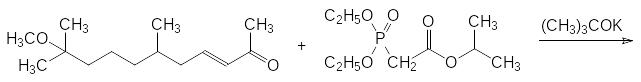
Реакция Хорнера-Вадсворта-Эммонса приводит к получению соответствующих непредельных соединений в виде термодинамически более выгодных Е‑изомеров. Замена этильных остатков в эфирных группах у атома фосфора на 2,2,2-трифторэтильные позволяет получать преимущественно Z‑изомеры. Это связано с тем, что фосфонат с трифторэтильными группами реагирует с карбонильными соединениями с более высокой скоростью. В соответствии с этим реакция с участием трифторэтиловых эфиров фосфонуксусной кислоты (W.C.Still, C.Gennari, 1983) протекает при более низкой температуре по пути с более низким значением энергии активации (кинетический контроль течения реакции).
Тетрабромметан реагирует с двумя молями трифенилфосфина с образованием дибромметилида трифенилфосфония (дибромметилентрифенил-фосфорана):
![]()
Это соединение может быть использовано в реакции Виттига с альдегидами для замены карбонильного атома кислорода на метилендибромидную группу. Например, именно с помощью дибромметилида трифенилфосфония был впервые получен эфир кислоты, получившей затем название дельтаметриновой, поскольку на её основе был получен один из самых эффективных пиретроидов дельтаметрин. Исходным карбонильным соединением в этом случае является этиловый эфир 2,2-диметил-3-формилциклопропанкарбоновой кислоты:

Полученные из альдегидов дибромвинильные соединения могут быть превращены в ацетиленовые производные действием бутиллития с последующим действием алкилгалогенида или воды:
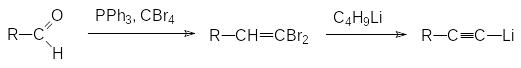

Эта цепочка превращений известна как реакция Кори-Фукса.
Еще одна область применения третичных фосфинов и полных эфиров фосфористой кислоты представлена реакциями, в которых эти соединения отрывают атом кислорода от разичных субстратов. В частности, действием соединений с трикоординированным атомом фосфора можно легко переводить N‑аминоксиды в соответствующие амины, а нитроны в основания Шиффа. Трифенилфосфин отщепляет атом кислорода от эпоксидов, например, образующихся по реакции Дарзана. В присутствии гидрохинона в качестве слабой кислоты и ингибитора полимеризации образующегося ненасыщенного эфира трифенилфосфин переводит 2‑фенил-3-этоксикарбонилоксиран в цис-изомер этилового эфира коричной кислоты с выходом около 80% при температуре от 150 до 170°С по схеме:
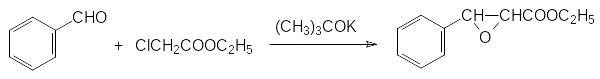
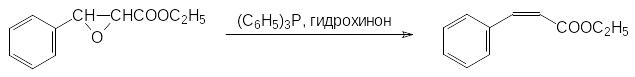
В более мягких условиях по аналогичной схеме идет десульфуризация тииранов, которые можно получать из соответствующих оксиранов и декасульфида фосфора (см. стр. 34). С помощью триметилфосфита и триэтилфосфита можно восстанавливать гидропероксиды до спиртов.
