
Семинары и лекции Обручниковой / Lektsii_1-6_Obruchnikova_Ya_A
.pdf
dA = TdS – pdV – TdS – SdT dA = – SdT – pdV
б) G = H – TS
dG = dH – TdS – SdT TdS = dH – Vdp
dH = TdS + Vdp
dG = TdS +Vdp –TdS – SdT dG = - SdT + Vdp
3)Абсолютные значения неизвестны
dGобр = dGнеобр dAобр = dAнеобр
ΔG = G2 – G1 ΔA = A2 – A1
Размерность [Дж] или [Дж/моль]
4)Характеризует работоспособность системы при определенных условиях, а именно V, T = const: A; p, T = const: G.
5)Является критерием направления протекания процесса.
Связь между энергией Гиббса и энергией Гельмгольца
A = U – TS
G = H – TS = U + pV – TS = A + pV
H = U + pV
Условия |
Самопроизвольный |
Несамопроизвольный |
U, V = const |
dS > 0 |
dS = 0 |
S, V = const |
dU < 0 |
dU = 0, d2U > 0 |
S, p = const |
dH < 0 |
dH = 0, d2H > 0 |
V, T = const |
dA < 0 |
dA = 0, d2A > 0 |
p, T = const |
dG < 0 |
dG = 0, d2G > 0 |
Зависимость энергии Гиббса и энергии Гельмгольца от параметров состояния
Характеристическая функция – термодинамическая функция, посредством которой и ее производных по естественным переменным можно в явной форме установить связь между термодинамическими свойствами системы с основными термодинамическими параметрами. Характеристические
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
функции обращаются в ноль при постоянстве относящихся к ним естественных переменных (то есть при которых данная функция становится характеристической).
dG = - SdT + Vdp
dA = – SdT – pdV
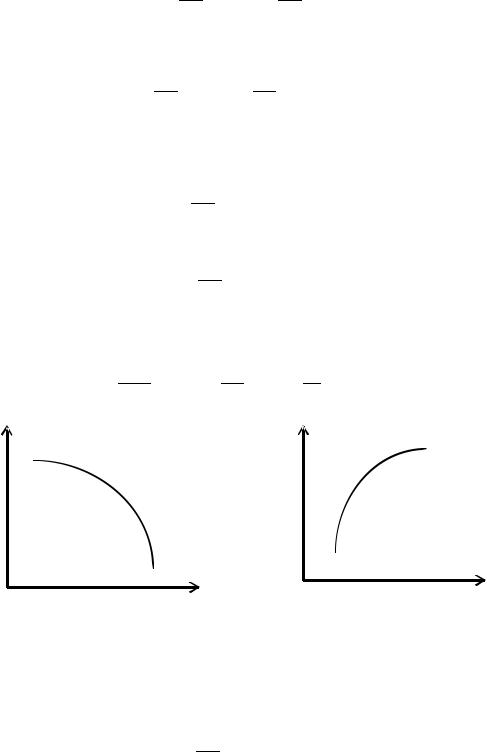
1)Зависимость энергии Гиббса от температуры
G = f(T), p = const
Так как S > 0, то
0
С увеличением температуры энергия Гиббса системы или вещества будет уменьшаться (линия выпуклая).
0
G G
T |
p |
|
|
|
|
2) Зависимость энергии Гиббса от давления при T = const
V > 0, то
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
0
С ростом давления энергия Гиббса вещества возрастает (линия выпуклая).
0
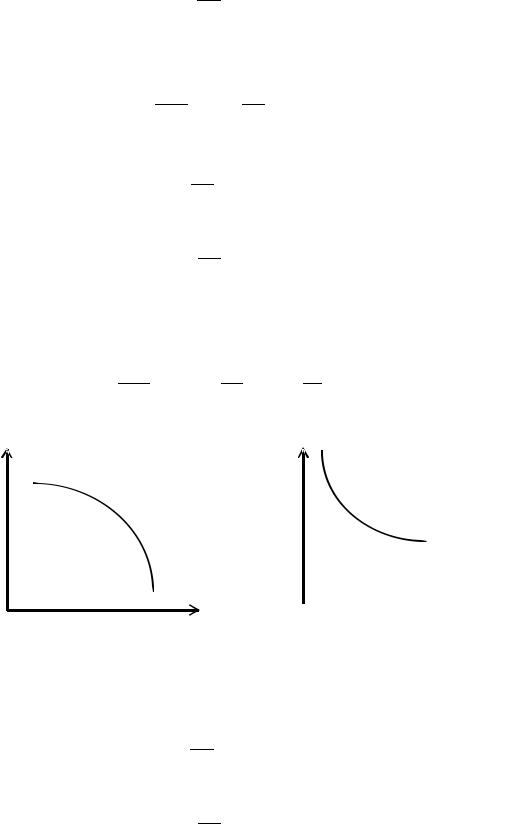
3)Зависимость энергии Гельмгольца от температуры при V = const
Так как S > 0, то
0
С увеличением температуры энергия Гельмгольца системы или вещества будет уменьшаться (линия выпуклая).
0
A A
T  V
V
4)Зависимость энергии Гельмгольца от объема при T = const
p > 0, то
0
С ростом давления энергия Гельмгольца вещества убывает (линия вогнутая).
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

0
Расчет изменения энергии Гиббса и энергии Гельмгольца в различных изопроцессах
dG = – SdT + Vdp dA = – SdT – pdV
1)T = const dG = Vdp
∆
dA = – pdV
∆
Для изотермического процесса расширения (сжатия) индивидуального вещества ΔG = ΔA.
2)V = const dA = – pdV
∆
3)p = const dG = – SdT
∆
Если S = f(T), то
Если cp = const, S = cplnT + const. Если cp = f(T), cp = a + bT + cT2 + c’/T2
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Расчет изменения энергии Гиббса при смешении идеальных газов
∆
∆ ∆ ∆
исх
кон
Уравнения Гиббса-Гельмгольца
- уравнения, связывающие A и G с их температурными производными.
Для индивидуального вещества: |
|
|
|
|
||||
G = H – TS |
A = U – TS |
|||||||
H = G + TS |
U = A + TS |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для химической реакции:
p, T = const, ΔG = G2 – G1
ΔG = (H2 – TS2) – (H1 – TS1) = (H2 – H1) – T(S2 – S1)
rG° = |
rH° – TΔrS° |
rA° = |
rU° – TΔrS° |
|
∆ |
° |
∆ |
∆ ° |
∆ |
∆ ° |
∆ ° |
∆ ° |
∆ ° ∆ ° |
∆ ° |
|
rG° = (Σνi fGi°)прод - (Σνj fGj°)исх |
|
|
|||
rG° = |
rH° – TΔrS° |
|
|
|
|
rA° = |
rU° – TΔrS° |
|
|
|
|
rH° = |
rU° + |
rnRT |
|
|
|
rG° = |
rA° + |
rnRT |
|
|
|
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Расчет ΔG и ΔA при T ≠ 298 K
∆ °
∆
Необходимо учитывать зависимости: ΔS = f(T), ΔH = f(T), Δcp = f(T)
rH°T = rH°298 + |
ΔrCp° |
|
∆ |
° |
|
Для удобства расчетов |
∆ ° ∆ ° |
|
|
||
rG°Т используют метод Темкина-Шварцмана: |
|||||
rG°Т = rH°298 – TΔrS°298 – T(ΔraM0 + |
rbM1 + |
rcM2 + rc′M-2) |
|||
Расчет ΔG и ΔA при фазовых переходах |
|
|
|||
1) В случае обратимого фазового перехода, протекающего при p, T = const
dG = – SdT + Vdp |
G |
|
p, T = const, dT, dp = 0 |
|
|
|
|
|
dG = 0 |
|
|
S = const, Sгаз >> Sжидк |
|
|
ΔA = ΔG – ΔnRT |
|
T |
Δn – изменение числа молей газообразных веществ |
|
|
2)В случае обратимого фазового перехода, протекающего при V,T = const dA = – SdT – pdV
dA = 0
Оценка принципиальной возможности протекания реакции
Большинство реакций протекает при p, T = const, поэтому в качестве критерия направления протекания процесса и равновесия чаще всего используется энергия Гиббса.
По справочнику рассчитывается значение протекает в прямом направлении. Если обратном направлении.
rG298°. Если rG298° < 0, реакция rG298° > 0, реакция протекает в
Чтобы определить влияние температуры, рассчитывается rS298°.
∆ °
∆
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Если |
rS298° > 0, с ростом температуры |
rG298° уменьшается. |
Если |
rS298° < 0, с ростом температуры |
rG298° возрастает. |
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Лекция №6
Система с переменным составом. Химический потенциал.
Для закрытых систем с постоянным составом (индивидуальные вещества) зависимость энергии Гиббса от p, T выражается уравнением:
dG ≤ - SdT + Vdp
Для открытых систем с переменным составом, связанных с протеканием химической реакции, связанных с перераспределением вещества между сосуществующими фазами или связанных со смешением газов, необходимо учитывать зависимость термодинамических свойств системы от ее состава, то есть чисел молей всех фаз, присутствующих в системе:
U = f(S, V, n1, n2, …nN)
, ,
H = f(S, p, n1, n2, …nN)
, ,
G = f(p, T, n1, n2, …nN)
, ,
A = f(V, T, n1, n2, …nN)
, ,
Последние слагаемые во всех уравнениях равны друг другу.
, |
, |
, |
, |
, |
, |
, |
, |
μi [Дж/моль] – химический потенциал
Химический потенциал – частная производная характеристической функции
по числу молей i-ого компонента при постоянстве пары соответствующих естественных параметров и числа молей остальных компонентов системы.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

Характеристическая функция – термодинамическая функция, посредством которой и ее производных по естественным переменным можно в явной форме установить связь между термодинамическими свойствами системы с основными термодинамическими параметрами. Характеристические функции обращаются в ноль при постоянстве относящихся к ним естественных переменных (то есть при которых данная функция становится характеристической).
Поскольку большинство процессов протекают при p, T = const наибольшее значение имеет выражение химического потенциала через энергию Гиббса:
, ,
Физический смысл
Химический потенциал i-ого компонента равен изменению энергии Гиббса системы при добавлении 1 моль этого компонента к большому объему системы при постоянных p и T. Большой объем означает, что состав системы практически не изменяется после добавления 1 моль компонента.
Абсолютное значение потенциала неизвестно. Интенсивная величина.
Химический потенциал как критерий направления протекания процесса в системах переменного состава
При p, T = const
′
′
Таким образом, химический потенциал является мерой работы, которую нужно затратить, чтобы ввести в систему или вывести из нее 1 моль i-ого компонента при постоянстве p, T и состава.
0– критерий направления протекания процесса системы с переменным составом
0– для самопроизвольного процесса
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

0 – для равновесного процесса
Химический потенциал является движущей силой любого процесса, связанного с перемещением масс или изменением состава системы (диффузия, фазовый переход, химическая реакция). Когда две системы с различными потенциалами вступают во взаимодействие, происходит выравнивание потенциалов за счет изменения числа молей (или природы веществ), т.е. данный компонент перемещается из области с более высоким значением потенциала в область с более низким значением потенциала. Процесс завершается наступлением равновесия, которое характеризуется равенством химического потенциала вещества во всех точках системы.
Зависимость химического потенциала от давления и температуры
Химический потенциал 1 моль чистого вещества равен энергии Гиббса 1 моль этого вещества, так как при изменении количества чистого вещества на 1 моль энергии Гиббса изменится на величину химического потенциала.
Таким образом, зависимость химического потенциала от давления p и температуры T аналогична зависимости энергии Гиббса от p и T.
μi = f(p, T) и Gi = f(p, T)
Vi – объем 1 моль вещества
Так как Vi > 0, то μi увеличивается с ростом давления.
Si – энтропия 1 моль вещества
Так как Si > 0, то μi уменьшается с ростом температуры.
Химический потенциал идеального газа
1) Идеальный газ как чистое вещество
T = const
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
