
Семинары и лекции Обручниковой / Lektsii_1-6_Obruchnikova_Ya_A
.pdf
′
∆
|
′ 1 |
1 |
||
2 |
2 |
|
|
|
4)Адиабатический процесс dS=0, ΔS=0
5)Одновременное изменение T и V(p)
∆
6)Расчет изменения энтропии при смешении идеальных газов (p = const = 1 атм, Т = const = 298 К)
n1, V1 n2, V2
Происходит только изменение объема от исходного V1 или V2 до суммарного V1 + V2.
∆ см ∆ |
∆ |
Через мольные доли газов:
∆ см
Изменение энтропии при фазовых переходах
T = const, при равновесном протекании фазового перехода p = const
|
|
∆ |
∆ ф.п. |
|
∆ ф.п. |
|
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Статистический характер второго закона термодинамики. Энтропия и термодинамическая вероятность системы.
Классическая термодинамика рассматривает происходящие процессы безотносительно к внутреннему строению системы; поэтому в рамках классической термодинамики показать физический смысл энтропии невозможно. Для решения этой проблемы Больцманом в теорию теплоты были введены статистические представления. Каждому состоянию системы приписывается термодинамическая вероятность. Термодинамическая вероятность - число микросостояний, составляющих данное макросостояние системы. Термодинамическая вероятность тем больше, чем более неупорядоченным или неопределенным является состояние системы. Таким образом, энтропия есть функция состояния, описывающая степень неупорядоченности системы. Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана:
S = klnW, k – константа Больцмана
С точки зрения статистической термодинамики второе начало термодинамики можно сформулировать следующим образом:
Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Статистическое толкование второго начала термодинамики придает энтропии конкретный физический смысл меры термодинамической вероятности состояния системы.
Ранее мы показали, что внутреннюю энергию системы можно условно представить в виде суммы двух величин "свободной" и "связанной" энергии. Возможность рассчитать величину "свободной" энергии, т.е. той части внутренней энергии системы, которую можно превратить в работу, дает тепловая теорема Нернста, называемая также третьим началом термодинамики.
Основные положения тепловой теоремы заключаются в следующем:
1.При абсолютном нуле температуры свободная энергия равна теплоте процесса.
2.При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Одной из |
формулировок третьего начала термодинамики является |
также |
|
постулат Планка: |
|
|
|
Энт ропия |
равильн |
образованного криста ла при абсолютном |
н ле |
температуры равна |
улю. |
|
|
|
|
Расчет абсолютной энт опии |
|
Рассчитаем |
изменение энтропии неко орой системы при нагревании её от |
||
абс олютного нуля до температуры T при постоянном давлении. |
|
||
|
|
|
|
; S0 → 0 |
|
|
|
|
|
|
|
|
|
||
При |
T = 0 любое ве щество может находиться только в твердом состоян ии. |
||||||
При |
нагревании ве ества возможен |
его переход в |
жидкое |
и затем в |
|||
газообразное |
состояние. Нагревание |
вещест а |
без |
фазовых |
переходов |
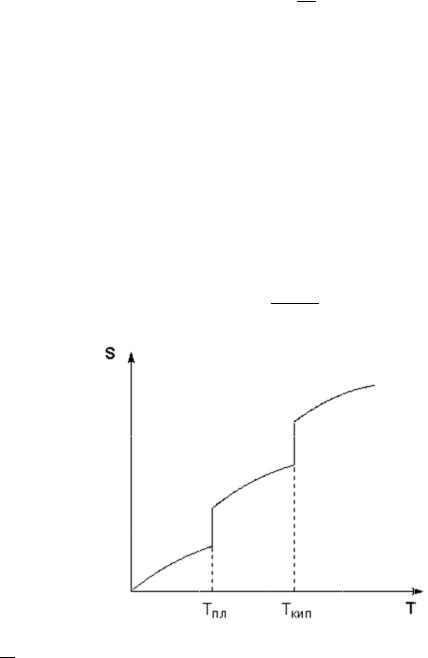
||
сопровождается непрерывны м росто |
|
энтропии; при |
фазово |
переходе |
|||
происходит скачкообразное изменени |
|
энтропии. |
Для |
фазовых переходов, |
|||
происходящих |
в изобарно-изотермических ус овиях, и зменение энтропии |
||||||
равно приве енной теплоте фазового п рехода:
∆ ф.п.
ф.п.
ф.п.
– тангенс угла наклона линий на график S = f(T)
Физическая химия I. Доцент каф ы физической хи ии РХТУ им. Д.И. Менделеева Обручникова Я.А.
пл тв |
|
∆ пл |
|
|
|
|
пл |
кип ж |
|
∆ исп |
|
г |
|
пл |
|
|
кип |
кип |
|
Так как S0 = 0,
пл тв |
|
∆ пл |
|
|
|
|
пл |
кип ж |
|
∆ исп |
|
г |
|
пл |
|
|
кип |
кип |
|
- уравнение справедливо для давления 1 атм.
°
°°
-уравнение справедливо для давления 1 атм.
°, ° брать из справочника для того агрегатного состояния вещества, в
котором оно находится при температуре T.
Если давление отличается от 1 атм, то необходимо учитывать дополнительное слагаемое, где давление p выражено в атмосферах:
°
°°
Графический расчет абсолютной энтропии
Для вычисления энтропии необходимо построить график зависимости и определить площадь под полученной кривой. Для этого нужно
знать экспериментальные значения теплоемкостей начиная от низких температур (10 – 80 К; при более низких температурах зависимость экстраполируется к нулю) до некоторой температуры T. Зависимость теплоемкости от температуры сложная – теплоемкость Cp может быть пропорциональна квадрату или кубу температуры, или температуре в 1-ой степени:
~; ~ ; ~
Фазовые переходы сопровождаются вертикальными скачками на графике и учитываются в расчетах с помощью выражения
ф.п.
∆ ф.п.
ф.п.
. Таким образом, для расчета энтропии фазового перехода
необходимо знать энтальпию фазового перехода.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
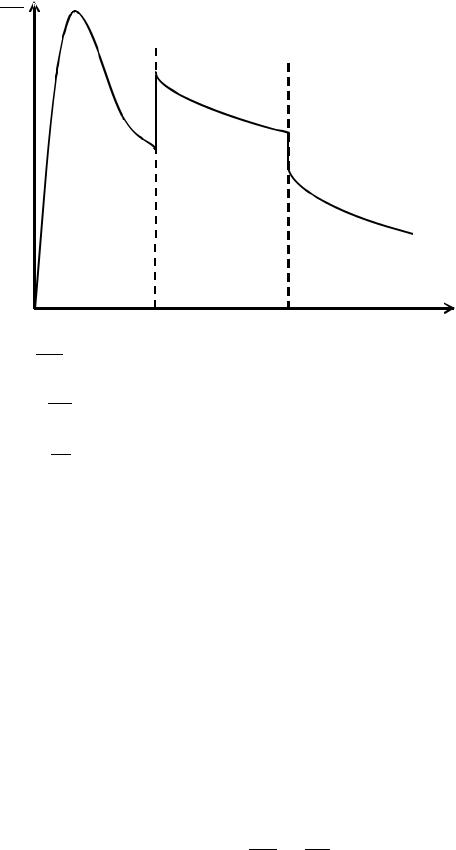
III
III
Tпл |
Tкип |
T |
I =
II =
пл тв
кип ж пл
III = кип г
Расчет изменения энтропии в химической реакции
Поскольку энтропия является функцией состояния, то есть изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции.
rS° = (ΣνiSi°)прод - (ΣνjSj°)исх
Если требуется определить изменение энтропии в ходе реакции rS° при температуре 298 K, значения энтропий веществ берется из справочника (табл. 44). Если T ≠ 298 K, тогда необходимо учитывать зависимость энтропии от температуры:
°°
– для индивидуального вещества;
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.

∆ ° ∆ °
– для химической реакции;
Тогда, например, для химической реакции:
|
|
|
|
|
|
|
∆ ° |
° |
∆ |
° |
∆ |
° |
|
|
||||
1. |
Если |
rcp° = const |
∆ |
|
|
|||||||||||||
|
rST° = |
rS°298 + ∆ |
°∙ |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2. |
Если |
rcp° = f(T) |
rcT2 |
|
|
|
|
|
rc′/T2 |
|
|
|
|
|||||
|
rcp = |
|
ra + rbT + |
|
|
+ |
|
|
|
|
|
|
||||||
|
rST° = |
rS°298 + ∆ |
∙ |
|
|
|
|
|
|
∆ |
298 |
|
∆ |
298 |
||||
|
|
|
|
|
|
|
|
|||||||||||
|
∆ |
′ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Лекция №5
Энергия Гиббса и энергия Гельмгольца. Термодинамический потенциал.
Изменения энтропии служит критерием направленности процесса только в изолированных системах. На практике создать условия изолированной системы почти невозможно и приходится иметь дело с неизолированными системами, то есть взаимодействующими с окружающей средой. Для характеристики процессов, протекающих в закрытых системах, были введены новые термодинамические функции состояния: изобарноизотермический потенциал (свободная энергия Гиббса) и изохорноизотермический потенциал (свободная энергия Гельмгольца).
Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изоэнтропный) и энтальпия (изобарно-изоэнтропный потенциал).
Термодинамические потенциалы
1) δQ = dU + pdV + δW’ - I начало термодинамики
- II начало термодинамики
TdS ≥ δQ, тогда
TdS ≥ dU + pdV + δW’
δW’≤ - dU – pdV + TdS
В изохорно-изоэнтропийных (V, S = const) условиях в равновесном процессе максимально полезная работа совершается за счет убыли внутренней энергии:
δW’≤ - dU
Необратимый процесс δW’ < - dU (W’ < - ΔU)
Обратимый процесс δW’max = - dU (W’max = - ΔU)
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Когда W’ = 0, dU ≤ 0 – критерий направленности процесса при V, S = const. dU < 0 – самопроизвольный
dU = 0 – равновесный
TdS = dU + pdV, dU = TdS – pdV
2)TdS ≥ dH - Vdp + δW’ δW’≤ - dH + Vdp + TdS
Визобарно-изоэнтропийных (p, S = const) условиях в равновесном процессе максимально полезная работа совершается за счет убыли энтальпии:
δW’≤ - dH
Необратимый процесс δW’ < - dH (W’ < - ΔH) Обратимый процесс δW’max = - dH (W’max = - ΔH)
Когда W’ = 0, dH ≤ 0 – критерий направленности процесса при p, S = const. dH < 0 – самопроизвольный
dH = 0 – равновесный
TdS = dH - Vdp, dH = TdS + Vdp
Условие постоянства энтропии на практике не реализуется, большинство процессов протекают при постоянстве p, T или V, T.
3) V, T = const TdS ≥ dU + pdV + δW’ δW’≤ - dU – pdV + TdS δW’≤ - dU + d(TS) δW’≤ - d(U - TS)
A = U – TS – энергия Гельмгольца (изохорно-изотермический потенциал) δW’≤ - dA
dA ≤ 0 – критерий направленности процесса при V, T = const.
Необратимый процесс δW’ < - dA (W’ < - ΔA)
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
Обратимый процесс δW’max = - dA (W’max = - ΔA)
В изохорно-изотермических (V, T = const) условиях максимально полезная работа совершается за счет убыли энергии Гельмгольца.
4) p, T = const
TdS ≥ dH - Vdp + δW’
δW’≤ - dH + Vdp + TdS
δW’≤ - dH + d(TS)
δW’≤ - d(H - TS)
G = H – TS – энергия Гельмгольца (изобарно-изотермический потенциал)
δW’≤ - dG
dG ≤ 0 – критерий направленности процесса при p, T = const.
Необратимый процесс δW’ < - dG (W’ < - ΔG)
Обратимый процесс δW’max = - dG (W’max = - ΔG)
В изобарно-изотермических (p, T = const) условиях максимально полезная работа совершается за счет убыли энергии Гиббса.
Энергия Гиббса и энергия Гельмгольца как критерий направленности процесса
δW’≤ - dA
W’ = 0,
dA ≤ 0
dA < 0 – самопроизвольный процесс (ΔA < 0; d2A > 0)
В изохорно-изотермических условиях могут самопроизвольно протекать процессы, сопровождающиеся уменьшением энергии Гельмгольца.
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
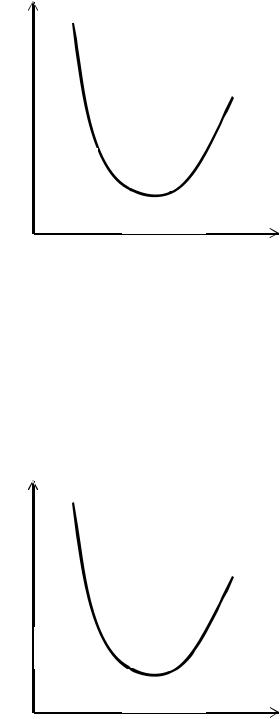
A
dA<0 dA=0 dA>0
d2A>0
δW’≤ - dG
W’ = 0
dG ≤ 0
dG < 0 – самопроизвольный процесс (ΔG < 0; d2G > 0)
В изобарно-изотермических условиях могут самопроизвольно протекать процессы, сопровождающиеся уменьшением энергии Гиббса.
G
dG<0 dG=0 dG>0
d2G>0
Свойства энергии Гиббса и энергии Гельмгольца
1)экстенсивные свойства системы
2)функции состояния системы (бесконечно малые изменения – полный дифференциал)
а) A = U – TS
dA = dU – TdS – SdT TdS = dU + pdV dU = TdS – pdV
Физическая химия I. Доцент каф ы физической химии РХТУ им. Д.И. Менделеева Обручникова Я.А.
