Ответы на дополнительные задачи
.docДополнительный список – 2006 год
|
№ 1 При нагревании белков до 70 градусов, большинство из них теряет свою биологическую активность. Объясните, как связана структура белков с их функцией, что происходит с белком при нагревании? Какие еще факторы могут нарушить структуру и функцию белков? Укажите механизмы защиты структуры белков в клетках. При ответе представьте соответствующие графики и рисунки.
ДНК Первичная структура белка Вторичная структура белка Третичная структура белка Образование уникальной формы активного центра Избирательное связывание лигандов Специфическая функция белка При нагревании происходит денатурация: Денатурация белков — это разрушение их нативной конформации, вызванное разрывом слабых связей, стабилизирующих пространственные структуры, при действии денатурирующих агентов. Денатурация сопровождается потерей биологической активности белка. Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации. Молекулярные шапероны предотвращают денатурацию белков. В клетках имеются белки – молекулярные шапероны, которые обладают способностью связываться с частично денатурированными, находящимися в неустойчивом, склонном к агрегации состоянии белками и восстанавливать их нативную конформацию. Вначале эти белки были обнаружены как белки теплового шока, так как их синтез усиливался при стрессовых воздействиях на клетку, например при повышении температуры (индуцибельные шапероны), но существуют также и конститутивные шапероны, высокий базальный синтез которых не зависит от стрессовых условий. Шапероны (Ш) классифицируются по массе субъединиц. Разлияают 6 классов:
Ш Различные семейства шаперонов, обнаруженные практически во всех отделах клетки, участвуют в таких фундаментальных процессах, как:
|
№ 2 В популяции людей найдены около 300 полиморфных форм гемоглобина. Каковы причины и последствия полиморфизма гемоглобина? Для ответа на вопрос: а) Расскажите строение основного белка эритроцитов; б) Объясните, какие изменения в структуре гемоглобина могут привести к образованию полиморфных форм этого белка; в) Используя в качестве примеров HbS и HbC, объясните, как изменение структуры 6елка отразится на его функции.
Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка. Каждый индивидуум может иметь только два варианта любого белка, тогда как в популяции число вариантов может быть огромно (так, по всем аллелям НЬА популяция людей образует более 600 генетически различающихся групп). Полиморфизм белков настолько велик, что можно говорить о биохимической индивидуальности каждого человека. а) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем. б) 2α2β 2α2δ HbA2 HbA + глюкоза HbA1c 2α2β 2α2γ HbF (фетальный) 2α2β 2ξ2ε HbE (эмбриональный) В β-цепи в 6-м положении Глу (полярн) Вал (гидрофобн) HbS В α- или β-цепи Гис E7 или Гис F8 Тир Fe 2+ окисляется в Fe3+ HbM (метгемоглобин) Фен D1 (гидрофобн) Сер (гидрофильн) Hb Хаммерсмита Гли B6 Арг Hb Ривердейла-Бронкса Асп G1 Асн Hb Кемпси в) В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте). Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области. Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям. Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. HbC, мутация происходит в β-цепи в 6 положении, Глу меняется на Лиз. |
№ 3 HbS имеет информацию, отличную от информации НbА и хуже выполняет свою функцию. На примере этих белков объясните связь между первичной структурой и функцией белков. Приведите различные примеры проявления полиморфизма белков.
ДНК Первичная структура белка Вторичная структура белка Третичная структура белка Образование уникальной формы активного центра Избирательное связывание лигандов Специфическая функция белка.
Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем. В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте). Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области. Полиморфизм белков. Амплификация генов, независимые мутации в копиях и рекомбинации приводят к дивергенции (расхождению) свойств соответствующих белков. Результатом этих процессов является усложнение генома в филогенезе и образование семейств родственных белков с близкой аминокислотной последовательностью и функциями или полиморфные разновидности одного и того же белка. Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, – существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0). |
|
№ 6 В 1949 году Лайнус Полинг с сотрудниками доказали, что в основе заболевания серповидноклеточной анемией лежит изменение первичной структуры белка. Назовите этот белок и на его примере расскажите о зависимости конформации белков и их функций от первичной структуры. Приведите примеры других заболеваний, основой которых является изменение структуры белков.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям. Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте). Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области. ДНК Первичная структура белка Вторичная структура белка Третичная структура белка Образование уникальной формы активного центра Избирательное связывание лигандов Специфическая функция белка Другие заболевания: α-Талассемии возникают при нарушении синтеза α-цепей. В геноме каждого индивидуума существует 4 копии гена α-глобина (по 2 копии на каждой хромосоме), поэтому встречаются несколько видов недостаточности α -цепей. Если дефектна одна из 4 копий, то фенотипически это не проявляется, и такого человека рассматривают как «молчащего носителя» талассемии. При дефекте в 2 копиях гена у носителя мутации обнаруживают слабовыраженные признаки болезни, а при дефекте в 3 копиях развивается гемолитическая анемия. При полном отсутствии синтеза α -цепей (т.е. дефектны все 4 копии гена) наступает внутриутробная гибель плода, так как не образуются фетальные формы Hb, а тетрамеры γ 4 обладают высоким сродством к кислороду и не способны функционировать как транспортные белки. β-Талассемии развиваются в результате снижения синтеза β-цепей Hb, для которых на каждой хромосоме имеется по одному гену. Синтез HbA начинается после рождения ребёнка. При дефекте в одной из копий гена недостаточность Hb проявляется в слабой степени и не требует специального лечения. Однако при полном включении синтеза β-цепей развивается тяжёлая форма анемии, и таким пациентам провод либо периодическую трансфузию крови, либо пересадку костного мозга. |
||
|
№ 4 В крови студента одной из африканских стран, поступившего в больницу с жалобами на одышку, головокружение, учащенное сердцебиение и боли в конечностях, при анализе крови были обнаружены эритроциты, имеющие форму серпа. Какова причина развития данного заболевания? Для ответа на вопрос: а) Опишите строение основного белка эритроцитов и объясните, какие изменения в структуре привели к образованию патологической формы этого белка; б) Используя таблицу генетического кода, определите, могут ли эти изменения быть результатом точечных мутаций; в) Объясните, почему изменяется форма и функция эритроцитов.
а), в) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7 и Гис F8 присоединяется гем. В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте). Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области. Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям. Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. б) Эти изменения могут быть результатом точечных мутаций |
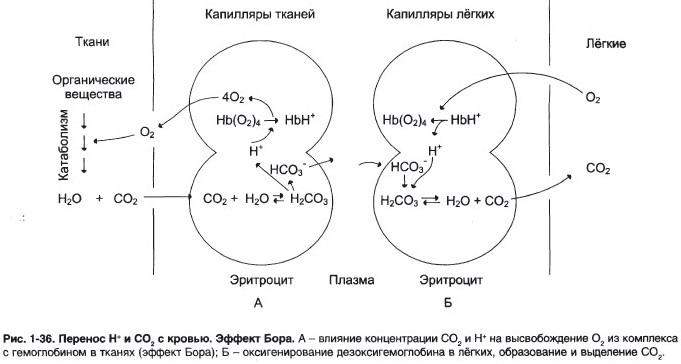
№ 5 Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, также как его избыток, губителен для тканей. Каким образом регулируется количество О2, доставляемого в ткани в соответствии с клеточными потребностями? При ответе объясните: а) Что такое эффект Бора; б) Как связан этот эффект с метаболической активностью тканей
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада – СО3 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
CO2 + H2O H2CO3 H+ + HCO3- Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-амин о группам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот). а) Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). б) В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О Н2СО3 Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом. Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани. Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3– |
|
|
|
||
|
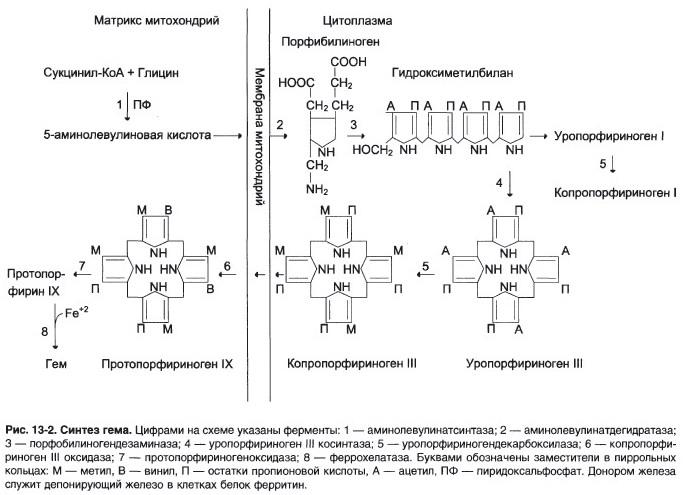
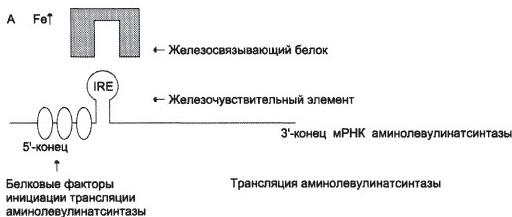
№ 7 В клетках костного мозга протекает следующий метаболический путь: E1 E2 E3 E4 En Глицин + Сукцинил-КоА → 5-аминолевулиновая кислота ↔ Р2 ↔ Р3 ↔ P4 ........... ↔ P При повышении концентрации конечного продукта синтез его прекращается. Объясните, как регулируется скорость процесса, для этого: а) Назовите, какие ферменты являются регуляторными в данной цепи реакций; б) Нарисуйте схему строения одного из регуляторных ферментов, перечислите его структурно-функциональные особенности и укажите все лиганды, которые могут взаимодействовать с этим ферментом; в) Назовите вид регуляции активности фермента данного метаболического пути.
Процесс – синтез гема.
а) Регуляторные ферменты – аминолевулинатсинтаза и аминолевулинатдегидратаза. б)
Особенности строения и функционирования аллостерических ферментов:
Лаганд здесь – железосвязывающий белок. в) Аллостерическое ингибирование:
|
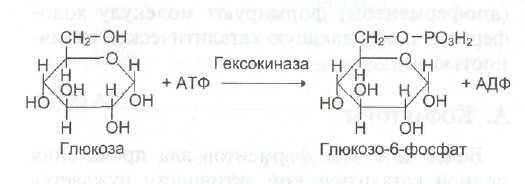
№ 8 Ферменты глюко- и гексокиназа катализируют одинаковую реакцию. Напишите реакцию, протекающую под действием этих ферментов; укажите различие в активности, регуляции и локализации этих ферментов. Объясните биологическое значение наличия в организме двух ферментов катализирующих одинаковую реакцию.
Глюко-
и гексокиназа катализируют реакцию
фосфорилирования глюкозы.
В превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе – фермент глюкокиназа. Фосфорилирование глюкозы – практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке – своеобразная «ловушка» для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови. Глюкокиназа. Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования. Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы. Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков. Гексокиназа. Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку. Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе. |
№ 9 Пациента с жалобами на боль в груди в течение 3 дней госпитализировали с подозрением на инфаркт миокарда. Результаты биохимического анализа крови подтвердили диагноз. Опишите метод энзимодиагностики и объясните: а) Какие особенности состава и распределения ферментов лежат в основе метода энзимодиагностики; б) Активность каких ферментов определяли в крови пациента и для какого из этих ферментов она была наибольшей на третьи сутки болезни, напишите реакции, катализируемыми этими ферментами.
а) Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
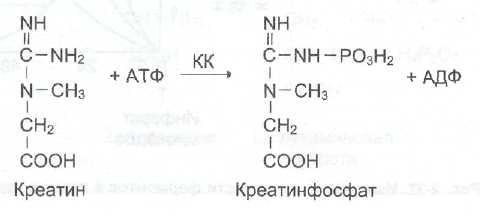
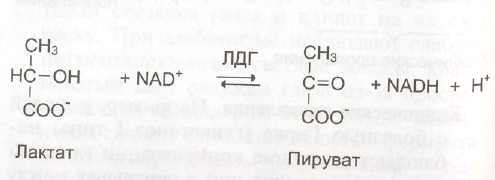
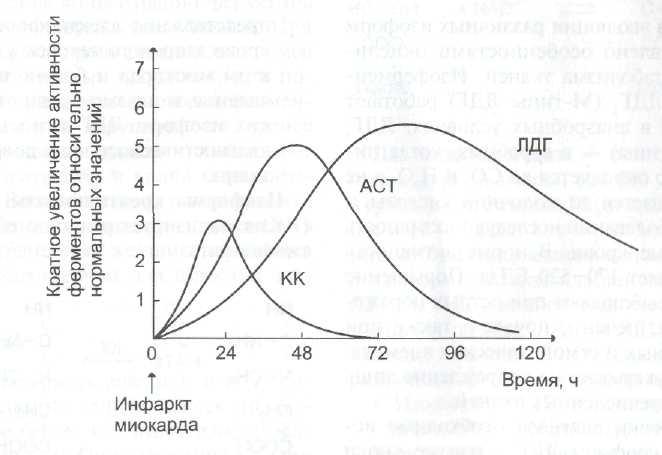
б) При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – АСТ, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы МВ, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.
|
|
|
|

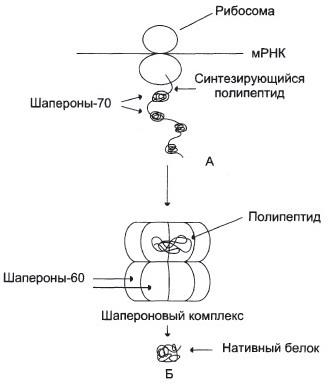 -70
способны защищать белки от температурной
инактивации и восстанавливать
конформацию и активность частично
денатурированных белков.
-70
способны защищать белки от температурной
инактивации и восстанавливать
конформацию и активность частично
денатурированных белков.