
- •Методическое руководство
- •Предисловие
- •1. Скорость химических реакций. Химическое равновесие
- •2. Спецификация теста по теме “Скорость химических реакций. Химическое равновесие”
- •3. Варианты теста Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Библиографический список
- •394026 Воронеж, Московский просп., 14
- •Методическое руководство
2. Спецификация теста по теме “Скорость химических реакций. Химическое равновесие”
Для контроля знаний по данной теме предлагаются тестовые задания, включающие понятия скорости химической реакции, факторы, влияющие на нее, математическое выражение для скорости гомогенной и гетерогенной реакций, зависимость скорости реакции от температуры (правило Вант-Гоффа), представления о химическом равновесии, математическое выражение закона действующих масс (константы равновесия), способы смещения химического равновесия (принцип Ле Шателье).
Перечень объектов контроля:
а) фактологические знания – знание основных научно-технических терминов, фактов и процессов;
б) базовые знания – знание основных понятий и законов;
в) методологические знания и умения – знать и уметь использовать методы теоретического и экспериментального исследования в химии, уметь оценивать численные порядки величин при расчетах
Используется закрытая форма заданий с выборочными ответами. Всего 15 вариантов теста, число заданий 5, к каждому заданию даны несколько ответов, из которых только один правильный. Общее время выполнения теста 45 минут. За каждое правильно выполненное задание начисляется 2 балла. Максимальная сумма баллов 10. Предлагается следующая категория пересчета по пятибалльной системе
9-10 – 5;
7-8 – 4;
5-6 – 3.
3. Варианты теста Вариант 1
А 1. Скорость реакции уменьшается при
понижении температуры с 35°С до 15 °С при
![]() в
в
1) 2,5 раза 2) 20 раз 3) 2,520 раз 4) 50 раз 5) 6,25 раза
А 2. Повышение температуры в системе
![]()
![]() приведет к
приведет к
1) уменьшению концентрации
![]()
2) увеличению концентрации
![]()
3) увеличению концентрации
4) уменьшению концентрации
![]()
5) смещению равновесия вправо (→)
А 3. Скорость прямой реакции
![]()
![]()
при увеличении давления смеси в 4 раза изменится
1) уменьшится в 4 раза
2) увеличится в 4 раза
3) увеличится в 16 раз
4) правильного ответа нет
5) уменьшится в 16 раз
А 4. Константа равновесия реакции
![]()
![]()
соответствует выражению
1)
 2)
2)
 3)
3)

4)
 5)
5)
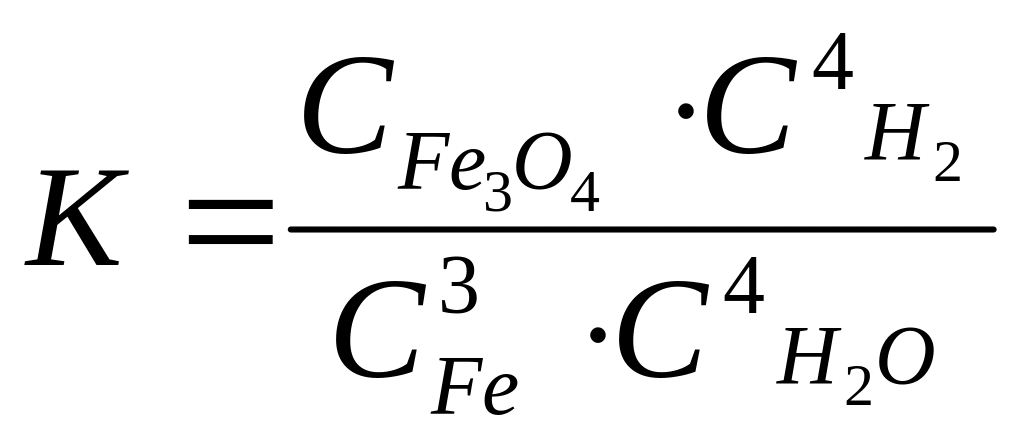
А 5. В состоянии равновесия в реакции
![]()
![]()
концентрации равны
![]() моль/л
и
моль/л
и
![]() 8
моль/л.
8
моль/л.
Исходная концентрация О2 (моль/л) равна
исходных данных недостаточно для
получения ответа
1) 4 2) 5 3) 4) 12 5) 12,2
Вариант 2
А 1. При повышении температуры от 90°С
до 130°С при
![]() 3
скорость реакции увеличится в
3
скорость реакции увеличится в
1) 3 раза 2) 9 раз 3) 27 раз 4) 12 раз 5) 81 раз
А 2. Понижение давления в системе
![]() приведет к
приведет к
1) увеличению концентрации
2) уменьшению концентрации
3) увеличению концентрации паров![]()
4) уменьшению концентрации паров
5) сохранению концентрации паров
А 3. Реакция идет по уравнению А(газ) + 2В(газ) → С(газ)
Скорость реакции при концентрации для вещества А 0,3 моль/л и вещества В 0,4 моль/л равна 0,024 моль/л*с. Константа скорости реакции (л2/моль2*с) равна
1) 0,2 2) 0,3 3) 0,4 4) 0,5 5) 0,6
А 4. Константа равновесия реакции
![]()
![]()
соответствует выражению
1)
 2)
2)
 3)
3)
4)
 5)
5)

А 5. В состоянии равновесия в реакции
![]()
![]() концентрации равны
концентрации равны
![]() 6 моль/л,
6 моль/л,
![]() 3
моль/л. Исходная концентрация
3
моль/л. Исходная концентрация
![]() (моль/л)
равна
(моль/л)
равна
1) 2,5 2) 8,5 3) 3,5 4) 10,5 5) 12
