
- •Содержание
- •Лабораторная работа № 1 термохимические измерения
- •1. Определение теплоемкости калориметра
- •2. Определение теплоты нейтрализации
- •1000 Мл 1 h нСl содержат 36,5 г нСl
- •10 Мл 1 h нСl содержат х г нСl
- •Следовательно, удельный тепловой эффект равен
- •3. Определение теплоты растворения соли в воде
- •Лабораторная работа № 2 определение давления насыщенного пара
- •Лабораторная работа №3 парциально-молярный объем
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №4 определение константы равновесия гомогенной реакции
- •В ионном виде уравнение реакции можно представить в виде:
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №5 криоскопия
- •Порядок выполения работы
- •Контрольные вопросы
- •Гетерогенные равновесия
- •Так как число переменных уменьшается на единицу (либо давление, либо температура постоянны). Лабораторная работа № 6 термический анализ двухкомпонентной системы
- •Лабораторная работа № 7 диаграммы состояния ограниченно смешивающихся жидкостей
- •394026 Воронеж, Московский просп., 14
- •Методические указания
Контрольные вопросы
по теме “Химическое равновесие”
Термодинамическое обоснование и формулировка закона действующих масс.
Какая зависимость существует между константами равновесия, выраженными различными способами?
Каковы термодинамические и молекулярно-кинетические признаки равновесного состояния?
От чего зависят Kp и Kc реакции? От чего не зависят?
Как, исходя из уравнения изохоры и изобары, предвидеть влияние температуры на константу равновесия?
Уравнение изотермы химической реакции и его исследование.
Какова связь между стандартными изменениями изобарного потенциала (GT) и константой равновесия химической реакции?
Как можно сместить химическое равновесие при постоянной температуре?
Как определить наступление равновесия в реакционной смеси?
Что называют выходом продукта и как его рассчитать?
Как рассчитать тепловой эффект химической реакции, зная Kp или Kc при разных температурах?
Как определить равновесные концентрации реагирующих веществ и константу равновесия данной реакции?
Лабораторная работа №5 криоскопия
Давление насыщенного пара растворителя понижается при растворении в нем какого-либо вещества. Если растворенное вещество и растворитель не образуют твердого раствора, то температура кристаллизации раствора ниже температуры кристаллизации растворителя. Понижение температуры кристаллизации пропорционально концентрации растворенного вещества:
![]() , (1)
, (1)
где T – понижение температуры кристаллизации; Eкр – криоскопическая константа растворителя; m – концентрация раствора, выдержанная в молях растворенного вещества на 1000 г растворителя (моляльность).
Криоскопическая константа вычисляется по формуле
![]() ,
,
где T0 – температура кристаллизации растворителя; R – универсальная газовая постоянная; - удельная теплота плавления растворителя.
Криоскопическая константа зависит только от свойств растворителя. Например, для воды Eкр = 1,86.
Моляльность m выражается через массу растворителя (g1), массу растворенного вещества (g2) и молекулярную массу растворенного вещества (2):
![]() (2)
(2)
Подставив значение m из (2) в (1), получим:
![]() ,
,
откуда следует, что
![]() . (3)
. (3)
Таким образом, для нахождения молекулярной массы растворенного вещества нужно знать массы растворителя и растворенного вещества, криоскопическую константу и понижение температуры кристаллизации раствора, определяемое опытным путем.
Для растворов электролитов понижение температуры кристаллизации значительно выше и вычисляется по формуле
![]() ,
,
где i – изотонический коэффициент Вант-Гоффа, показывающий, во сколько раз увеличилось число частиц в растворе вследствие диссоциации.
Цель работы – определение молекулярной массы растворенного вещества криоскопическим методом.
Т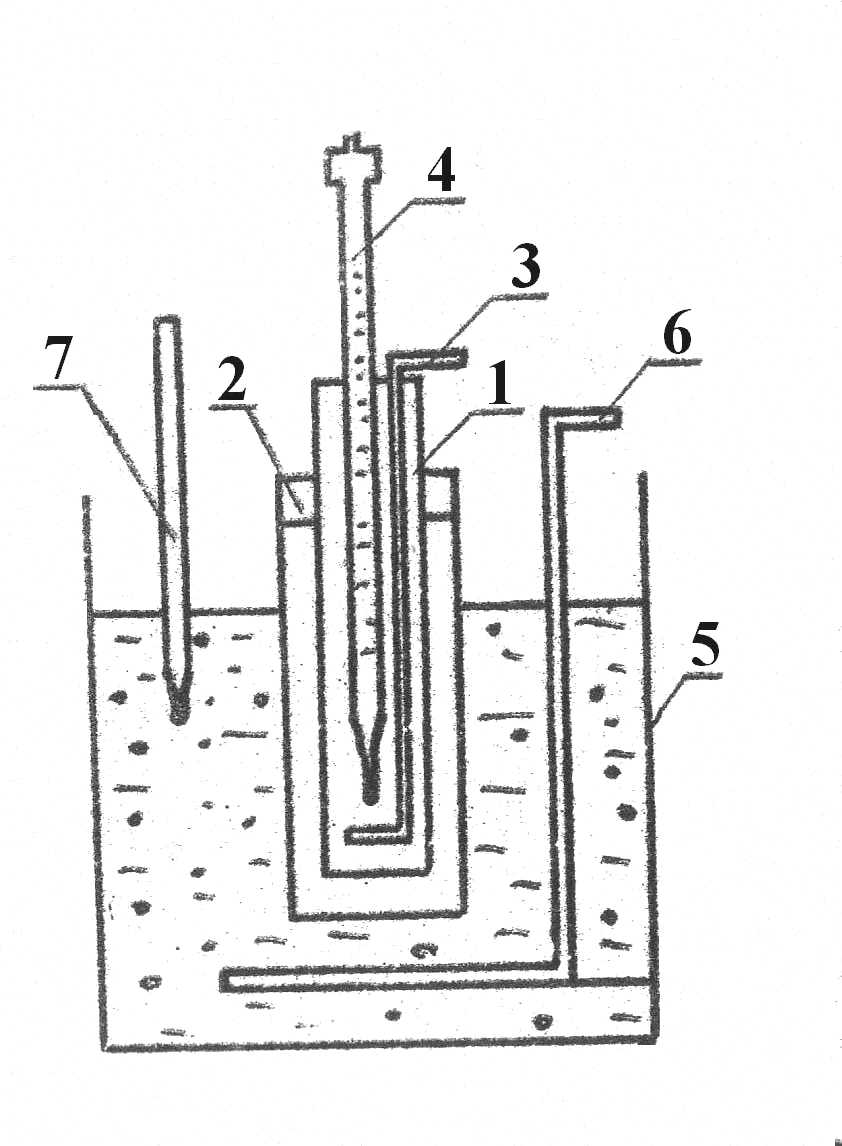 ак
как уравнение (1) справедливо только для
разбавленных растворов, то T
должно быть малой величиной, не
превосходящей несколько десятых долей
градуса. Поэтому температуры кристаллизации
должны измеряться с большой точностью
с помощью термометра Бекмана, описание
которого дано в работе № 1.
ак
как уравнение (1) справедливо только для
разбавленных растворов, то T
должно быть малой величиной, не
превосходящей несколько десятых долей
градуса. Поэтому температуры кристаллизации
должны измеряться с большой точностью
с помощью термометра Бекмана, описание
которого дано в работе № 1.
