
- •Содержание
- •Лабораторная работа № 1 термохимические измерения
- •1. Определение теплоемкости калориметра
- •2. Определение теплоты нейтрализации
- •1000 Мл 1 h нСl содержат 36,5 г нСl
- •10 Мл 1 h нСl содержат х г нСl
- •Следовательно, удельный тепловой эффект равен
- •3. Определение теплоты растворения соли в воде
- •Лабораторная работа № 2 определение давления насыщенного пара
- •Лабораторная работа №3 парциально-молярный объем
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №4 определение константы равновесия гомогенной реакции
- •В ионном виде уравнение реакции можно представить в виде:
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №5 криоскопия
- •Порядок выполения работы
- •Контрольные вопросы
- •Гетерогенные равновесия
- •Так как число переменных уменьшается на единицу (либо давление, либо температура постоянны). Лабораторная работа № 6 термический анализ двухкомпонентной системы
- •Лабораторная работа № 7 диаграммы состояния ограниченно смешивающихся жидкостей
- •394026 Воронеж, Московский просп., 14
- •Методические указания
Контрольные вопросы
по теме “Парциально-молярные величины”
Какие свойства системы называются экстенсивными, а какие интенсивными?
Что такое парциально-молярные величины компонентов раствора?
Что такое парциально-молярный объем? Каким методом он определяется?
Какими способами выдерживается постоянство состава раствора при определении парциально-молярных величин?
Методы определения парциально-молярных величин.
Лабораторная работа №4 определение константы равновесия гомогенной реакции
Химические реакции делятся на гомогенные и гетерогенные. Реакции, протекающие в пределах одной фазы,
называются гомогенными. К гомогенным реакциям относятся многие химические процессы, протекающие в газовой фазе или растворах.
Рассмотрим гомогенную реакцию, протекающую по следующему уравнению:
aA + bB eE + fF.
Указанная химическая реакция протекает самопроизвольно до состояния химического равновесия. Термодинамически химическое равновесие определяется как соотношение концентраций продуктов и исходных веществ, при котором свободная энергия имеет минимальное значение. Молекулярно-кинетически химическое равновесие определяется как такое состояние, при котором скорости прямой и обратной реакций равны. При этом равновесие наступает тогда, когда состав реакционной смеси с течением времени при постоянных внешних условиях не изменяется.
Для установления истинного равновесия можно пользоваться вторым признаком равновесия – признаком его подвижности. Если система, находящаяся в равновесии, будет в значительной степени выведена из этого положения внешним воздействием, а по прекращении последнего самопроизвольно возвратится в прежнее состояние, то это означает, что рассматриваемое состояние является равновесным.
Система, состояние которой характеризуется двумя признаками – неизменностью состава и подвижностью, называется равновесной, а состав ее – равновесным составом.
Константу равновесия можно выразить через равновесные концентрации или равновесные парциальные давления веществ, участвующих в реакции:
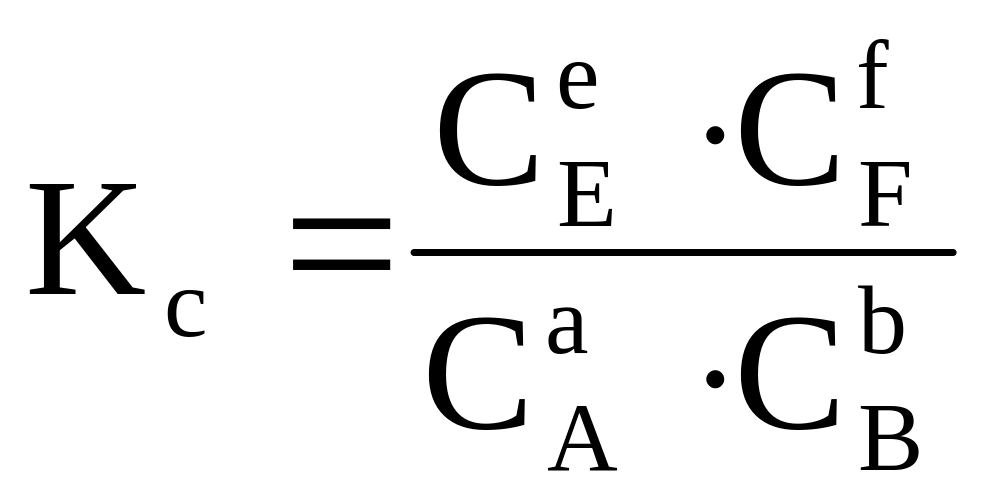 , (1)
, (1)
или 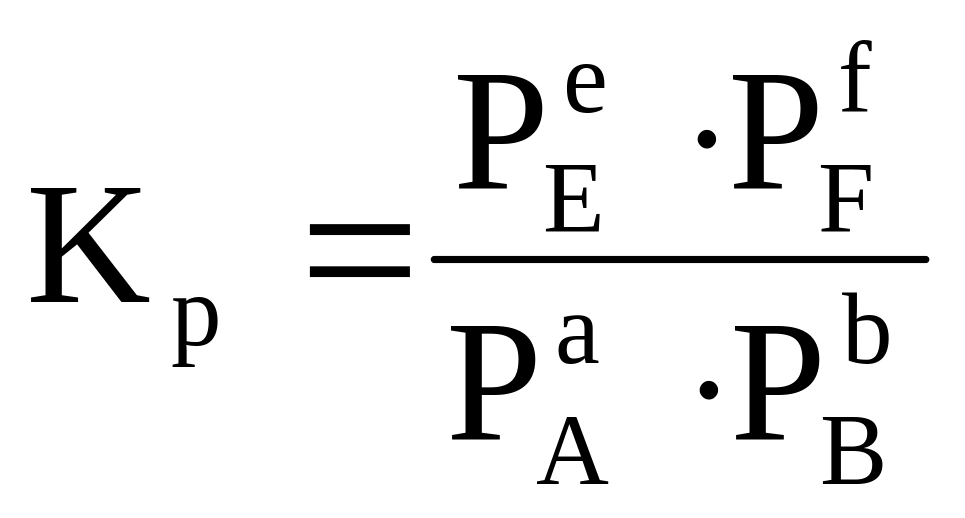 ).
(2)
).
(2)
Между константами, выраженными различным способом, существует следующая связь:
Kp = Kc (RT)n, (3)
где n – изменение числа моль газообразных веществ реакции (n = nпрод. – nисх.вещ-в).
Таким образом, константа химического равновесия (закон действующих масс) – это отношение произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам. Это величина постоянная при данной температуре. Равновесие системы может смещаться при изменении начальных концентраций реагирующих веществ. Константа же равновесия остается постоянной при данной температуре. Поэтому, зная константу равновесия при каких-либо внешних условиях и начальных концентрациях реагирующих веществ, можно найти выход продуктов реакций – число моль веществ, получившихся в результате реакции, протекающей из определенного начального состояния в состояние равновесия. По величине константы равновесия может быть рассчитано GT (стандартное изменение изобарного потенциала), так как из уравнения изотермы реакции следует:
GT = RT lnKp (4)
и
FT = RT lnKc. (5)
зависимость константы равновесия реакции от температуры описывается уравнением Вант-Гоффа:
изохора
![]() (6)
(6)
и
изобара
![]() (7)
(7)
(при V или P = const); R – универсальная газовая постоянная; T – абсолютная температура; Kc и Kp – константы равновесия.
Если
U
> 0, то химическая реакция идет с
поглощением тепла (реакция эндотермическая),
и производная
![]() ,
следовательно, константа равновесия с
увеличением температуры возрастает.
,
следовательно, константа равновесия с
увеличением температуры возрастает.
Если
U
< 0, т.е. химическая реакция идет с
выделением тепла (реакция экзотермическая),
то производная
![]() ,
следовательно, константа равновесия с
увеличением температуры уменьшается.
,
следовательно, константа равновесия с
увеличением температуры уменьшается.
В данной работе исследуется химическое равновесие на примере реакции:
2FeCI3 + 2KJ 2FeCI2 + J2 + 2KCI.
