
- •Аналитическая химия
- •Авторский коллектив:
- •Рецензенты:
- •Введение
- •Глава 1 основы качественного анализа
- •1.1. Качественный анализ неорганических веществ
- •1.1.1. Аналитическая классификация катионов
- •1.1.2. Аналитическая классификация анионов
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 2 количественный химический анализ
- •2.1. Сущность и характеристика
- •Гравиметрического метода анализа
- •2.1.1. Операции гравиметрического анализа
- •2.1.2. Отбор средней пробы и подготовка её к анализу
- •2.1.3. Расчет навески для анализа и взвешивание
- •2.1.4. Вскрытие навески
- •2.1.5. Устранение влияния мешающих компонентов
- •2.1.6. Осаждение определяемой составной части вещества в виде малорастворимого соединения
- •2.1.6.1. Механизм образования осадков
- •2.1.6.2. Влияние условий осаждения на структуру осадка
- •2.1.6.3. Причины загрязнения осадков
- •2.1.6.4. Старение осадков
- •2.1.7. Фильтрование и промывание осадков
- •2.1.7.1. Правила фильтрования
- •2.1.7.2. Промывные жидкости
- •2.1.7.3. Высушивание, прокаливание осадков
- •2.1.7.4. Техника получения гравиметрической формы и ее взвешивание
- •2.1.8. Расчет количества определяемого вещества
- •2.1.9. Метрологическая оценка результатов анализа
- •Математическая обработка результатов количественного анализа
- •Влияние отдельных ошибок на конечный результат
- •Значащие цифры
- •Определение гигроскопичной воды Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение SiO2 в силикате
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение оксида серы so3
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение полуторных оксидов Al2o3, Fe2o3, TiO2
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •2.2. Сущность и характеристика титриметрического метода анализа
- •2.2.1. Стандартизация растворов титрантов
- •2.2.2. Основные приемы титрования
- •2.2.3. Расчеты в титриметрическом анализе Химический эквивалент
- •Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •Расчет результата в методах обратного титрования
- •2.2.4. Кривые титрования
- •2.2.5. Основные методы титриметрического анализа
- •2.2.6. Кислотно-основное титрование
- •2.2.6.1. Рабочие растворы
- •2.2.6.2. Кривые титрования и выбор индикатора
- •100,0 Мл 0,1 н hCl 0,1 н раствором NaOh
- •100,0 Мл 0,1 м уксусной кислоты 0,1 м раствором NaOh
- •2.2.7. Комплексонометрическое титрование
- •Синий цвет
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •2.2.8. Титрование по методу осаждения
- •2.2.8.1. Аргентометрия
- •2.2.8.2. Кривые титрования и способы обнаружения конечной точки титрования
- •Порядок выполнения работы
- •2.2.9. Окислительно-восстановительное титрование
- •2.2.9.1. Перманганатометрия
- •2.2.9.2. Способы обнаружения конечной точки титрования
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 3 спектральные методы анализа
- •3.1. Принципы аналитической оптической спектроскопии
- •3.2. Основные узлы и приборы для аналитической оптической спектроскопии
- •3.3. Молекулярная абсорбционная спектроскопия
- •3.3.1. Основной закон светопоглощения - закон Бугера-Ламберта-Бера
- •Таким образом
- •3.3.1.1. Ограничения и условия применения закона Бугера-Ламберта-Бера
- •3.3.1.2. Аппаратура в молекулярной абсорбционной спектроскопии
- •3.4. Молекулярная спектроскопия в инфракрасном диапазоне (икс)
- •3.4.1. Задачи, решаемые инфракрасной спектроскопией
- •Лабораторная работа № 7
- •Цель работы
- •Теоретическая часть
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Концентрация Оптическая
- •Глава 4 электрохимические методы анализа
- •4.1. Потенциометрические методы
- •4.1.1. Методы проведения потенциометрического анализа
- •4.1.2. Потенциометрическое титрование
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •4.2. Кулонометрический анализ
- •4.2.1. Установка для кулонометрического титрования
- •4.3. Кондуктометрические методы анализа
- •4.3.1. Прямая кондуктометрия
- •4.3.2. Кондуктометрическое титрование
- •Выполнение кондуктометрических измерений с помощью учебно-лабораторного комплекса «Химия»
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 5 хроматографические методы анализа
- •5.1. Хроматографические параметры
- •5.2. Обработка хроматограмм
- •5.3. Жидкостная хроматография
- •5.4. Газовая хроматография
- •5.5. Тонкослойная хроматография (тсх)
- •5.5.1. Параметры тонкослойной хроматографии
- •5.5.2. Количественные характеристики эффективности разделения в тсх
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 6 микроскопические методы исследования
- •6.1. Принцип работы и конструкция сзм NanoEducator
- •6.2. Техническая спецификация оборудования NanoEducator
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Заключение
- •Библиографический список Основная литература
- •Дополнительная литература
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Посуда, приборы, реактивы
раствор трилона Б 0,05 н., аммонийная буферная смесь, 2 н. раствор гидроксида натрия NaOH, эриохром черный Т (тонкоизмельченная смесь с NaCl в отношении 1:1), мурексид.
Порядок выполнения работы
Сначала определяют объем трилона Б, идущий на одновременное связывание ионов кальция и магния. Для этого пипеткой берут 50 мл фильтрата, полученного после осаждения гидроксидов, переносят в коническую колбу, добавляют 50 мл аммонийной буферной смеси, на кончике лопатки индикатор эриохром черный Т (20 – 30 мл) размешивают и оттитровывают рабочим раствором трилона Б до перехода винно-красной окраски в синюю с зеленоватым оттенком.
Затем определяют объем трилона Б, идущий на связывание только ионов кальция. Для этого к 50 мл исследуемого раствора добавляют 100 мл 2 н. раствора NaOH, на кончике лопатки мурексид и титруют трилоном Б до перехода розовой окраски в фиолетово-сиреневую.
Зная объем раствора, израсходованного на титрование Ca2+ и Mg2+ c эриохромом черным Т, объем раствора, пошедший на титрование Ca2+, находят объем раствора комплексона, который расходуется на титрование Mg2+. Расчеты ведут по формулам:
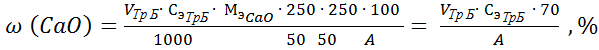 ;
;
![]() ;
;
![]() CaO
=
CaO
=
![]() MgO
=
MgO
=
![]()
Выводы
Укажите значение комплексонометрического метода титрования для определения содержания оксидов кальция и магния в цементе и материалах цементного производства.
2.2.8. Титрование по методу осаждения
2.2.8.1. Аргентометрия
Методы осадительного титрования имеют ограниченное значение. Лишь очень немногие процессы осаждения отвечают всем требованиям, предъявляемым к реакциям в титриметрии. Ограничения связаны главным образом с неколичественным и нестехиометрическим протеканием реакций. Необходимым требованиям удовлетворяют с этой точки зрения реакции осаждения галогенидов и тиоцианата серебра (аргентометрия), а также ряда соединений ртути (I). Аргентометрия основана на применении в качестве титранта раствора нитрата серебра AgNO3. Этим методом определяют галогенид- и роданид-ионы по реакции
Ag+ + X- → AgX↓ (X = Cl-, Br-, I-, SCN-).
2.2.8.2. Кривые титрования и способы обнаружения конечной точки титрования
В процессе титрования изменяется концентрация осаждаемого иона, например А, поэтому кривые титрования целесообразно строить в логарифмических или линейных координатах р[А]—f (логарифмические кривые) или [А]—-f (линейные кривые). В зависимости от стехиометрии осадка логарифмические кривые могут быть симметричными (если образуется осадок типа АВ) и асимметричными (если образуется осадок состава АnВm).
Метод Мора. Индикатором служит хромат-ион, который образует краснокирпичный осадок Ag2CrО4, более растворимый, чем галогениды серебра. При титровании хромат серебра не образуется, пока не будет оттитрован галогенид-ион. Важно правильно выбрать концентрацию хромат-ионов. Если она будет очень мала, потребуется слишком большой избыток ионов серебра для образования наблюдаемого визуально осадка. При слишком большой концентрации СrО42- образование осадка начинается раньше, чем оттитруется галогенид-ион. В пределах погрешности титрований ± 0,1% концентрацию СrО42- можно изменять от 0,35 М до 1,1∙ 10-4 М (при C0Cl- = 0,1 М). На практике обычно создают концентрацию СrО42-, равную 0,01— 0,005 М. Титрование по методу Мора следует проводить в слабокислой среде.
В кислой среде необходимо учитывать протолитическую реакцию
СrО42- + H+ НСrО4- и 2НСrО4- Cr2O72- + Н2O. В щелочной среде следует иметь в виду возможность протекания реакций
Ag++OH-
![]() AgOH↓
AgOH↓
2AgOH![]() Ag2O
+ H2O
Ag2O
+ H2O
Метод Мора непригоден для определения иодид- и тиоцианат-ионов.
Метод Фольгарда. Метод основан на титровании раствора ионов Ag+ раствором KSCN в присутствии ионов Fe (III):
Ag+ + SCN- AgSCN↓
Fe3+ + nSCN- Fe(SCN)n(3-n)+
После оттитровывания ионов Ag избыток титранта образует с ионами Fe3+ красный комплекс. Обычно создают концентрацию Fe(III) около 0,01 М. Титрование проводят в кислой среде.
Для определения анионов (СГ, Br-, CN-, СО32-, CrO42-, S2-, РO43-) этим методом используют обратное титрование. К раствору титруемого иона добавляют избыток стандартного раствора нитрата серебра. После образования осадка оттитровывают избыток Ag+ стандартным раствором KSCN в присутствии раствора хлорида железа (III). При образовании осадков, менее растворимых, чем AgSCN, возможно непосредственное титрование избытка Ag+ над осадком, но при определении Сl- более растворимый AgCl может частично перейти в AgSCN, поэтому необходимо отделить его (фильтрованием или добавлением тяжелого органического растворителя, покрывающего осадок и предохраняющего его от контакта с раствором).
Лабораторная работа № 5
Определение хлорид-ионов в образцах бетона
Цель работы
Используя метод Фольгарда, определить массовую долю хлорид-ионов в образцах бетона.
Теоретическая часть
Объемный аргентометрический метод основан на осаждении в азотнокислой среде хлорид-иона избытком азотнокислого серебра с последующим обратным титрованием этого избытка роданистым аммонием или роданистым калием в присутствии индикатора - железоаммонийных квасцов.
Посуда, приборы, реактивы
Сушильный шкаф с термометром, электроплитка, тигли фарфоровые, весы технические и аналитические с разновесами, стаканы химические на 100 мл, палочки стеклянные, воронки, фильтры (белая лента), фильтры (синяя лента), растворы 2 н. азотной кислоты HNO3, 0,1 н. нитрата серебра AgNO3, соляной кислоты HCl (1 : 3), 5 % раствор карбоната натрия Na2CO3, растворы азотной кислоты HNO3 (1 : 40) , 6 н., 40 % раствор железоаммонийных квасцов, 0,1 н. раствор роданистого аммония NH4CNS, 0,1 н. раствор хлористого натрия, 2 бюретки, колбы на 250 мл для титрования, колбы на 500 мл для промывания осадков, пробирки с делениями, нарезанная фильтровальная бумага, пипетка, бюксы металлические для хранения сыпучих веществ, эксикатор, промывалка лабораторная.
