
- •Часть 1
- •Лабораторная работа №1 исследование структуры металлов и сплавов с помощью светового микроскопа
- •Лабораторная работа №2 методы количественной металлографии
- •Лабораторная работа №3 структурные и фазовые превращения в твердом состоянии
- •Лабораторная работа №4 анализ диаграмм состояния двойных систем
- •14. Как будет выглядеть эвтектический сплав после кристаллизации?
- •Часть 1
- •394026 Воронеж, Московский просп., 14
Лабораторная работа №4 анализ диаграмм состояния двойных систем
Цель работы: ознакомление с диаграммами состояния двойных систем, методами их построения и исследования.
Оборудование и материалы: компоненты для приготовления сплавов, аналитические весы, тигли, печь, термопары, самопишущий потенциометр, диаграммы состояния.
Диаграмма состояния представляет собой графическое изображение состояния сплава в координатах температура -концентрация, которое позволяет определить в условиях равновесия фазовый состав и структуру любого сплава при любой температуре. Диаграмма состояния показывает устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Фаза - однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела при переходе через которую химический состав вещества изменяется скачком.
Закономерность изменения числа фаз в системе определяется правилом фаз, или законом Гиббса:
c = k-f+2, (21)
где с - число степеней свободы (вариантность) системы, т.е. число внешних и внутренних факторов (температура, давление, концентрация), которое можно изменить без изменения числа фаз в системе;
k - количество компонентов (вещества, образующие систему) в сплаве;
f- число фаз в сплаве;
2 -- число изменяющихся внешних факторов (давление, температура).
Так как при обычных условиях небольшими изменениями барометрического давления можно пренебречь, то
c = k-f+1, (22)
Экспериментальное построение диаграмм
Для построения реальных диаграмм состояния необходимо знать температуры фазовых превращений (критические точки) металлов и сплавов. Для этой цели обычно определяют изменения теплосодержания (термический анализ) и теплового расширения (дилатометрический анализ).
Метод термического анализа
Фазовое превращение - плавление (или кристаллизация), изменение типа кристаллической решетки, растворение (или выделение) избыточной фазы вызывает изменение теплосодержания. Обычно для построения диаграмм состояния пользуются результатами термического анализа, т.е. строят кривые охлаждения и по остановкам и перегибам на этих кривых, вызванным тепловым эффектом превращений, определяют температуры превращения.
Температуру металлов измеряют обычно при помощи термопары. Температура кристаллизации определяется следующим образом. В печь 1 (рис.7) помещают тигелек 2, в котором расплавляют исследуемый сплав 3. Затем в расплав погружают горячий спай 4 термопары 5 (защищенной фарфоровым или кварцевым колпачком 6), холодный спай 7 присоединяют к входу самопишущего потенциометра 8, который записывает кривые охлаждения, и выключают печь.

Рис.7. Схема установки для изучения процесса кристаллизации термическим методом
Начинается охлаждение. Появление изменений в агрегатном состоянии в связи с выделением скрытой теплоты превращения отражается на кривой температура - время.
Имея достаточное количество сплавов, и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. Для более точного построения диаграммы состояния в дополнение к термическому методу изучают с помощью микроскопа и рентгеновских лучей структуру сплавов разного состава и по-разному обработанных термически, измеряют физические свойства сплавов, проводят испытания механических свойств и т.д.
Процесс построения диаграммы состояния по критическим точкам кривых охлаждения представлен на рис.8. Рассмотрим применение правила фаз Гиббса при построении и анализе кривых охлаждения. Если с = 1 (система моновариантна), то это означает, что данное превращение осуществляется в диапазоне температур в двухфазной области, причем число фаз в сплаве (системе) не изменяется при изменении температуры в этом диапазоне. Если с = 0 (система нонвариантна или безвариантна), то это означает трехфазное равновесие при постоянной температуре, и здесь нельзя изменить температуру, не изменив числа фаз в системе. Трехфазным состояниям сплава на кривой охлаждения соответствуют остановки изменения температуры во времени, т.е. появляются горизонтальные площадки.
Для определения концентрации (химического состава) фаз в двухфазных областях необходимо провести горизонталь (ко-ноду), соответствующую выбранной температуре до пересечения с линиями диаграммы, ограничивающими данную двухфазную область (рис.9). Проекции точек пересечения концов а и в коноды с линиями диаграммы на ось концентраций указывают химический состав соответствующих фаз (точки а и в ). Масса фаз в двухфазной области при заданной температуре определяется по правилу отрезков: масса фаз обратно пропорциональна отрезкам коноды (рис. 9):
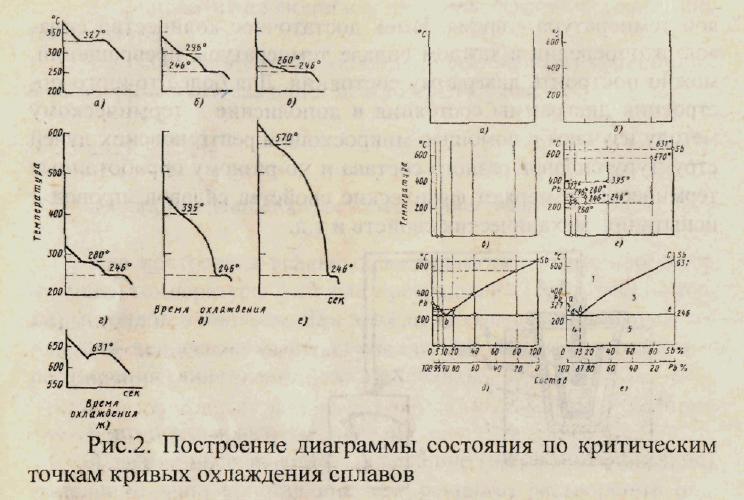
Рис. 8. Построение диаграммы состояния по критическим точкам кривых охлаждения сплавов

Рис. 9. Определение химического состава и массы фаз
Qж
=
![]() ;
Qα =
;
Qα =
![]()
Дилатометрический анализ заключается в фиксировании изменений длины образцов при нагреве (охлаждении) или в изотермических условиях. Его применяют для определения температур превращений, протекающих в твердом состоянии.
Если в металлах или сплавах при изменении температуры не происходит фазовых превращений, то их длина (объем) изменяется плавно. Однако если происходит фазовое превращение, то длина (или объем) растет (или убывает) скачкообразно.
Изменение длины (или объема) во времени в изотермических условиях позволяет определить кинетику превращений, поскольку степень этих превращений во времени пропорциональна изменениям фазы (или объема).
Достоинством дилатометрического анализа по сравнению с термическим является независимость его результатов от скорости охлаждения или нагрева (если при этом не изменяется тип превращения).
Для регистрации изменений длины применяют различные методы и приборы - дилатометры - механические, оптические и электрические. В первых из них линейное перемещение фиксируется с помощью индикатора или пера на диаграммной бумаге, находящейся на вращающемся барабане, во втором - либо непосредственно различными компараторами, катетометрами или микроскопами, либо с использованием оптического рычага, когда поступательное движение от расширения образца преобразуется во вращательное, фиксируемое по перемещению светового блика на шкале. Существует несколько конструкций дилатометров, когда линейное перемещение преобразуется в электрический сигнал, например с помощью фотоэлектрических или электронных ламповых устройств, а также различных датчиков - тензометрических, индукционных или емкостных. На основе таких преобразователей созданы автоматические дилатометры с программным управлением и дилатометры для фиксирования быстропротекающих процессов при скоростном нагреве или охлаждении.
Для определения температур в дилатометрах используют термопары, а во многих конструкциях - дилатометрические пирометры, т.е. образцы-эталоны, характеризующиеся плавным изменением коэффициента расширения при нагреве или охлаждении. Поэтому по величине расширения (сжатия) эталона можно точно определить их температуру. Достоинством таких дилатометрических пирометров является безынерционность и более точная оценка температуры образца, нагреваемого в тех же условиях, что и эталон, поскольку он фиксирует температуру не в какой-либо одной точке, а усредненную по всей длине образца.
Механические и физические свойства сплавов сильно зависят от их фазового состава, который может быть определен в равновесном состоянии по диаграмме состояния. Для систем с неограниченной растворимостью компонентов в твердом состоянии твердость, удельное электросопротивление, коэрцитивная сила и ряд других свойств всегда выше, чем для исходных компонентов, образующих сплав. Например, при растворении в железе до 2% кремния и марганца его прочность повышается в два раза при снижении пластичности на 10%; растворение 5% алюминия в меди также в два раза повышает прочность последней без снижения пластичности; растворение в железе до 30% никеля понижает точку Кюри до комнатных температур, а 13% хрома делает сталь нержавеющей.
Связь между диаграммами состояний и диаграммами свойств (диаграммами Курнакова) представлена на рис.10.
Сплавы на базе твердых растворов лучше обрабатываются давлением, чем резанием. Литейные свойства твердых растворов низкие. Наилучшей жидкотекучестью и низкой склонностью к усадке обладают эвтектические сплавы. Механические свойства (твердость, прочность) и электросопротивление электрических сплавов занимают промежуточное положение между аналогичными свойствами чистых компонентов и фаз, образующих механическую смесь, но такие сплавы плохо обрабатываются давлением.
Такие фазы, как карбиды, нитриды, бориды, оксиды, металлические соединения, имеют, в общем случае, свойства, резко отличающиеся от свойств компонентов, их образующих, и, как правило, обладают высокими твердостью, хрупкостью, износостойкостью и температурами плавления.
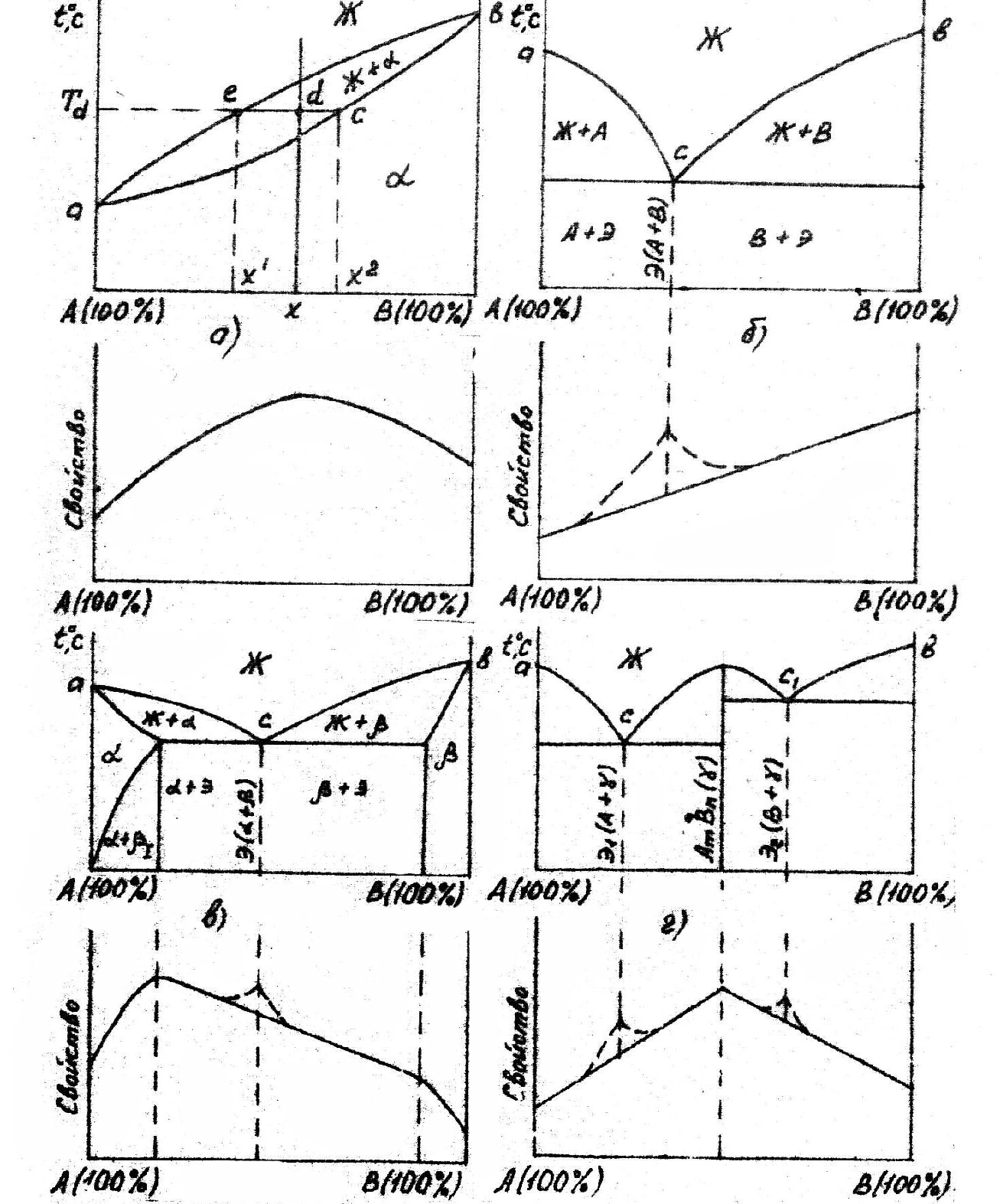
Рис. 10. Диаграммы состояния состав - свойства (диаграммы Курнакова)
Их присутствие в структуре сплава повышает твердость и электросопротивление, снижая магнитную проницаемость и пластичность. Связь структуры сплава с его свойствами определяет важность знания строения сплава и умения управлять фазовым составом.
Типичные микроструктуры двойных сплавов
Диаграммы состояния показывают в условиях равновесия фазовый состав сплава в зависимости от температуры и концентрации и позволяют качественно характеризовать многие физико-химические, механические и технологические свойства сплавов.
Анализ диаграмм состояния позволяет решать важные инженерные задачи; на основании диаграмм возможно определить, какие именно сплавы и в каком направлении изменяют свою структуру, и многие свойства при переходе к неравновесному состоянию, зависящему от реальных условий литья, обработки давлением и специально выполняемой термической обработки.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии и эвтектикой показана на рис.11.

Рис. 11. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии: а - фазовая диаграмма; б – структурная диаграмма
В этой системе не образуются фазы, представляющие собой чистые компоненты. Из жидкости могут выделяться только твердые растворы α или β. Следовательно, около вертикалей А и В, соответствующих чистым компонентам, находятся области существования твердых растворов α или β. Предельная растворимость компонента В в А определяется линией CF, а предельная pacтворимость А в В - линией DG. Сплавы, находящиеся между этими линиями, находятся за пределами растворимости и являются двухфазными, состоящими из α + β. Окончание кристаллизации происходит по эвтектической реакции:
Ж → αС + βD
Реакция эта нонвариантна, так как при двух компонентах в реакции участвуют три фазы (с = k - ф + 1 = 2-3 + 1 = 0).
Все три фазы, участвующие в реакции, имеют определенные составы (проекции точек Е, В, С) и температура их превращения постоянна.
Линия А1ЕВ является на этой диаграмме линией ликвидус, линия A1CEDB1 - линией солидус. Зная правило фаз и правило отрезков, можно проследить за процессом кристаллизации любого сплава.
Выделение вторичных кристаллов из эвтектических со-ставляющих обычно не обнаруживается при микроскопическом исследовании, так как вторичные выделения объединяются с такой же (одноименной) фазой эвтектики.
Несмотря на многообразие структурных составляющих (первичный α -твердый раствор, вторичные кристаллы β - твердого раствора, эвтектика α + β), окончательно охлажденный сплав содержит только две фазы α и β, и правило фаз, если его применить ниже линии CD, покажет все количество α- и β -фаз независимо от того, в какой структурной форме они находятся.
Кривые охлаждения и схемы структур различных сплавов при различных температурах показаны на рис.12 и 13.

Рис. 12. Кривая охлаждения и схема структуры сплава, образующего при кристаллизации твердый раствор с последующим выделением вторичной фазы
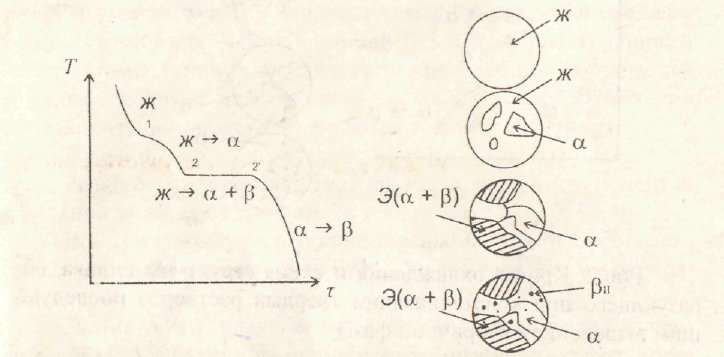
Рис. 13. Кривая охлаждения и схема структуры доэвтектического сплава
Кристаллы β, выделившиеся из твердого раствора, называются вторичными кристаллами и часто обозначаются символом βll в отличие от первичных β-кристаллов (βl), выделяющихся из жидкости. Процесс выделения вторичных кристаллов из твердой фазы носит название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой фазе.
Нужно отметить, что сплав, концентрация которого лежит левее точки F, не будет иметь вторичных выделений β-кристаллов.
Точка С для твердого раствора α показывает максимальную растворимость компонента В в компоненте А при наиболее благоприятных условиях.
При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов Ж + α → β. Реакция подобного типа называется перитектической.
Диаграмма с перитектическим превращением показана на рис. 14. На диаграмме показаны три однофазные области: жидкость Ж и ограниченные твердые растворы α и β.
Линия АРВ является линией ликвидус, линия АваВ - линией солидус.
Кристаллизация сплава I. Кристаллизация начинается в точке 1 (рис.14), когда из жидкости выпадают кристаллы α-раствора. Затем по мере снижения температуры жидкость меняет свою концентрацию по линии ликвидус от точки 1 до точки Р. а кристаллы α - по линии солидус. По достижении перитектической горизонтали bаР состав жидкости будет отвечать точке Р, а состав кристаллов - точке b. Эти обе фазы реагируют и дают третью фазу β, концентрация которой определяется точкой а - третьей точкой на горизонтали.

Рис. 14. Диаграмма состояния с перитектикой
Перитектическая реакция запишется следующим образом:
ЖР + αb → βа
Количественное соотношение фаз при перитектической реакции, необходимое для образования β-фазы, определяется по правилу отрезков соотношением
(количество α/количество Ж) = аР/bа
В рассматриваемом же сплаве количество участвующих в перитектической реакции кристаллов α и жидкости определяется соотношением
(количество α/количество Ж) = 2Р/b2
т.е. в данном сплаве имеется избыток α -фазы по сравнению с тем количеством, которое необходимо для образования β -кристаллов. Поэтому по окончанию реакции в избытке остаются α -кристаллы. Следовательно, в структуре будут продукты перитектической реакции (т.е. β -кристаллы) и оставшиеся избыточные первичные α -кристаллы. Чем ближе точка 2 лежит к точке а, тем меньше в реакции остается избыточных α-кристаллов.
Для сплава, отвечающего по концентрации точке а, соотношение реагирующих при перитектическом превращении жидкости и α -кристаллов таково, что оно как раз достаточно для образования β -кристаллов предельной концентрации.
 На
рис. 15 показана кривая охлаждения сплава
I;
отдельные моменты кристаллизации
показаны на схемах структур. Для
перитектической кристаллизации
характерно то, что новая β -фаза появляется
на границе реагирующей друг с другом
жидкости и α –кристаллов.
На
рис. 15 показана кривая охлаждения сплава
I;
отдельные моменты кристаллизации
показаны на схемах структур. Для
перитектической кристаллизации
характерно то, что новая β -фаза появляется
на границе реагирующей друг с другом
жидкости и α –кристаллов.
Рис. 15. Кривая охлаждения и схема структуры сплава, в котором перитектическое превращение идет с избытком твердой фазы (структура окружения)
Предельные случаи безвариантных равновесий
Для рассмотрения этого достаточно разобрать эвтектическую и перитектическую реакцию. Также безвариантные превращения в твердом состоянии могут быть описаны реакциями: эвтектоидной и перитектоидной, если вместо жидкого раствора в реакции участвует твердый раствор.
Рассмотрим случаи типа
L ↔ α+β
α + L ↔ β
независимо от агрегатного состояния фаз α, β и L.
Из рис. 16 видно, что эвтектическая диаграмма (рис. 16, а) при наличии граничных твердых растворов α и β может выродиться в такую диаграмму (рис. 16, б), в которой предельная растворимость на основе компонента В уменьшена до нуля, эвтектическая точка настолько сдвинута вправо, что «эвтектика» состоит из 100% В, а «эвтектическая» температура по существу является температурой плавления В.
Из рис. 17 видно, что перитектическая диаграмма (рис. 17, а) в результате перемещения состава нестойкого химического соединения М вправо до точки р вырождается в диаграмму (рис. 17, б), в которой жидкая фаза состава р затвердевает при постоянной температуре с образованием соединения М. Нетрудно понять, что «перитектическая» температура в данном случае является температурой плавления (затвердевания) фазы М. Диаграмму (см. рис. 17, б) можно рассматривать, как состоящую из двух частей: А — М и М — В, причем диаграмма А — М не отличается от изображенной на рис. 16, б.
Из рис. 18 видно, каким образом при смещении точки а вправо и совмещении ее с точкой е можно получить «эвтектику», состоящую из 100% твердого раствора состава α1. В данном случае предельный твердый раствор α1 плавится при постоянной «эвтектической» температуре (рис. 18, б).
То же можно сказать о вырождении перитектики. Совмещение точек р и а на рис. 19 приводит к тому, что при постоянной «перитектической» температуре плавится (или затвердевает) твердый раствор предельного состава α1. Формальное описание таково: фаза α1 образуется при охлаждении из 100% жидкости состава р и 0% фазы β1. Сравнение правых частей рис. 18, б и рис. 19, 6 показывает, что они одинаковы. В данном случае различие между «вырожденной эвтектикой» и «вырожденной перитектикой» чисто условно. Оно скорее характеризует левую (сигарообразную) часть диаграммы. Если она опускается слева направо (см. рис. 18, б), то можно считать линию аЬ эвтектической, а если поднимается (см. рис. 19, б), то - перитектической.
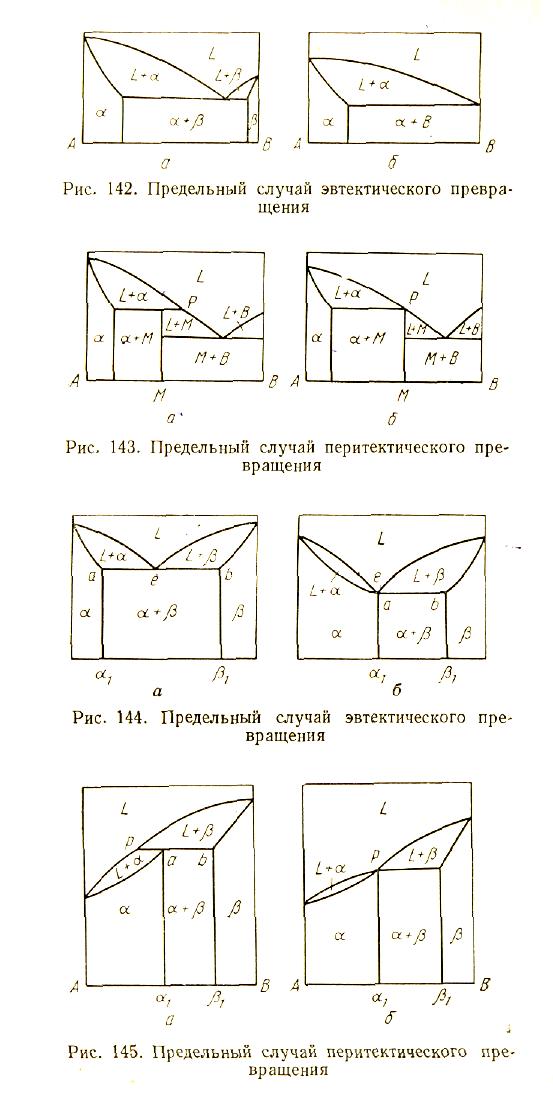
Рис. 16. Предельный случай эвтектического превращения
Рис. 17. Предельный случай перитектического превращения
Рис. 18. Предельный случай эвтектического превращения
Рис. 19. Предельный случай перитектического превращения
На рис. 20 – 25 даны диаграммы состояния различных сплавов для выполнения задания.

Рис. 20. Диаграмма состояния железо-азот

Рис. 21. Диаграмма состояния сплавов вольфрам-рений

Рис. 22. Диаграмма состояния медь-цинк
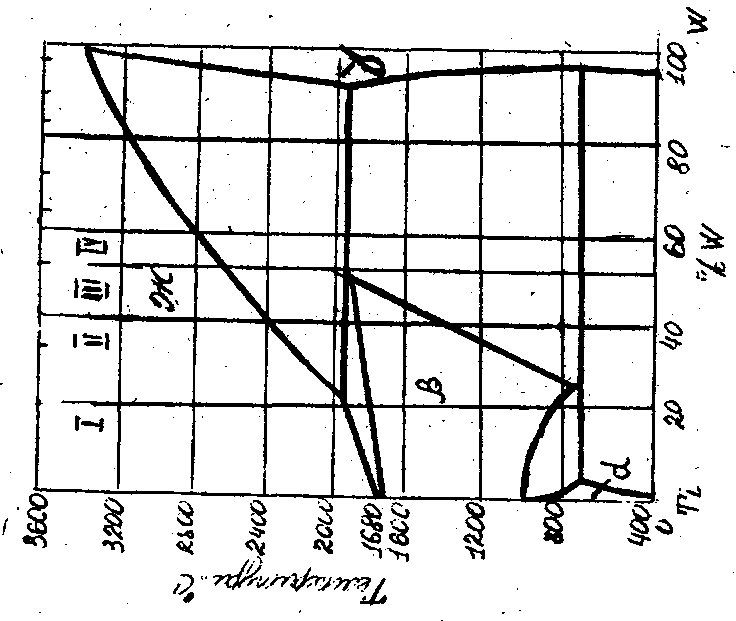
Рис. 23. Диаграмма состояния сплавов титан-вольфрам
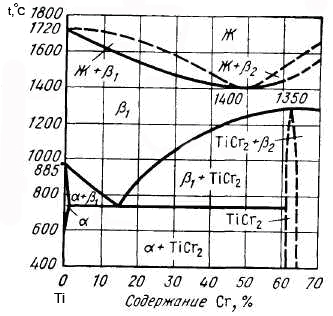
Рис. 24. Диаграмма состояния сплавов титан-хром

Рис. 25. Диаграмма состояния сплавов олово-сурьма
Задание
1. Ознакомьтесь с устройством и работой оборудования и приборов для построения кривых охлаждения сплавов.
2. Изучите назначение и сущность термического метода построения диаграмм состояния.
3. Начертите заданную диаграмму состояния.
4. Проведите фазовый анализ всех областей и определите количественное соотношение фаз при заданной температуре.
5. Опишите все изотермические превращения и заданной диаграмме.
6. Во всех областях диаграммы укажите структуры, образующиеся в сплавах данной системы в состоянии равновесия.
7. Постройте кривую охлаждения для заданной концентрации X и объясните превращения, происходящие в процессе охлаждения.
8. Определите количественное соотношение структурных составляющих сплава при комнатной температуре и зарисуйте структуру.
9. Пользуясь правилом фаз Гиббса, постройте в координатах температура – время кривые охлаждения для выбранного вами сплава.
10. Объясните все превращения в исследуемых сплавах при охлаждении и нагреве.
11. По заданной температуре в двухфазной области найдите химический состав и массу сосуществующих фаз.
12. Составьте отчет.
Контрольные вопросы
1. Дайте определение диаграммы состояния сплавов.
2. Что называется компонентом, фазой?
3. Сформулируйте правило фаз Гиббса; что означает С=0 и С=1?
4. Поясните известные Вам типы диаграмм состояния двойных сплавов.
5. Как определяется химический состав и масса фаз в двухфазных областях диаграмм состояния?
6. Что такое диаграммы свойств Курнакова?
7. Что означают «критические точки» на кривых охлаждения?
8. На чем основан принцип определения температуры с помощью термических пар?
9. Что позволяет определить диаграмма состояния?
10. Что показывают и характеризуют диаграммы состояния?
11. Какие структуры получаются по диаграмме состояния с ограниченной растворимостью компонентов и эвтектикой?
12. Какие структуры получаются по диаграмме состояния с перитектикой?
13. Как будет выглядеть перитектический сплав после кристаллизации?
