
- •Часть 1
- •Лабораторная работа №1 исследование структуры металлов и сплавов с помощью светового микроскопа
- •Лабораторная работа №2 методы количественной металлографии
- •Лабораторная работа №3 структурные и фазовые превращения в твердом состоянии
- •Лабораторная работа №4 анализ диаграмм состояния двойных систем
- •14. Как будет выглядеть эвтектический сплав после кристаллизации?
- •Часть 1
- •394026 Воронеж, Московский просп., 14
Лабораторная работа №3 структурные и фазовые превращения в твердом состоянии
Цель работы: изучить структурные и фазовые превращения металлов в твердом состоянии.
Оборудование и материалы: микроскоп МИМ-7 или МИМ-8М, микрошлифы армко-железа.
Превращения в твердом состоянии. Полиморфизм
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а следовательно, реально существующим типом, является решетка, обладающая наиболее низким запасом свободной энергии. Так, например, в твердом состоянии литий, натрий, калий, рубидий, цезий, молибден, вольфрам и другие металлы имеют объемноцентрированную кубическую решетку; алюминий, кальций, медь, серебро, золото, платина и др. — гранецентрированную, а бериллий, магний, цирконий, гафний, осмий и некоторые другие — гексагональную.
Однако в ряде случаев при изменении температуры или давления может оказаться, что для того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре или давлении. Так, например, существует железо с решетками объемноцентрированного и гранецентрированного кубов; обнаружен кобальт с гранецентрированной и с гексагональной решетками. В различных решетках кристаллизуются также олово, марганец, титан и некоторые другие металлы.
Существование одного металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии. Различные кристаллические формы одного вещества называются полиморфными, или аллотропическими модификациями.
Небольшие изменения давления, которые могут возникать в практике, обычно не приведут к полиморфным превращениям. Поэтому для практического металловедения важна главным образом температурная аллотропия.
В табл. 2 показан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
Аллотропические формы обозначаются греческими буквами α, β, γ и т.д., которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая — через β и т. д.
Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой (в координатах температура - время) превращение отмечается горизонтальным участком (рис. 4).
Таблица 2
Аллотропические формы металлов
Металл (элемент) |
Аллотропическая форма |
Интервал температур устойчивого состояния, 0С |
Кристаллическая решетка |
Fe |
α
γ |
˂911
1392 – 1539 911 - 1392 |
Кубическая объемноцентрированная (К8) Кубическая гранецентрированная (К 12) |
Со |
α β |
˂450 450 - 1480 |
Гексагональная (Г 12) Кубическая гранецентрированная (К12) |
Sn |
α β |
˂18 18 - 232 |
Решетка алмаза Тетрагональная объемноцентрированная |
Мп |
α
β γ
δ |
˂700
700-1079 1079 – 1143
1143 - 1244 |
Кубическая сложная многоатомная То же Тетрагональная гранецентрированная Кубическая объемноцентрированная (К8) |
Ti |
α β |
˂882 882 - 1660 |
Гексагональная (Г12) Кубическая объемноцентрированная (К8) |
Zr |
α β |
˂867 867 - 1860 |
Гексагональная (Г12) Кубическая объемноцентрированная (К8) |
U |
α β γ |
˂668 668 – 720 720 – 1132 |
Орторомбическая Тетрагональная Кубическая объемноцентрированная (КЗ) |
Т
Рис. 4. Кривые охлаждения и нагрева металла, имеющего аллотропические превращения
При охлаждении происходит выделение тепла (выделение скрытой теплоты превращения) теоретически при такой же температуре, что и при нагреве, но практически при несколько более низкой вследствие переохлаждения.
Явление полиморфизма основано на приведенном выше едином законе об устойчивости состояния с наименьшим запасом энергии.
Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом — модификация β и т. д. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного (аллотропического) превращения. Так, железо имеет две температуры полиморфного превращения: 911 и 1392°С. На рис. 5 показана кривая охлаждения железа.
Новые аллотропические формы образуются в результате зарождения центров и роста кристаллов аналогично кристаллизации из жидкого состояния. Кривые зависимости с. к. и ч. ц. от степени переохлаждения для аллотропического превращения имеют тот же вид, что и для кристаллизации из жидкого состояния. Следует отметить большую склонность к переохлаждению при аллотропических превращениях в твердом состоянии.
 t
t
Рис. 5. Кривая охлаждения железа
В качестве общей закономерности можно указать, что высокотемпературная модификация, как правило, имеет более простое атомно-кристаллическое строение и более высокую пластичность.
Аллотропические превращения различных металлов имеют свои особенности.
Аллотропия олова. Олово существует в двух модификациях. Ниже +18 °С устойчиво так называемое серое α -олово. При охлаждении α-олово появляется на обыкновенном белом олове (β -модификация) в виде отдельных бугорков на поверхности (так называемая «оловянная чума»). Решетка белого олова с координационным числом 6 в полтора раза компактнее решетки серого олова, имеющего решетку алмаза с координационным числом 4. Поэтому превращение белого олова в серое сопровождается увеличением объема примерно на 25%. Серое олово представляет собой серый порошок, не обладающий металлическими свойствами. Хотя температура равновесия Snα ↔ Snβ равна +18°С, превращение при этой и немного более низкой температуре происходит с весьма малой скоростью. Максимальное значение с. к, получается при переохлаждении п = 50 °С (т. е. при минус 32 °С), когда с. к. превращения α ↔ β равняется 0,004 мм в час. Ввиду столь малой скорости превращения β-олово весьма склонно к переохлаждению и сравнительно длительное время может сохраняться при температурах ниже 18 °С.
Аллотропия железа. Ниже 911 °С железо существует в форме α; при 911 °С объемноцентрированная решетка Feα переходит в гранецентрированную решетку Feγ, которая при 1392 °С вновь превращается в объемноцентрированную α -решетку (рис. 5). Высокотемпературную α-модификацию иногда обозначают буквой δ.
Таким образом, одна и та же решетка у железа (кубическая объемноцентрированная) устойчива в двух интервалах температур. Превращение γ ↔α сопровождается уменьшением координационного числа кристаллической решетки и уменьшением компактности. Если бы это уменьшение не компенсировалось в значительной степени уменьшением атомного радиуса, то железо должно было бы при превращении γ ↔α увеличиваться в объеме на 9 %. На самом деле (благодаря уменьшению атомного радиуса) объем железа увеличивается при этом примерно на 1 %. Следует отметить, что структурные напряжения, вызванные даже этим незначительным увеличением объема, имеют большое значение.
При 768 °С получается остановка на кривой охлаждения, связанная не с перестройкой решетки, а с изменением магнитных свойств. Выше 768 °С α -железо немагнитно (немагнитное α -железо называют иногда β -желеэом). Ниже 768 °С железо ферромагнитно.
Магнитные превращения. Некоторые металлы (железо, кобальт, никель) отличаются специфическими магнитными свойствами, например способностью хорошо намагничиваться. Эти свойства называются ферромагнитными. Однако при нагреве ферромагнитные свойства металла постепенно теряются. П. Кюри показал, что полная потеря ферромагнитных свойств получается при определенной температуре, названной в дальнейшем точкой Кюри.
Как видно из рис. 6, интенсивность намагничивания с повышением температуры постепенно снижается, и точка Кюри соответствует окончательной потере ферромагнетизма.
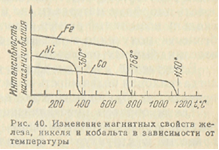
Рис. 6. Изменение магнитных свойств железа, никеля и кобальта в зависимости от температуры
Магнитное превращение имеет ряд особенностей, отличающих его от аллотропического превращения.
Во-первых, магнитные свойства постепенно падают по мере приближения к точке превращения, и эта точка не отвечает скачкообразному изменению свойств. Во-вторых, магнитное превращение не имеет температурного гистерезиса. Увеличение скорости охлаждения не снижает температуры превращения. В-третьих, механические и некоторые физические свойства при превращении не изменяются (изменяются многие электрические магнитные и тепловые свойства). Наконец, в-четвертых, самое важное, магнитное превращение не сопровождается перекристаллизацией — образованием новых зерен и изменением решетки.
Эти особенности существенно отличают магнитное превращение от аллотропического. Типичными для аллотропического превращения являются изменение кристаллической решетки, перекристаллизация и тепловой гистерезис превращения.
Магнитное превращение не сопровождается ни одним из этих явлений. Следовательно, магнитное превращение есть особый вид превращения, принципиально отличный от аллотропического.
Согласно современным представлениям при магнитных превращениях происходит изменение не в кристаллической структуре металла, а во взаимодействии внешних и внутренних электронных оболочек атомов.
Задание
Изучить явление аллотропии.
Записать аллотропические формы металлов, предложенных преподавателем.
3. Описать сущность магнитного превращения.
4. Зарисовать кривую охлаждения железа с указанием изменения магнитных свойств.
5. Рассмотреть микроструктуру армко-железа и зарисовать ее.
Контрольные вопросы
1. Что такое полиморфизм?
2. Что такое аллотропическая модификация?
3. Как происходит превращение одной аллотропической формы в другую?
4. Как происходит аллотропия олова?
5. Как происходит аллотропия железа?
6. Какие свойства металла называются ферромагнитными?
7. Назовите особенности магнитного превращения?
8. Что происходит в структуре металлов при магнитном превращении?
