Лекции / Лекции_32
.DOC
Лекция №32
МНОГОАТОМНЫЕ СПИРТЫ. ДИОЛЫ
План.
Классификация. Номенклатура.
Способы получения.
Химические свойства.
Многоатомные спирты – производные алканов, в которых два или большее число атомов водорода при различных углеродных атомах замещены на гидроксильную группу. Если многоатомные спирты содержат две гидроксильные группы, то они называются диолами или гликолями. Если они содержат три гидроксильные группы, то они называются триолами. Общее название многоатомных спиртов – полиолы. Наиболее важными из многоатомных спиртов являются диолы.
Диолы. Классификация. Номенклатура
В зависимости от взаимного расположения
гидроксильных групп различают 1,2–
диолы, 1,3–диолы, 1,4–диолы и т.д. У
1,2–диолов группы ОН расположены у двух
соседних углеродных атомов, например,
зависимости от взаимного расположения
гидроксильных групп различают 1,2–
диолы, 1,3–диолы, 1,4–диолы и т.д. У
1,2–диолов группы ОН расположены у двух
соседних углеродных атомов, например,
У 1,3–диолов группы ОН расположены при атомах углерода, находящихся в 1,3–положении по отношению друг к другу, например, HOCH2CH2CH2OH. У 1,4– диолов группы ОН расположены при атомах углерода, находящихся в 1,4–положении по отношении друг к другу. 1,2- ,1,3– и 1,4–диолы иногда называют - ,- и - гликолями соответственно.
При образовании названий диолов используют номенклатуру IUPAC и тривиальную номенклатуру. В системе IUPAC пользуются общими правилами этой номенклатуры, в тривиальной номенклатуре диолы часто называют гликолями.
Примеры названий диолов представлены ниже.
Структурные формулы |
Название по номенклатуре IUPAC |
Тривиальное название |
HOCH2CH2OH HOCH2CH2CH2OH HOCH2CH2CH2CH2OH
|
Этандиол - 1,2 Пропандиол – 1,3 Бутандиол – 1,4
2,3 – диметилбутандиол – 2,3
|
Гликоль, этиленгликоль 1,3 – пропиленгликоль 1,4 – бутиленгликоль
Пинакон |
Способы получения гликолей
Г
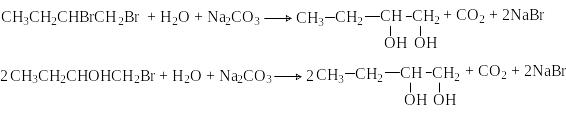 идролиз
дигалогеналканов или галогенгидринов
идролиз
дигалогеналканов или галогенгидриновГ
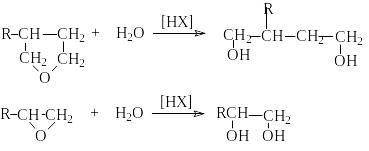 идратация
циклических эфиров
идратация
циклических эфиров
О
 кисление
алкенов пероксидом водорода или
перманганатом калия
кисление
алкенов пероксидом водорода или
перманганатом калияК
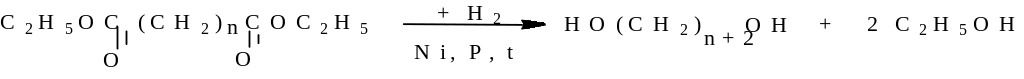 аталитическое
восстановление эфиров дикарбоновых
кислот.
аталитическое
восстановление эфиров дикарбоновых
кислот.
Физические свойства гликолей
Низшие члены ряда – густые жидкости, высшие – кристаллические вещества. Температуры кипения гликолей выше, чем температуры кипения спиртов близкой молекулярной массы. Низшие гликоли хорошо растворимы в воде. Растворимость гликолей в воде выше, чем растворимость близких им по молекулярной массе спиртов. Эти факты объясняются двумя причинами. Во–первых, наличие двух спиртовых функций обусловливает большее число межмолекулярных водородных связей, образуемых молекулами гликолей, во–вторых, эти связи прочнее, так как одна спиртовая группа действует на другую как акцептор, увеличивая ее кислотность. Гликоли имеют сладковатый вкус, плотность большинства из них больше 1.
Химические свойства гликолей
Химические свойства гликолей аналогичны свойствам одноатомных спиртов. Они могут вступать в химические взаимодействия как одной, так и двумя гидроксильными группами.
1) Кислотность
Г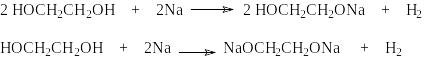 ликоли
обладают более высокой кислотностью
по сравнению с одноатомными спиртами.
Поэтому они также, как и последние, легко
вступают во взаимодействие со щелочными
металлами,
ликоли
обладают более высокой кислотностью
по сравнению с одноатомными спиртами.
Поэтому они также, как и последние, легко
вступают во взаимодействие со щелочными
металлами,
и![]() в отличие от одноатомных спиртов,
реагируют со щелочами
в отличие от одноатомных спиртов,
реагируют со щелочами
и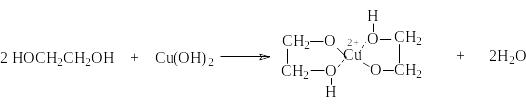 некоторыми основными гидроксидами
некоторыми основными гидроксидами
Последняя реакция легко наблюдается как растворение Сu(OH)2 с образованием синего раствора. Эта реакция является качественной на многоатомные спирты.
2 )
Образование полных и неполных эфиров
с неорганическими и органическими
кислотами.
)
Образование полных и неполных эфиров
с неорганическими и органическими
кислотами.
Е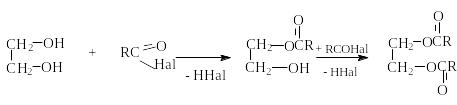 сли
в качестве этерифицирующих агентов
используются ангидриды и хлорангидриды
карбоновых кислот, то реакции этерификации
диолов протекают необратимо:
сли
в качестве этерифицирующих агентов
используются ангидриды и хлорангидриды
карбоновых кислот, то реакции этерификации
диолов протекают необратимо:
3) Окисление диолов
Процесс окисления диолов протекает обычно по сложной схеме, включающей последовательные и параллельные реакции.
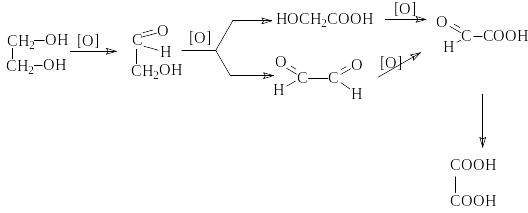
гликолевая к - та
глиоксиловая
гликолевый кислота
альдегид глиоксаль
щавелевая
кислота
П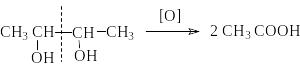 ри
этом, как и в случае одноатомных спиртов,
по продуктам окисления можно судить о
структуре диола. Так, если при окислении
диола состава C4H8(OH)2
в продуктах окисления обнаруживается
только уксусная кислота, то диол может
иметь только формулу 2,3 – бутандиола.
ри
этом, как и в случае одноатомных спиртов,
по продуктам окисления можно судить о
структуре диола. Так, если при окислении
диола состава C4H8(OH)2
в продуктах окисления обнаруживается
только уксусная кислота, то диол может
иметь только формулу 2,3 – бутандиола.
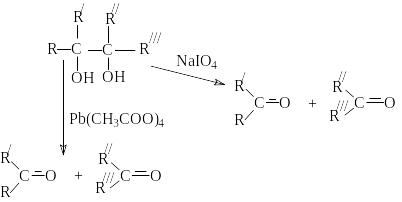
В этом плане характерной реакцией окисления, являющейся тестом на установление структуры 1,2–диолов (-гликолей), является реакция Малапрада, в которой в качестве окислителей используется тетраацетат свинца или периодат натрия.
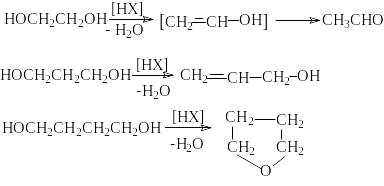
4) Дегидратация
Реакции дегидратации диолов могут иметь межмолекулярный или внутримолекулярный характер. Эти реакции относятся к реакциям нуклеофильного замещения. Поэтому для электрофильного отщепления «плохой» уходящей группы – OH требуется кислотный катализ.
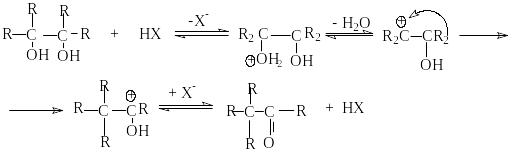
С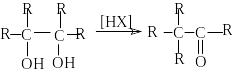 воеобразным
типом дегидратации является пинаколиновая
перегуппировка.
воеобразным
типом дегидратации является пинаколиновая
перегуппировка.
Пинаколиновая перегруппировка является типичной реакцией перегруппировки карбкатионов, которые образуются при протонировании пинаконов.